许多小细胞肺癌患者复发时身体状况较好,但很少有抗肿瘤药物保证患者较好体能状态的同时又能够抑制肿瘤发展。敏感性复发的小细胞肺癌患者常用化疗药物有拓扑替康、伊立替康、长春瑞滨、紫杉醇和吉西他滨等[1-4]。早些年在治疗小细胞肺癌的药物中,最常用的二线化疗药物是拓扑替康,但拓扑替康治疗敏感性复发型小细胞肺癌的有效率仅为18%,难治性复发型小细胞肺癌的有效率低于10%[5]。近年研究发现紫杉醇和吉西他滨单独治疗小细胞肺癌患者的疗效较好[4,6]。由于不同的药物活性、不同的作用机制和不重叠的毒性反应,紫杉醇和吉西他滨联合使用也许会更有利于药物的相互作用[7]。紫杉醇能够显著降低吉西他滨的总清除率和分布容积,并且显著增加吉西他滨的稳态浓度。当吉西他滨与紫杉醇联合使用治疗小细胞肺癌时并没有观察到吉西他滨在个体间和个体内存在药动学参数差异[7]。因此本研究选择紫杉醇联合吉西他滨与紫杉醇单独治疗小细胞肺癌,评估曾接受一线铂化疗的小细胞肺癌患者进行二线化疗的临床疗效。
1 方法 1.1 资料来源选取2010年1月—2012年12月宝鸡市中医医院收治的、病理组织学确诊且经过一线含铂化疗治疗过的小细胞肺癌患者78例。其中男68例,女10例;年龄38~75岁,平均年龄(67±6.5)岁;病程0.5~1.5年,平均病程(1.0±0.3)年。
纳入标准:患者年龄大于18岁;卡氏评分70~90分;一线化疗为铂相关化疗;一线治疗停止时间大于28 d;所有患者签署知情同意书;此项研究通过医院伦理道德委员会批准。
排除标准:主要器官如肝、肾、心脏和骨髓等功能异常的患者;病灶部位进行过放疗的患者;病灶部位接受过铂除外的其它化疗的患者。
1.2 分组和治疗方法所有患者随机分为对照组和治疗组,每组各39例。对照组男33例,女6例;年龄38~75岁,平均年龄(65±5.2)岁;病程0.5~1.2年,平均病程(0.8±0.4)年;小细胞肺癌复发23例,转移16例;吸烟37例;一线伊立替康/铂化疗33例,一线依托泊苷/铂化疗6例。治疗组男35例,女4例;年龄41~74岁,平均年龄(69±7.8)岁;病程0.8~1.5年,平均病程(1.2±0.2)年;小细胞肺癌复发30例,转移9例;吸烟36例;一线伊立替康/铂化疗35例,一线依托泊苷/铂化疗4例。两组患者的基线资料比较差异无统计学意义,具有可比性。
对照组患者静脉滴注紫杉醇注射液(辰欣药业股份有限公司,规格10 mL∶60 mg,产品批号20090701)80mg/m2,第1天静脉滴注3 h。治疗组患者在对照组基础上静脉滴注注射用盐酸吉西他滨(江苏豪森药业集团有限公司,规格0.2 g/瓶,产品批号20090830)1 000 mg/m2,第1、8天静脉滴注不超过1 h。在静脉滴注紫杉醇注射液前使用地塞米松(10~20 mg)、苯海拉明(45.5 mg)和法莫替丁(20 mg)进行预处理。每21天为一个周期,完成2个周期以上化疗且有效者继续进行,完成4个周期化疗者不再维持。化疗期间每2个月复查1次,病情变化者随时复诊。随访时间为1~35个月。
1.3 临床疗效评价标准根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)客观评价肿瘤化疗疗效[7]。现有的所有病变完全消失或3个月内没有新的病灶为完全缓解(CR);患者转移性病变减少50%以上为部分缓解(PR);肿瘤缩小大于25%但小于50%,且患者无新病灶出现为稳定(SD);患者肿瘤减小小于25%、肿块变大或有新病灶出现为疾病进展(PD)。计算客观缓解率和疾病控制率。
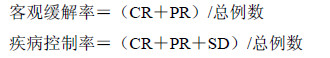
|
根据NCI-CTCAE v4.0[8]评价患者的毒性反应(贫血、白细胞减少、中性粒细胞减少、血小板减少、感染、恶心呕吐、腹泻、黏膜炎、脱发、尿素氮、周围神经毒性等)。毒性反应分级:0级为正常,1级为轻度毒性,2级为中度毒性,3级为重度毒性,4级为威胁生命或不能活动的毒性,5级死于毒性。
1.5 观察指标统计总生存期(开始对患者进行治疗到患者死亡的时间跨度)、无进展生存期(开始对肿瘤进行治疗到肿瘤出现继发性生长的时间跨度),计算总生存率(一定生存期内存活例数与总例数的比值)、无进展生存率(一定生存期内肿瘤未出现继发性生长的例数与总例数的比值)[7-8]。
1.6 统计分析使用SPSS 18.0软件对数据进行统计分析,计量资料以x±s的形式表示,组间比较采用独立样本的t检验。计数资料以百分比进行表示,组间比较采用χ2检验。分析95%置信区间(95% CI)。使用Kaplan-Meler法计算生存率。
2 结果 2.1 两组患者临床近期疗效比较治疗后,对照组CR 0例,PR 5例,SD 12例,客观缓解率为12.82%,疾病控制率为12.82%;治疗组CR 0例,PR 15例,SD 7例,客观缓解率为38.46%,疾病控制率为56.41%,两组比较差异具有统计学意义(P<0.05),见表 1。
| 表 1 两组患者临床近期疗效比较 Table 1 Comparison on clinical short-term efficacy between two groups |
2.2 两组患者毒性反应比较
化疗过程中,对照组全部39例患者完成4个周期的化疗,治疗组9例患者完成3个周期的化疗,30例患者完成4个周期的化疗。与对照组比较,治疗组白细胞减少、中性粒细胞减少和血小板减少发生率显著降低(P<0.05),其他毒副反应虽然也低于对照组,但差异无显著性。对照组39例患者中少数患者出现轻微的Ⅰ级或Ⅱ级毒性反应,并无Ⅲ~Ⅴ级毒性反应出现,见表 2。
| 表 2 两组患者毒性反应比较 Table 2 Comparison on adverse reactions between two groups |
2.3 两组患者生存率比较
治疗组中位总生存期是31周(95% CI,23.44~38.56),一年生存率为40.3%;对照组中位总生存期是19周(95% CI,7.57~16.44),一年生存率为22.1%。与对照组比较,治疗组患者的总生存率、无进展生存率差异具有统计学意义(P<0.05)。见表 3。
| 表 3 两组患者生存率比较(x± s,n=39) Table 3 Comparison on survival rates between two groups(x± s,n=39) |
3 讨论
如果一线化疗结束后只进行最佳支持治疗将导致小细胞肺癌的中位生存期为14周。与最佳支持治疗比较,二线化疗增加了患者生存期,并且更好地控制了小细胞肺癌的症状[9-10]。有研究表明敏感性小细胞肺癌二线治疗的有效率约为50%,二线治疗的中位生存期为24周左右;难治性疾病患者对于二线治疗的有效率小于10%,二线治疗的中位生存期为16周左右;而且联合化疗治疗小细胞肺癌的有效率要高于单独药物化疗的有效率[11]。
吉西他滨是新型细胞周期特异性抗肿瘤药物,主要通过阻滞细胞周期从G1期向S期进展,进而减少肿瘤细胞的增殖,另外也可以促进肿瘤细胞凋亡的发生[12]。紫杉醇是第2代抗肿瘤药物,其作用机制是破坏微管蛋白二聚体之间的动态平衡,使微管聚合成团块和束状,从而抑制微管网的正常重组,最终阻断细胞周期的M期和G2期,抑制肿瘤细胞的增殖[12-13]。已有研究显示,紫杉醇联合吉西他滨治疗顺铂和依托泊苷预处理后的小细胞肺癌患者,3周为1个周期,在第1、8、15天注射紫杉醇(80 mg/m2),第1、8天注射吉西他滨(1 000 mg/m2),总有效率为26%,其中难治性小细胞肺癌有效率为20%,敏感性小细胞肺癌的有效率为28.6%。敏感性小细胞肺癌的有效率略高于难治性小细胞肺癌,这说明紫杉醇联合吉西他滨化疗方案更适合于敏感性小细胞肺癌[14]。本研究结果发现紫杉醇联合吉西他滨化疗后客观缓解率为38.5%,高于紫杉醇单独化疗组,这说明该治疗方案是有研究应用价值的。而且已有研究表明紫杉醇联合吉西他滨治疗小细胞肺癌的临床疗效强于氨柔比星联合拓扑替康化疗的疗效[15]。
在小细胞肺癌临床治疗中,二线化疗治标不治本,所以在选择二线化疗方案时要考虑患者的生存质量、毒性反应和治疗成本[10]。对于已经接受铂相关一线化疗的小细胞肺癌患者来说,在二线治疗中要考虑到毒性的积累。在本研究中紫杉醇联合吉西他滨治疗后出现的中性粒细胞减少,其他毒性反应都是在可控范围内的。
综上所述注射用盐酸吉西他滨联合紫杉醇注射液治疗接受一线铂类化疗的、复发转移性小细胞肺癌具有较好的临床疗效,具有一定的临床推广应用价值。
| [1] |
Ardizzoni A, Tiseo M, Boni L. Validation of standard definition of sensitive versus refractory relapsed small cell lung cancer: a pooled analysis of topotecan second-line trials[J].
Eur J Cancer,2014, 50 (13) : 2211-2218.
( 0) 0)
|
| [2] |
Morise M, Niho S, Umemura S, et al. Low-dose irinotecan as a second-line chemotherapy for recurrent small cell lung cancer[J].
Jpn J Clin Oncol,2014, 44 (9) : 846-851.
( 0) 0)
|
| [3] |
Higashiyama M, Okami J, Maeda J, et al. Differences in chemosensitivity between primary and paired metastatic lung cancer tissues: In vitro analysis based on the collagen gel droplet embedded culture drug test (CD-DST)[J].
J Thorac Dis,2012, 4 (1) : 40-47.
( 0) 0)
|
| [4] |
Dazzi C, Cariello A, Casanova C, et al. Gemcitabine and paclitaxel combination as second-line chemotherapy in patients with small-cell lung cancer: a phase II study[J].
Clin Lung Cancer,2013, 14 (1) : 28-33.
( 0) 0)
|
| [5] |
Eckardt J R. Topotecan in relapsed small-cell lung cancer: can good things come in small packages?[J].
Clin Lung Cancer,2003, 4 (4) : 229-230.
( 0) 0)
|
| [6] |
Yananoto N, Tsurutani J, Yoshimura N, et al. Phase II study of weekly paclitaxel for relapsed and refractory small cell lung cancer[J].
Anticancer Res,2006, 26 (1B) : 777-781.
( 0) 0)
|
| [7] |
Yun T, Kin H T, Han J Y, et al. A Phase II Study of weekly paclitaxel plus gemcitabine as a second-line therapy in patients with metastatic or recurrent small cell lung cancer[J].
Cancer Res Treat,2015, 48 (2) : 465-472.
( 0) 0)
|
| [8] |
National Cancer Institute Common Terminology Criteria for Adverse Events version 4.0 [DB/OL]. (2010-06-14) [2011-02-21]. http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE4.03_2010-06-14_QuickReference_5x7.pdf.
( 0) 0)
|
| [9] |
Martins R G, Reynolds C H, Riely G J. Beyond "second-line" in non-small cell lung cancer: therapy and supportive care[J].
Am Soc Clin Oncol Educ Book,2015 : e414-e418.
( 0) 0)
|
| [10] |
李治桦, 刘晓晴, 李俭杰, 等. 二线不同化疗方案治疗小细胞肺癌的疗效和安全性比较[J].
中国肺癌杂志,2015, 18 (5) : 280-288.
( 0) 0)
|
| [11] |
Nair B S, Bhanderi V, Jafri S H. Current and emerging pharmacotherapies for the treatment of relapsed small cell lung cancer[J].
Clin Med Insights Oncol,2011, 5 : 223-234.
( 0) 0)
|
| [12] |
李娜, 韩子阳, 郑斌. 紫杉醇脂质体或吉西他滨联合顺铂治疗晚期非小细胞肺癌的临床研究[J].
中国临床药理学杂志,2014, 30 (12) : 1083-1085.
( 0) 0)
|
| [13] |
王宝强, 周陈华. 紫杉醇联合顺铂同步放化疗治疗局部晚期非小细胞肺癌的临床疗效及安全性评价[J].
中国临床药理学杂志,2015, 34 (08) : 603-605.
( 0) 0)
|
| [14] |
Dongiovanni V, Buffoni L, Berruti A, et al. Second-line chemotherapy with weekly paclitaxel and gemcitabine in patients with small-cell lung cancer pretreated with platinum and etoposide: a single institution phase II trial[J].
Cancer Chemothe Pharmacol,2006, 58 (2) : 203-209.
( 0) 0)
|
| [15] |
von Pawel J, Jotte R, Spigel D R, et al. Randomized phase III trial of amrubicin versus topotecan as second-line treatment for patients with small-cell lung cancer[J].
J Clin Oncol,2014, 32 (35) : 4012-4019.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

