卡铂是第2代金属铂类抗肿瘤药物,具有抗肿瘤活性强、毒性低等特点,是周期非特异性抗肿瘤药物,直接作用于脱氧核糖核酸(DNA),从而抑制分裂旺盛的肿瘤细胞。其肾毒性轻微且不常见,耳毒性和神经毒性罕见,骨髓抑制比顺铂强,是剂量限制性毒性。目前临床主要用于治疗实体瘤,如小细胞肺癌、卵巢癌、睾丸肿瘤、头颈部癌及恶性淋巴瘤等;也适用于其他肿瘤,如子宫颈癌、膀胱癌及非小细胞癌等[1]。血清白蛋白是血浆中最丰富的蛋白质,能与大量内源和外源性药物发生相互作用,是重要的载体蛋白。药物分子进入体内后,与血清白蛋白结合,进而在血浆中储存、运输,从而到达靶部位,发挥其药理作用[2]。牛血清白蛋白(bovine serum albumin,BSA)常作为模型蛋白用于研究药物与白蛋白相互作用。通过研究药物与BSA相互作用的热力学特征,测定BSA荧光强度、峰位和荧光寿命的变化等来探索药物与BSA相互作用机制、BSA构型的变化及药物的药理作用。本实验采用荧光光谱法和同步荧光光谱法,在模拟人体生理条件下,探讨卡铂对BSA的荧光猝灭机制、结合常数、结合位点数、作用力类型和两者相互作用后对BSA构象的影响。
1 仪器和试剂F-7000荧光光度计(日本日立公司);电热恒温水槽(上海精宏实验设备有限公司);GR-202型电子天平(日本AND公司);Biohit加样器(芬兰百得公司);pHS-3C数字酸度计(上海光学仪器厂)。
BSA(美国Sigma公司,质量分数≥99%,平均相对分子质量68 000);卡铂(上海哈灵生物科技有限公司,质量分数≥98%,批号100322-201102);其他试剂均为分析纯;实验用水为二次蒸馏水。
2 方法与结果 2.1 试验方法用PBS缓冲溶液将BSA配制成1.16×10-5 mol/L储备液,用PBS缓冲溶液将卡铂配制成15.8 μmol/L溶液,分别在系列10 mL量瓶移取1.0 mL BSA溶液和不同体积(0、10、20、30、40、50、60 μL)卡铂溶液,用PBS缓冲溶液加至刻度,混合均匀,分别置于恒温(298、303、308 K)水浴中30 min。准确移取3 mL混合溶液于石英比色皿中,以280 nm为激发波长,在荧光光度计上记录290~500 nm波长范围内的发射光谱,即得荧光光谱。测定308 K待测液,分别在△λ=15、60 nm下扫描荧光激发光谱,得到BSA中酪氨酸残基和色氨酸残基的同步荧光光谱。
2.2 卡铂与BSA相互作用的荧光猝灭机制BSA具有较强的内源性荧光,主要由分子中的酪氨酸残基(Tyr)、色氨酸残基(Trp)和苯丙氨酸残基(Phe)产生[3]。固定BSA浓度,测定不同浓度的卡铂与BSA相互作用的荧光光谱,见图 1。可见随着卡铂浓度的增加,BSA的荧光强度有规律地降低,其峰形基本不变,但是最大荧光峰的峰位发生明显红移。表明卡铂与BSA发生相互作用,使BSA分子中荧光基团及其所处微环境发生改变,推测卡铂与BSA结合形成不发光的荧光复合物。
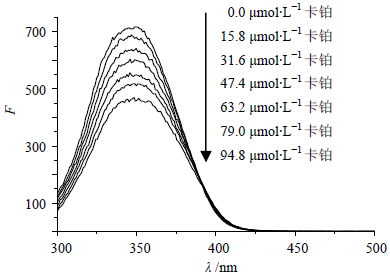
|
图 1 308 K时卡铂对BSA荧光猝灭图 Fig. 1 Fluorescence spectra of cisplstin on BSA at 308 K |
荧光猝灭是不同的分子间相互作用,导致荧光基团的荧光量子化产率减少,缩短发光分子激发态寿命[4]。药物小分子对BSA猝灭机制主要是静态猝灭和动态猝灭两种[5, 6]。动态猝灭是猝灭剂和荧光物质的激发态分子之间发生碰撞,引起荧光物质减弱的过程,引起动态猝灭的主要原因是电子转移和分子间的有效碰撞,温度升高加速分子间的有效碰撞,使动态猝灭常数增加;对于静态猝灭过程,随着温度升高,基态复合物的稳定性降低,猝灭常数会随之减小。动态猝灭过程遵循Stern-Volmer方程[7]:
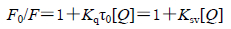
|
(1) |
F0和F分别为加入卡铂之前和加入卡铂之后BSA的荧光强度,Kq是双分子猝灭速率常数,τ0为卡铂不存在时荧光物质的平均寿命,生物大分子荧光平均寿命大约为1×10−8 s,Ksv是动态猝灭常数,[Q]为卡铂的浓度。以F0/F对卡铂浓度[Q]作图,见图 2。
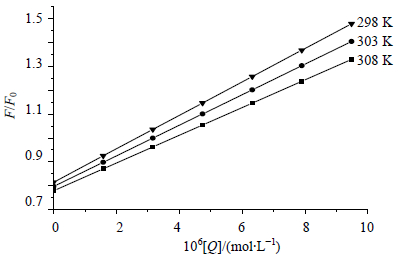
|
图 2 卡铂对BSA荧光猝灭的Stern-Volmer图 Fig. 2 Stern-Volmer plots of fluorescence quenching of cisplstin on BSA |
考察298、303、308 K温度下动态猝灭常数Ksv和Kq,结果见表 1。可见随着温度的升高,卡铂与BSA的Ksv逐渐减小,初步判断卡铂对BSA的猝灭机制是静态猝灭。此外卡铂对BSA的荧光猝灭速率常数Kq远大于各类猝灭剂对生物大分子最大扩散碰撞猝灭常数2.0×1010 L/(mol∙s)[8],进一步证明卡铂对BSA的猝灭不是由于分子间碰撞和能量转移而导致的动态猝灭,而是由于两者形成复合物而导致内源性荧光猝灭的静态猝灭。
| 表 1 卡铂与BSA的Stern-Volmer常数 Table 1 Stern-Volmer constants of cisplstin with BSA |
2.3 卡铂与BSA的结合位点数、结合常数测定
静态猝灭是猝灭剂与荧光分子之间相互作用形成基态复合物,而导致荧光强度降低的过程。卡铂对BSA的猝灭机制为静态猝灭,可以用静态猝灭公式得到结合常数和结合位点数[9]。
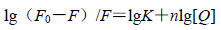
|
(2) |
F0和F分别为加入卡铂之前和加入卡铂之后BSA的荧光强度,K为卡铂与BSA的结合常数,n为卡铂与BSA的结合位点数,[Q]为卡铂的浓度。以lg(F0-F)/F对lg[Q]作图,得到不同温度(298、303、308 K)下卡铂与BSA的结合常数和结合位点数,结果见表 1。可见卡铂与BSA的结合位点数均接近1,表明卡铂与BSA有1个结合位点;结合常数均很大,说明卡铂与BSA之间作用力很强。
2.4 卡铂与BSA结合的热力学性质及作用力药物小分子与蛋白质大分子相互作用力包括氢键、静电引力、范德华力、疏水作用力等[10, 11, 12]。根据生物大分子与小分子作用力类型热力学规律[13, 14]:即△H<0,△S<0为氢键、范德华力;△H>0,△S>0为典型的疏水作用力;△H<0,△S>0主要存在静电引力。当温度变化不大的情况下,焓变可看作一个常数。根据卡铂与BSA作用前后的焓变和熵变的相对大小,确定两者的作用力类型。
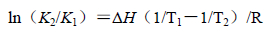
|
(3) |
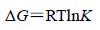
|
(4) |
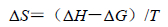
|
(5) |
由热力学公式(3)~(5)可以计算得到不同温度下卡铂与BSA作用的热力学参数,结果见表 2。可见△H>0,△S>0,说明卡铂与BSA以疏水作用力为主。△H>0,说明卡铂与BSA作用过程为吸热反应,温度升高有利于反应的进行,从而使结合常数随之增大。
| 表 2 卡铂与BSA结合热力学常数 Table 2 Thermodynamic parameters for binding of BSA with cisplstin |
2.5 卡铂对BSA构象的影响
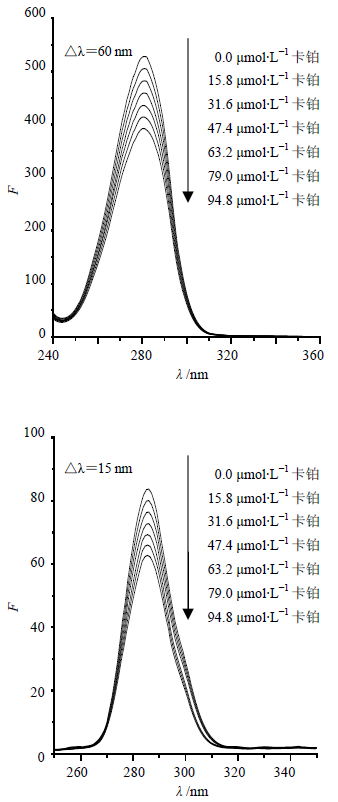
BSA中含有酪氨酸、色氨酸和苯丙氨酸能吸收紫外光,并且能发射内源性荧光,而内源性荧光主要来自色氨酸和酪氨酸。可以通过检测BSA中色氨酸和酪氨酸残基荧光变化,考察药物小分子对BSA构象的影响。固定△λ=60 nm得到BSA中色氨酸残基的同步荧光光谱;△λ=15 nm得到BSA中酪氨酸残基的同步荧光光谱,见图 3。
|
图 3 卡铂与BSA作用的同步荧光光谱图 Fig. 3 Synchronous fluorescence spectra of interaction between cisplstin and BSA |
氨基酸残基的最大发射波长与其所处环境的极性有关,如果红移说明残基所处环境极性增加,疏水性减弱,因此可以根据发射波长的移动(红移或者蓝移)来判断BSA构象的变化[15]。△λ=15 nm时,随着卡铂浓度的增加,BSA的酪氨酸残基荧光有规律地降低,但降低不明显,且最大荧光发射波长未发生明显移动,说明卡铂的加入对酪氨酸残基微环境没有明显影响;△λ=60 nm时,BSA的色氨酸残基荧光明显降低且比酪氨酸残基荧光强度降低更明显,表明BSA的荧光主要由色氨酸残基贡献,推测卡铂与BSA的结合位点更接近于色氨酸残基。色氨酸的最大发射波长发生红移,表明卡铂加入改变BSA色氨酸残基的微环境,使BSA色氨酸残基亲水性增强,疏水性环境减弱,说明BSA的构象发生变化。
3 讨论采用荧光光谱法研究卡铂与BSA相互作用,结果表明卡铂对BSA有荧光猝灭作用,是由于两者形成1∶1的复合物而引起的静态猝灭。结合常数随温度的升高而增大,可能是由于温度的升高使卡铂与BSA分子之间的碰撞和扩散增强,导致结合常数的增大。同步荧光结果表明:卡铂的加入使BSA色氨酸氨基附近的微环境发生改变,其亲水性增强,疏水性环境减弱;卡铂与BSA的结合位点在色氨酸残基附近,BSA的构象发生变化。
BSA的空间结构是圆筒状结构,分子中几乎所有的疏水性氨基酸残基都包埋在圆筒内部,构成疏水腔,此空间结构靠疏水性作用力来维持[16]。实验结果表明卡铂与BSA之间以疏水作用为主,说明卡铂通过疏水作用力进入BSA疏水空腔内部形成复合物。
| [1] |
刘阳, 王敏. 紫杉醇联合奈达铂或卡铂治疗上皮性卵巢癌的临床疗效比较[J].
现代药物与临床,2015, 29 (5) : 512-525.
( 0) 0)
|
| [2] |
Li J F, Li J Z, Jiao Y, et al. Spectroscopic analysis and molecular modeling on the interaction of jatrorrhinzine with human serum albumin[J].
Spectrochim Acta Part A Molecul Biomolecul Spectrosc,2014, 118 : 48-54.
( 0) 0)
|
| [3] |
刘里, 成飞翔. 光谱法研究头孢丙烯与牛血清白蛋白的相互作用[J].
中国药房,2015, 26 (31) : 4360-4363.
( 0) 0)
|
| [4] |
王娜, 于海洋, 张晓辉, 等. 芥子碱与牛血清白蛋白的相互作用[J].
分子科学学报,2012, 28 (6) : 478-482.
( 0) 0)
|
| [5] |
郭明, 谭贤, 王莹, 等. 黄芩苷-金属配合物与血清蛋白的分子作用机制研究[J].
药学学报,2015, 50 (5) : 613-620.
( 0) 0)
|
| [6] |
贾昊迪, 王建明, 刘宪英, 等. 绿原酸与牛血清白蛋白的相互作用及酒精对其的影响[J].
时珍国医国药,2011, 22 (6) : 1335-1337.
( 0) 0)
|
| [7] |
龚兰新, 翁之望, 王英波, 等. 吡柔比星与牛血清白蛋白的相互作用研究[J].
化学研究与应用,2013, 25 (8) : 1161-1164.
( 0) 0)
|
| [8] |
张晓静, 许多多, 张俊义, 等. 胆酸类化合物与牛血清白蛋白相互作用的光谱研究[J].
中国实验方剂学杂志,2014, 20 (1) : 56-62.
( 0) 0)
|
| [9] |
胡威, 高宗华, 王雷. 光谱法研究维生素C和拉米夫定与血清白蛋白的相互作用[J].
光谱实验室,2013, 30 (6) : 3082-3085.
( 0) 0)
|
| [10] |
Lan Y X, Liu M X, Chen S Z, et al. Spectrophotometric studies on the interaction between chlorogenic acid, neochlorogenic acid, cryptochlorogenic acid and lysozyme[J].
J Chin Pharm Sci,2014, 23 (8) : 543-547.
( 0) 0)
|
| [11] |
张素峰, 黎明, 张怀斌. 注射用头孢噻肟钠与牛血清白蛋白相互作用研究[J].
中国临床药理学杂志,2015, 31 (11) : 921-923.
( 0) 0)
|
| [12] |
Zhang L H, Liu B S, Li Z Y, et al. Comparative studies on the interaction of cefixime with bovine serum albumin by fluorescence quenching spectroscopy and synchronous fluorescence spectroscopy[J].
Luminescence,201, 30 (5) : 686-692.
( 0) 0)
|
| [13] |
王旭, 吴淑春, 王家学, 等. 水杨酸和牛血清白蛋白的相互作用研究及共存铜离子的影响[J].
中国现代应用药学,2013, 30 (10) : 1066-1070.
( 0) 0)
|
| [14] |
Ross P D, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability[J].
Biochemistry,1981, 20 (11) : 3096-3102.
( 0) 0)
|
| [15] |
李翠侠, 刘绍璞, 刘忠芳, 等. 荧光光谱法研究托拉塞米与牛血清白蛋白的相互作用及其分析应用[J].
化学学报,2011, 69 (12) : 1408-1414.
( 0) 0)
|
| [16] |
尚永辉, 李华, 孙家娟. 荧光光谱法研究原花青素与牛血清白蛋白的相互作用[J].
分析科学学报,2011, 27 (2) : 179-182.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

