2. 佳木斯大学校医院 超声科, 黑龙江 佳木斯 154003;
3. 佳木斯大学, 黑龙江 佳木斯 154002;
4. 佳木斯大学附属第一医院 高压氧中心, 黑龙江 佳木斯 154003
2. Department of Ultrasonography, Hospital of Jiamusi University, Jiamusi 154003, China;
3. Jiamusi University, Jiamusi 154002, China;
4. Center of Hyperbaric Oxygen, First Affiliated Hospital of Jiamusi University, Jiamusi 154003, China
化疗在临床肿瘤治疗中起到重要作用,蒽环类抗生素如阿霉素在恶性肿瘤中应用广泛,但在治疗过程中伴随着一系列副作用及耐药问题,尤其心脏毒性引起的致命性心力衰竭,限制了其在临床中的应用。目前,研究阿霉素心肌损伤的方法很多,引起能量代谢损害主要是由于线粒体损伤所致,线粒体是心肌能量产生的主要场所,阿霉素心肌损伤线粒体功能变化发挥了重要作用。苦参碱类生物碱是以苦参碱为代表的化学结构相似的一类生物碱,包括苦参碱、氧化苦参碱、槐国碱、槐醇碱等,广泛存在于豆科植物苦参、苦豆子和广豆根中,是这几种常用中草药的主要有效成分[1]。研究发现苦参碱对酸化条件及长期心肌缺血后心室肌细胞表现出明显的抑制作用,提示其对心肌梗死后心律失常有效[2]。另外研究还发现苦参碱、氧化苦参碱均能对抗乌头碱、哇巴因、肾上腺素、氯化钡及冠状动脉结扎等所诱发的动物实验性心律失常[3]。本课题组前期研究发现苦参碱、氧化苦参碱具有显著保护阿霉素引起的心肌损伤作用[4, 5],因此本研究通过建立大鼠阿霉素心肌损伤模型,利用苦参碱进行干预,探讨苦参碱对阿霉素致心肌损伤的保护作用。
1 材料 1.1 实验动物成年健康SD大鼠100只,体质量200~350 g,雌雄各半,正常饲料喂养,购自北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2012-0001。
1.2 药品和试剂注射用苦参碱(山东瑞阳药业有限公司,规格0.15 g/支,批号15020406),注射用阿霉素(浙江海正药业有限公司,规格10 mg/支,批号15023020),谷胱甘肽过氧化物酶(GSH-Px)、总超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒均购自南京碧云天生物技术有限公司,批号分别为20121210、20121218、20121219。线粒体偶联因子6(CF6)试剂盒购自上海酶联生物科技有限公司,货号为ml-elisa-1018。Na+-K+-ATP酶、Ca2+-ATP酶活性试剂盒均购自南京建成生物工程研究所,批号为20120301。
2 方法 2.1 动物分组及给药SD大鼠随机分为对照组、模型组和苦参碱25、50、100 mg/kg组,每组各20只。模型组将注射用阿霉素10 mg以10 mL生理盐水稀释后,ip大鼠2.5 mg/kg,1次/周,连续给药6周,累积剂量15 mg/kg,建立心肌损伤模型。对照组ip等量生理盐水。苦参碱组将注射用苦参碱0.15 g以10 mL生理盐水稀释,在大鼠ip注射用阿霉素前2 d ip注射用苦参碱25、50、100 mg/kg,连续给药5 d。
2.2 血液和心肌组织匀浆的处理6周给药结束后,立即对各组大鼠进行处理,摘除眼球取血,将取得的血液4 ℃,3 000 r/min离心15 min后,取上清液−80 ℃冻存备用。
大鼠处死后,取心脏组织约0.5 g,用生理盐水漂洗,除去血液,滤纸拭干,称定质量,用小剪刀尽快剪碎组织块。将剪碎的组织倒入玻璃匀浆器中充分磨碎,使组织匀浆化。将制备好的10%组织匀浆用低温离心机3 000 r/min离心10~15 min。将离心好的心肌组织匀浆取上清液备用,并保存于−80 ℃的冰箱中。
2.3 组织病理学检查将心肌组织使用4%甲醛固定24 h后,以石蜡包埋,切成5 μm左右薄片,用苏木精-伊红进行染色,显微镜观察心肌组织变性、肥大程度以及充血肿胀程度。
2.4 血清CF6水平的测定采用酶联免疫吸附法检测大鼠血清线粒体偶联因子CF6水平,所有操作均按照试剂盒说明书进行。
2.5 线粒体Na+-K+-ATP酶和Ca2+-ATP酶活性的测定取心肌组织匀浆上清液,采用无机磷比色法测定线粒体Na+-K+-ATP酶、Ca2+-ATP酶活性。以721分光光度计于660 nm处测定吸光度值,通过磷标准曲线来推算ATP 酶活力,均采用复管测定,严格按试剂盒说明操作。
2.6 氧化应激水平的测定取心肌组织匀浆上清液,测定心脏中GSH-Px、SOD活力,以及MDA含量。所有操作均按照试剂盒说明书进行。
2.7 统计分析采用SPSS 16.0软件,结果以x±s表示。两组间的数据比较采用t检验。
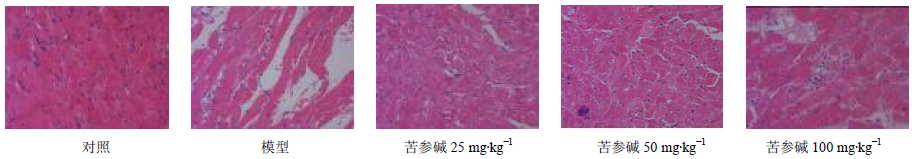
3 结果 3.1 病理学检查模型组大鼠心肌组织出现肿胀,肌束间、间质有灶性出血现象,心肌间质水肿。苦参碱各组心肌组织肿胀,肌束间、间质有灶性出血现象显著减轻,见图 1。
|
图 1 大鼠心肌细胞病理学(HE染色) Fig. 1 Histopathology of cardiac muscle cells of mice (HE staining) |
3.2 血清CF6水平变化
与对照组比较,模型组大鼠血清CF6水平显著升高(P<0.01);与模型组比较,苦参碱各组血清CF6水平显著降低,差异具有统计学意义(P<0.05)。结果表明阿霉素可引起大鼠心肌组织释放CF6,苦参碱可抑制阿霉素引起的CF6释放,见表 1。
| 表 1 苦参碱对大鼠血清CF6水平的影响(x±s,n=20) Table 1 Effect of matrine on CF6levels in serum of mice (x±s, n=20) |
3.3 线粒体Na+-K+-ATP、Ca2+-ATP酶活性比较
与对照组比较,模型组大鼠Na+-K+-ATP酶、Ca2+-ATP酶活性显著降低(P<0.01);与模型组比较,苦参碱各组Na+-K+-ATP酶、Ca2+-ATP酶活性显著升高,差异有统计学意义(P<0.05)。结果表明阿霉素可抑制大鼠心肌代谢,苦参碱可显著改善阿霉素引起的ATP酶活性降低,见表 2。
| 表 2 苦参碱对大鼠线粒体Na+-K+-ATP、Ca2+-ATP酶活性的影响(x ± s,n = 20) Table 2 Effect of matrine on activities of Na+-K+-ATP and Ca2+-ATP enzyme in mitochondrion of mice (x ± s, n= 20) |
3.4 氧化应激指标比较
与对照组比较,模型组大鼠心肌组织GSH-Px活性及SOD活力下降,MDA含量上升(P<0.01);与模型组比较,苦参碱各组大鼠心肌组织GSH-Px活性及SOD活力升高,MDA含量显著降低(P<0.05),结果表明苦参碱可以降低阿霉素所导致大鼠机体内的氧化应激水平,从而起到保护心肌作用,见表 3。
| 表 3 苦参碱对大鼠心肌细胞内GSH活性、MDA含量及SOD活力的影响(x ± s,n = 20) Table 3 Effect of matrineon activities of GSH and SOD,and content of MDA in cardiac muscle cells of mice (X ± s, n = 20) |
4 讨 论
阿霉素在治疗肿瘤的同时,可以引起心血管系统损害,这是由于氧化应激以及钙超载所致[6],大量研究表明,在蒽环类药物引起的心脏毒性发病过程中,线粒体是主要靶器官[7]。线粒体是生物体的ATP来源,约90% ATP来自线粒体氧化磷酸化。阿霉素抑制Na+-K+-ATP酶的活性,使Na+-K+交换减少,Na+-Ca2+交换增加,进而加速Ca2+内流,进一步加重心肌细胞内钙超载及Ca2+-ATP酶活性降低。线粒体偶联因子6(mitochondrial coupling factor-6,CF6)是ATP合成酶组成成分,存在于体内多种组织之中,且以心肌组织含量最高,血管内皮细胞膜也含有丰富的CF6,并成为循环中CF6的重要来源之一。CF6在原发性高血压、急性冠脉综合症、终末期肾病以及糖尿病中均显著升高[8],阿霉素抑制Na+-K+-ATP酶的活性,使Na+-K+交换减少、Na+- Ca2+交换增加而加速Ca2+内流,而长期的Ca2+内流增加可能是阿霉素导致心衰的机制之一[9]。
苦参碱对异丙肾上腺素致大鼠心力衰竭模型心室重构及心功能衰竭具有保护作用,随着苦参碱剂量增加,减轻异丙肾上腺素致大鼠肥厚性心肌组织病理学结构的异常改变越来越显著,其心肌细胞排列逐渐整齐,肥大心肌细胞范围变小,纤维化、间质水肿和炎细胞浸润减少,心肌细胞直径和横截面积减小[10]。本研究发现,阿霉素使大鼠Na+-K+- ATP、Ca2+-ATP酶活性显著降低,而苦参碱显著提高Na+-K+-ATP、Ca2+-ATP酶活性。观察大鼠应用阿霉素后CF6的变化,结果显示血清CF6水平较对照组显著增加;应用苦参碱干预后,血清CF6水平显著下降,苦参碱能够保护线粒体功能,提高线粒体Na+-K+-ATP酶的活性及Ca2+-ATP酶活性,降低血清CF6水平,减轻阿霉素引起的心肌损伤。
有研究发现[11]苦参碱可以降低细胞内活性氧(ROS)含量,从而导致MDA含量也降低,同时提高SOD的活性,进一步清除细胞内的ROS。本实验结果显示阿霉素组大鼠心肌组织GSH活性及SOD活力下降,MDA含量上升;苦参碱显著提高GSH及SOD活力,降低MDA含量,减轻阿霉素引起的心肌组织氧化应激反应,表明苦参碱能够减轻阿霉素对心肌组织的损害。在正常细胞中,线粒体整合了能量产生和生物合成的分子途径,维持氧化还原平衡,调节细胞内钙信号并参与细胞死亡。ROS可能诱导线粒体内膜上心磷脂过氧化损伤,导致呼吸链复合体及ATP合酶活性下降,氧化磷酸化功能减弱,最终使得ATP产量减少。线粒体呼吸链是ROS产生的主要部位,氧化应激是许多类型疾病的损伤机制的一个过程,它是肌体ROS生成和体内抗氧化防御系统失衡的结果[12]。心脏的ROS主要是超氧化物(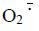
阿霉素对心肌的影响最直接的证据是心肌活检,本研究表明在应用阿霉素后大鼠心肌充血水肿,心肌组织出现肿胀,肌束间、间质有灶性出血现象,心肌间质水肿最明显,在给予苦参碱干预后,大鼠心肌组织出现肿胀现象,肌束间、间质有灶性出血情况显著减轻。
通过本研究表明,苦参碱减轻阿霉素引起的心肌损伤,通过保护线粒体功能、提高ATP酶活性、降低血清CF6水平、减轻氧化应激反应,从而达到保护心脏的作用,但是苦参碱对放化疗心肌损伤的保护机制仍有待于进一步研究。
| [1] |
国家医药管理局中草药情报中心站.
植物药有效成分手册[M]. 北京: 人民卫生出版社, 1986 : 700 .
( 0) 0)
|
| [2] |
张婉, 潘振伟, 冯铁明, 等. 苦参碱对缺血性心室肌细胞快速延迟整流钾电流的作用[J].
中国药理学通报,2008, 24 (3) : 322-326.
( 0) 0)
|
| [3] |
张丽华, 陈邦恩, 潘明佳. 苦参碱药理作用研究进展[J].
中草药,2009, 40 (6) : 1000-1003.
( 0) 0)
|
| [4] |
刘洋, 杨益鹏, 姚忠林, 等. 氧化苦参碱对阿霉素所致大鼠心肌损伤的保护作用研究[J].
现代生物医学进展,2013, 13 (27) : 5267-5270.
( 0) 0)
|
| [5] |
王燕琴, 初而复, 李欣, 等. 注射用苦参碱对阿霉素致大鼠心脏重构的影响[J].
药物评价研究,2016, 39 (2) : 193-197.
( 0) 0)
|
| [6] |
Arai M, Yoguchi A, Takizawa T, et al. Mechanism of doxorubicin-induced inhibition of sarcoplasmic reticulum Ca2+-ATPase gene transcription[J].
Circ Res,2000, 86 (1) : 8-14.
( 0) 0)
|
| [7] |
Zhou S, Starkov A, Froberg M K, et al. Cumulative and irreversible cardiac mitochondrial dysfunction induced by doxorubicin[J].
Cancer Res,2001, 61 (2) : 771-777.
( 0) 0)
|
| [8] |
Li X L, Xing Q C, Gao Y Y, et al. Plasma level of mitochondrial coupling factor 6 increases in patients with type 2 diabetes mellitus[J].
Int J Cardiol,2007, 117 (3) : 411-412.
( 0) 0)
|
| [9] |
Torii M, Ito H, Suzuki T. Lipid peroxidation and myocardial vulnerability in hypertrophied SHR myocardium[J].
Exp Mol Pathol,1992, 57 (1) : 29-38.
( 0) 0)
|
| [10] |
郑萍, 张伟, 买淑霞, 等. 苦参碱对慢性心力衰竭大鼠心肌重构的干预作用[J].
中国现代中药,2014, 16 (12) : 979-984.
( 0) 0)
|
| [11] |
王瑞霞. 苦参碱对H9C2细胞缺氧复氧损伤的保护作用及机制[J].
中国心血管杂志,2015, 20 (4) : 290-294.
( 0) 0)
|
| [12] |
Juránek I, Bezek S. Controversy of free radical hypothesis: reactive oxygen species-cause or consequence of tissue injury?[J].
Gen Physiol Biophys,2005, 24 (3) : 263-278.
( 0) 0)
|
| [13] |
Minotti G, Menna P, Salvatorelli E, et al. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity[J].
Pharmacol Rev,2004, 56 (2) : 185-229.
( 0) 0)
|
| [14] |
Takemura G, Fujiwara H. Doxorubicin-induced cardiomyopathy from the cardiotoxic mechanisms to management[J].
Prog Cardiovasc Dis,2007, 49 (5) : 330-352.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


