环阿尔廷烷类三萜又称环菠萝蜜烷类三萜或环阿屯烷型三萜,其结构骨架中C9和C19形成的三元环成为环阿尔廷烷类三萜的典型结构特征,并以此区别于其他类型的三萜结构。此结构的基本骨架与羊毛甾烷类化合物有相似,在特殊科属类(如五味子属)植物中此结构则有多种变形,有合环、裂环变化,举例见图 1。环阿尔廷烷类三萜结构特殊,但广泛的存在于植物界,只是具体的含量、分布有所不同。环阿尔廷类三萜及其苷具有较好的药理活性,因此本文对于其在植物中的分布和近年来的药理活性进行总结,有利于进一步开发此药物。
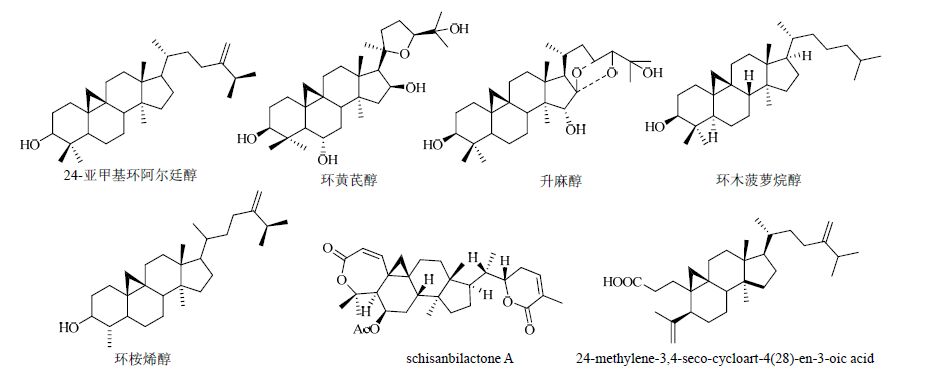
|
图 1 环阿尔廷烷类三萜的化学结构举例 Fig. 1 Structures examples of cycloartane triterpenoids |
1 资源分布
李从军等[1]在1994年对此类结构的资源进行过总结,列举了38科63属植物。现在含有环阿尔廷烷类结构化合物的植物已扩至100个科,其中还包括了菌类火木层孔菌Phellinus igniarius (L.:F.) Quél.[2]以及多种海洋植物瘤枝藻Tydemania expeditionis Weber-van bosse[3]、束生刚毛藻Cladophora fascicularis (Mert.) Kuetzing[4]。除此之外,在玻利维亚产的蜂胶中还发现了一种富含三萜的蜂胶,但是其植物来源尚未确定[5]。
含有此类结构的植物种类较多,其中黄芪属和升麻属中环阿尔廷烷类三萜结构变化较多,黄芪属中发现5类环阿尔廷类母核结构[6],而升麻属中主要有7类环阿尔廷类母核结构[7]。除此之外还有其他不属于其中几大主类的环阿尔廷烷类三萜结构。
然而,其他科属的植物中虽然含量和种类不如以上两属植物多,却也有自己特有的结构类型被发现:如毛茛科唐松草属中的唐松草苷Ⅻ、唐松草苷ⅩⅢ[8],松科Pseudolarix kaempferi Gord.中的peudolarolides A、B、C[9],兰科石仙桃属云南石仙桃Pholidota yunnanensis Rolfe.[10]、百合科粉条菜属粉条儿菜Aletris spicata (Thunb.) Franch.[11]中的cyclopholidonol等。还有一部分科属的植物中分得的并不是特有的结构,仅是广泛存在的几种化合物。这些化合物基本上包括24-亚甲基环阿尔廷醇、环桉烯醇、环阿尔廷醇等。含环阿尔廷类化合物的植物资源范围也因此扩大了许多。由此可见,环阿尔廷类化合物的资源主要还是集中在几类科属中,如豆科黄芪属,毛茛科升麻属、唐松草属、黄三七属、铁破锣属等。但在其他分布的科属中可以发现一些特有的环阿尔廷烷类化合物,如菊科Lindheimera属、兰科石仙桃属等,为开拓新的资源提供思路。对于其他只含常见的环阿尔廷类化合物的植物来说,即使现今没有发现其他环阿尔廷类结构,在未来的植物化学分离中发现的可能性也将会增加。
2 药理活性 2.1 抗肿瘤活性孙海燕等[12]研究发现,从升麻中分离的25-O-乙酰基-7,8-去氢升麻醇-3-O-β-D-吡喃木糖苷具有潜在的抗肿瘤活性,对MCF-7、HepG2细胞的IC50值分别为17.7、22.0 μmol/L。陈继永等[13]通过细胞毒高通量筛选,发现升麻中分得的5个环阿尔廷类化合物对HeLa、MCF-7细胞都具有较好的抑制活性,表明此类阿尔廷烷型三萜皂苷中的侧链环氧很可能发挥重要的药效作用。Sakurai等[14]发现升麻醇可以抑制Raji细胞中Epstein-Barr病毒早期抗原的活化,体内实验进一步证明升麻醇对小鼠皮肤癌也有一定疗效。Nishida等[15]发现从升麻根茎中分离得到的3个三萜皂苷能够显著抑制淋巴细胞的增殖。从升麻中获得的环阿尔廷烷类三萜可抑制HepG2、HL-60、R-HepG2细胞增殖,其机制可能是在G2/M期阻滞癌细胞,并抑制cdc2、COX-2的表达[3]。
在白芨Bletilla striata (Thunb.) Reichb. f.中分离得到的环阿尔廷类三萜皂苷具有抗癌和抗血管生成活性。较高浓度的白芨环阿尔廷烷类三萜120 μg/mL对血管内皮生长因子诱导的血管生成具有明显抑制作用,提示该化合物具有抗血管生成活性,可作为潜在抗癌先导化合物[16]。Tillandsia recurvata L.中的6个环阿尔廷类三萜皂苷对于4种白血病癌细胞的抑制作用有所不同,其IC50值在1.83~18.3 μmol/L,其中5个显示活性,有1个没有活性[17]。此外,研究发现T. recurvata L.中分离得到的环阿尔廷类三萜皂苷可以通过选择性抑制MRCKα激活酶和血管再生来抑制前列腺癌细胞存活,并且有望制成对于正常细胞没有杀伤性的特异性制剂[18]。五味子科植物中分离得到的不同结构的环阿尔廷类化合物对肝癌细胞HepG2、胃腺癌细胞BGC-823、肺癌细胞A549、结肠癌细胞HT-29和急性粒细胞白血病细胞HL-60均有明显的抑制作用[19]。从朝鲜冷杉Abies koreana Wils.中得到的24-methylene-3,4- seco-cycloart-4(28)-en-3-oic acid对肿瘤细胞A549、SK-OV-3、SK-MEL-2、HCT-15增殖有显著抑制作用[20]。瘤枝藻Tydemania expeditionis Weber-van bosse中的环阿尔廷类三萜硫酸盐类化合物对结肠癌、乳腺癌、肺癌、前列腺癌和卵巢癌细胞显示较弱抑制活性[3]。从苦马豆中获得的环阿尔廷烷类三萜对SF18、MCF-7、H460等癌细胞有抑制作用[3]。
2.2 抗衰老活性黄芪(含有环黄芪醇、黄芪甲苷)、赖氨酸、维生素E、维生素B9、硒及三甲基甘氨酸等抗衰老物质组合物可以有限增加染色体端粒的长度[21]。环黄芪醇有显著的抗小鼠衰老作用,主要机制可能与提高总超氧化物歧化酶活性、总抗氧化能力,降低丙二醛水平,增加羟辅氨酸水平有关[22]。环黄芪醇可作为抗衰老物质,刺激人类新生儿角化细胞端粒酶活性和细胞增殖。此外还发现ig环黄芪醇7 d的小鼠抑郁行为减少,可能是潜在的抗抑郁药物[23]。环黄芪醇经过2种真菌的生物转化后可得到衍生物,结果显示其中一些乙酰化物可以延长新杆状线虫寿命至(20.01±0.75)d,环黄芪醇组的寿命为(18.54± 0.67)d,而空白组的寿命仅为(16.93±0.70)d。这些化合物可以成为潜在的抗衰老制剂[24]。从Astragalus plumosus var. krugianus Chamb. & Matthews中分得的环阿尔廷类三萜苷可以保护纤维母细胞免受氧化应激反应,可能通过抑制叔丁基氢过氧化物诱导的活性氧升高实现的[25]。
2.3 抗病毒和抗菌活性升麻根茎中的24种三萜化合物能抑制植物血凝素刺激的淋巴细胞对核苷的转运,其中升麻苷抑制活性最强。构效关系研究表明侧链上的半缩醛结构,12位氧代,B环上的环丙烷环及C-7(8)双键与活性有关[26]。Sakurai等[15]研究发现黄肉楠碱有抗艾滋病毒的作用。黄芪甲苷和环黄芪醇可以通过上调端粒酶的活性促使HIV患者的CD8+ T淋巴细胞的增殖[27]。五味子科植物中发现的可抗HIV活性的环阿尔廷类化合物结构大部分为3,4位碳键断裂开环的环阿尔廷烷类化合物及降环阿尔廷烷类化合物,但抑制活性强度不一[19]。笔筒树Sphaeropteris lepifera (J. Sm. ex Hook.) R. M. Tryon中获得的环阿尔廷烷类三萜在50、10 μg/mL对腺病毒有较强的抑制作用[3]。(24S)-24,25- dihydroxycycloartanol对于结核分枝杆菌的生长有抑制作用,并且对耐药型结核分枝杆菌有明显的抗结核活性[28]。(3β,23E)- cycloarta-23-ene-3,25-diol抗病毒活性的细胞活力测定实验,EC50值(86.63±0.03)μg/mL,CC50值为(1 089.21±0.25)μg/mL,SI值为12.57,实验结果显示其有明显的抗病毒活性[29]。从升麻中分离的几种9,19-环阿尔廷型四环三萜有明显的抗菌活性[30]。
2.4 抗炎活性argentatin A、B、D可作为潜在的抗炎药物,效果比吲哚美辛好。在12-O-十四烷酰佛波醇-13-醋酸酯诱导小鼠水肿实验中,argentatins B可以抑制关键酶COX-2活性[31]。黄芪叶中分离的huangqiyegenin V、VI和 huangqiyenin K对于脂多糖引起的巨噬细胞释放NO具有很明显的抑制作用,其IC50值在14.4~27.1 μmol/L[32]。Krameria pauciflora MOC et. Sesse ex DC.甲醇、二氯甲烷部位有一定的抗炎效果,其中含有一种环阿尔廷类三萜及一种甾体类成分[33]。
2.5 对肝损伤的保护作用木糖-葡萄糖-环黄芪醇能够明显抑制小鼠离体肝脏的脂质过氧化物生成作用,抑制率为31.5%,并且能够抑制阿霉素引起的小鼠体内脂质过氧化物水平升高,抑制率为83.8%[34]。从铁破锣Beesia calthifolia (Maxim.) Ulbr.中分离的环阿尔廷类三萜有护肝作用,可以减少D-半乳糖胺引起的人类肝细胞L02的细胞损伤[35-36]。鹧鸪麻中环阿尔廷烷类三萜对肝脏细胞的保护作用的EC50在37.9~123.1 μmol/L,与75.7 μmol/L水飞蓟宾的作用相当[3]。
2.6 其他作用cycloeucalenol、cycloeucalenone有温和的强心作用,其中cycloeucalenol可以微微增强右心房的收缩力[37]。环黄芪醇对局灶性脑缺血再灌注脑组织损伤具有保护作用,能抑制脑缺血再灌注大鼠神经元凋亡,抑制作用是通过促进端粒酶逆转录酶表达来实现的[38-39]。环黄芪醇对CYP3A4亚酶具有明显抑制作用,对CYP2E1亚酶有显著的诱导作用[40]。糖尿病小鼠模型试验,百合科芦荟中5种甾醇类lophenol、24-methyl-lophenol、24-ethyl-lophenol、环木菠萝烷醇、24-亚甲基环阿尔廷醇给药28 d,结果其血液中的葡萄糖水平分别是空白组的64%、28%、47%、51%、55%,提示是潜在的治疗2型糖尿病药物[41]。有报道称从升麻中获得的环阿尔廷烷类三萜可用于治疗骨质疏松症和更年期综合征[3]。Jarry等研究认为总状升麻可能含有3种协同作用的化合物黄肉楠碱、升麻苷和芒柄花素,能够降低血清中促黄体生成素水平,同时与雌激素受体结合,增加血液中游离的雌激素,缓解绝经症状[15]。升麻内酯A有明显抗补体作用,其IC50值为28.6 μmol/L[42]。
环阿尔廷类化合物结构特殊,除上述作用之外,还包括免疫调节活性,对心血管系统的作用,调节神经突触的生长等药理活性[43]。
部分植物和药理活性见表 1。
| 表 1 部分植物和药理活性举例 Table 1 Part of plants and pharmacological activities for example |
3 结语
现在已经有越来越多的环阿尔廷类化合物被发现,其植物分布的科属大大增加。分布在不同植物中的环阿尔廷类化合物在结构上是不同的,其中的结构变化可能影响后续的药理活性和强度。环阿尔廷类化合物药理活性丰富,包括抗肿瘤、抗病毒、抗菌、抗炎等活性,甚至是对于肝损伤也有很好的保护作用。因此环阿尔廷类化合物除了可以开发成为抗肿瘤药物,也可以作为潜在的抗病毒性传染病药物,可作为一些心血管疾病、糖尿病、骨质疏松等老年多发病的潜在药物。总之,环阿尔廷类化合物的资源日渐丰富,结构类型多样化,药理活性也在日益完善中,具有较好的开发前景。
| [1] |
李从军, 李英和, 肖培根.
9,19-环羊毛脂烷型三萜化合物的资源及生理活性[J]. 现代药物与临床, 1994, 8(5) : 195–196.
( 0) 0)
|
| [2] |
郭佳, 包海鹰, 崔宝凯.
火木层孔菌的脂溶性成分[J]. 东北林业大学学报, 2011(4) : 127–129.
( 0) 0)
|
| [3] |
张建龙, 江仁望.
瘤枝藻的化学成分及生物活性研究进展[J]. 中国海洋药物, 2011, 30(5) : 61–66.
( 0) 0)
|
| [4] |
黄新苹. 四种海洋生物的化学成分及其生物活性研究[D]. 青岛:中国科学院研究生院海洋研究所, 2006.
( 0) 0)
|
| [5] |
Nina N, Quispe C, Jimenez-Aspee F, et al.
Chemical profiling and antioxidant activity of Bolivian propolis[J]. J Sci Food Agric, 2016, 96(6) : 2142–2153.
DOI:10.1002/jsfa.2016.96.issue-6 ( 0) 0)
|
| [6] |
郭璐. 黄芪中皂苷类成分及黄芪甲苷结构修饰的研究[D]. 成都, 西南交通大学, 2014.
( 0) 0)
|
| [7] |
陈继永. 升麻的化学成分及生物活性研究[D]. 青岛:中国海洋大学, 2014.
( 0) 0)
|
| [8] |
徐诺.
唐松草中二个新的环阿尔廷型糖甙[J]. 国外医学:中医中药分册, 1998(3) : 50.
( 0) 0)
|
| [9] |
Chen G F, Li Z L, Pan D J., et al.
The isolation and structural elucidation of four novel triterpene lactones, peudolarolides A, B, C, and D, from Pseudolarix kaempferi[J]. J Nat Prod, 1993, 56(7) : 1114–1122.
DOI:10.1021/np50097a015 ( 0) 0)
|
| [10] |
毕志明, 王峥涛, 徐珞珊, 等.
云南石仙桃化学成分的研究[J]. 中国中药杂志, 2004, 29(1) : 47–49.
( 0) 0)
|
| [11] |
李林珍, 王孟华, 孙建博, 等.
粉条儿菜化学成分的研究[J]. 中国药科大学学报, 2014, 45(2) : 175–177.
( 0) 0)
|
| [12] |
孙海燕, 刘蓓蓓, 陈四保.
升麻中环菠萝蜜烷三萜化学成分及其抗肿瘤活性的研究[J]. 中南药学, 2015, 13(3) : 234–238.
( 0) 0)
|
| [13] |
陈继永, 姜永涛, 沈莉, 等.
升麻中环阿尔廷烷型三萜皂苷及其抗肿瘤活性研究[J]. 中国海洋大学学报:自然科学版, 2014, 44(11) : 74–80.
( 0) 0)
|
| [14] |
Sakurai N, Kozuka M, Tokuda H, et al.
Antitumor agents 220. Antitumor-promoting effects of cimigenol and related compounds on Epstein-Barr virus activation and two-stage mouse skin carcinogenesis[J]. Bioorg Med Chem, 2003, 11(6) : 1137–1140.
DOI:10.1016/S0968-0896(02)00432-7 ( 0) 0)
|
| [15] |
高璟春, 张金超, 朱国元, 等.
升麻族植物药理活性研究进展[J]. 中草药, 2006, 37(10) : 1599–1602.
( 0) 0)
|
| [16] |
刘明志, 强娜, 林芳花.
白芨环阿屯烷型三萜的鉴定及抗血管生成活性[J]. 药物生物技术, 2015, 22(2) : 121–124.
( 0) 0)
|
| [17] |
Lowe H I C, Toyang N J, Watson C T, et al.
Antileukemic activity of Tillandsia recurvata and some of its cycloartanes[J]. Anticancer Res, 2014, 34(7) : 3505–3509.
( 0) 0)
|
| [18] |
Lowe H, Bryant D J. Methods for inhibiting prostate cancer by kinases and angiogenesis inhibitory mechanisms of ball moss extract[P]. US:9040100B2, 2015-05-26.
( 0) 0)
|
| [19] |
金银萍, 焉石, 刘俊霞, 等.
五味子科植物中环阿屯烷型三萜类成分及其药理作用研究进展[J]. 中草药, 2014, 45(4) : 582–589.
( 0) 0)
|
| [20] |
李永利. 三种冷杉属植物的化学成分与生物活性研究[D]. 上海:上海交通大学, 2013.
( 0) 0)
|
| [21] |
Caterini R J L. Composition with plant extracts to fight against cellular ageing[P]. FR:3016290A1, 2015.
( 0) 0)
|
| [22] |
曹艳玲, 李文兰, 韦灵玉, 等.
环黄芪醇对D-半乳糖致衰老小鼠的抗衰老作用[J]. 中国实验方剂学杂志, 2012, 18(19) : 208–211.
( 0) 0)
|
| [23] |
Ip F C F, Ng Y P, An H J, et al.
Cycloastragenol is a potent telomerase activator in neuronal cells:implications for depression management[J]. Neurosignals, 2014, 22(1) : 52–63.
DOI:10.1159/000365290 ( 0) 0)
|
| [24] |
Feng L, Ji S., Qi ao, X ., et al.
Biocatalysis of cycloastragenol by Syncephalastrum racemosum and Alternaria alternata to discover anti-aging derivatives[J]. Adv Synth Catal, 2015, 357(8) : 1928–1940.
DOI:10.1002/adsc.201401158 ( 0) 0)
|
| [25] |
Denizli N, Horo I, Gulcemal D, et al.
Cycloartane glycosides from Astragalus plumosus var. krugianus and evaluation of their antioxidant potential[J]. Fitoterapia, 2014(92) : 211–218.
( 0) 0)
|
| [26] |
周亮, 杨峻山.
186升麻族植物中的三萜皂苷及其药理作用[J]. 现代药物与临床, 2005, 20(4) : 149–156.
( 0) 0)
|
| [27] |
Yung L Y, Lam W S, Ho M K C, et al.
Astragaloside IV and cycloastragenol stimulate the phosphorylation of extracellular signal-regulated protein kinase in multiple cell types[J]. Planta Med, 2012, 78(2) : 115–121.
DOI:10.1055/s-0031-1280346 ( 0) 0)
|
| [28] |
Akihisa T, Ukiya M, Okuda H. Antibacterial agents containing triterpene alcohols for controlling acid-fast bacteria[P]. JP:2004175679A, 2004.
( 0) 0)
|
| [29] |
Shamsabadipour S, Ghanadian M, Saeedi H, et al.
Triterpenes and steroids from Euphorbia denticulata Lam. with anti-herpes symplex virus activity[J]. Iran J Pharm Res, 2013, 12(4) : 759–767.
( 0) 0)
|
| [30] |
王记祥, 金首文.
南川升麻的化学成分和抗菌活性研究[J]. 安徽农业科学, 2012(5) : 2651–2653.
( 0) 0)
|
| [31] |
Romero J C, Martinez-Vazquez A, Herrera M P, et al.
Synthesis, anti-inflammatory activity and modeling studies of cycloartane-type terpenes derivatives isolated from Parthenium argentatum[J]. Bioorg Med Chem, 2014, 22(24) : 6893–6898.
DOI:10.1016/j.bmc.2014.10.028 ( 0) 0)
|
| [32] |
Wang Z, Zhai Y, Ma Z, et al.
Triterpenoids and flavonoids from the leaves of Astragalus membranaceus and their inhibitory effects on nitric oxide production[J]. Chem Biodiversity, 2015, 12(10) : 1575–1584.
DOI:10.1002/cbdv.v12.10 ( 0) 0)
|
| [33] |
Ramirez-Cisneros M A, Rios M Y, Deciga-Campos M, et al.
Phytochemical study and anti-inflammatory, antidiabetic and free radical scavenger evaluations of Krameria pauciflora methanol extract[J]. Molecules, 2012, 17 : 861–872.
DOI:10.3390/molecules17010861 ( 0) 0)
|
| [34] |
张静华, 龚志铭, 郑基蒙, 等.
黄芪注射液及提取成分对小鼠肝脂质过氧化物的影响[J]. 上海医科大学学报, 1992(5) : 378–380.
( 0) 0)
|
| [35] |
Gan L, Zheng D, Liu Q., et al.
Eight new cycloartane triterpenoids from Beesia calthifolia with hepatoprotective effects against D-galactosamine-induced L02 cell damage[J]. Bioorg Med Chem Lett, 2015, 25(18) : 3845–3849.
DOI:10.1016/j.bmcl.2015.07.070 ( 0) 0)
|
| [36] |
Zheng D, Zhou J, Liu Q, et al.
Five new cycloartane triterpenoids from Beesia calthifolia[J]. Fitoterapia, 2015, 103 : 283–288.
DOI:10.1016/j.fitote.2015.04.017 ( 0) 0)
|
| [37] |
Kongkathip N, Dhumma-upakorn P, Kongkathip B, et al.
Study on cardiac contractility of cycloeucalenol and cycloeucalenone isolated from Tinospora crispa[J]. J Ethnopharmacol, 2002, 83(1-2) : 95–99.
DOI:10.1016/S0378-8741(02)00210-6 ( 0) 0)
|
| [38] |
易忠良. 环黄芪醇对脑缺血再灌注大鼠神经元凋亡和TERT表达的影响[D]. 承德:承德医学院, 2015.
( 0) 0)
|
| [39] |
高维娟.
环黄芪醇对脑缺血再灌注大鼠神经元凋亡和TERT表达的影响[J]. 中国病理生理杂志, 2015(10) : 1858.
( 0) 0)
|
| [40] |
魏宝红, 叶静, 薛宝娟, 等.
环黄芪醇连续灌胃对大鼠肝脏P450酶活性的影响[J]. 中国新药杂志, 2014, 23(4) : 476–479.
( 0) 0)
|
| [41] |
Tanaka, M, Misawa E, Ito Y, et al.
Identification of five phytosterols from Aloe vera gel as anti-diabetic compounds[J]. Biol Pharm Bull, 2006, 29(7) : 1418–1422.
DOI:10.1248/bpb.29.1418 ( 0) 0)
|
| [42] |
Qiu M, Kim J, Lee H, et al.
Anticomplement activity of cycloartane glycosides from the rhizome of Cimicifuga foetida[J]. Phytother Res, 2006, 20(11) : 945–948.
DOI:10.1002/(ISSN)1099-1573 ( 0) 0)
|
| [43] |
田泽, 肖培根, 闻杰, 等.
天然环菠萝蜜烷三萜化合物生物活性研究进展[J]. 中国中药杂志, 2006, 31(8) : 625–629.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


