近年来,血栓栓塞性疾病的发病率呈不断上升趋势,且表现出致死率高和致残率高的特点。抗血小板药物通过抑制血小板聚集,防止血栓形成,在该类疾病的预防和治疗中发挥重要作用。根据作用靶点的不同,常用抗血小板药物主要包括环氧合酶(COX-1)抑制剂(如阿司匹林)、P2Y12抑制剂(如氯吡格雷)以及血小板GPⅡb/Ⅲa受体拮抗剂(如阿昔单抗)等。然而,大量临床研究表明上述药物的有效性和安全性存在不足。因此开发结构新颖、安全性和有效性更佳的抗血小板药物已成为该领域研发的重要目标。
1991年,Coughlin等[1]首先克隆了人体血小板凝血酶受体(thrombin receptor),并揭示了该受体被凝血酶激活的独特机制,这为抗血栓药物的研发提供了新的靶标。由于凝血酶是一种丝氨酸蛋白酶,凝血酶受体也因此被称为蛋白酶激活受体-1(protease-activated receptor-1,PAR-1),后续研究又相继发现PAR-2、PAR-3、PAR-4等亚型。研究表明,凝血酶通过PAR-1、PAR-4介导人体的血小板活化,其中PAR-1起主要作用[2-3]。因此,凝血酶受体拮抗剂的开发主要以PAR-1为作用靶点。目前已有多个拮抗剂被报道,其中口服小分子药物vorapaxar sulfate已上市,多肽类药物PZ-128正在进行II期临床试验。
PAR-1由染色体F2R基因编码,其一级结构由425个氨基酸残基构成。该受体C-端位于细胞内,N-端位于细胞外,其二级结构还包括7个跨膜螺旋结构域(TM1-7)、3个细胞内loop区(intracellular loop,ICL1-3)和3个细胞外loop区(extracellular loop,ECL1-3)。PAR-1的活化是一种特殊的、不可逆的“自身激活”过程[1]。具体而言,凝血酶首先特异性识别PAR-1的水蛭素样序列(K51YEPF55),该序列对两者的结合中发挥至关重要的作用[4]。然后,位于PAR-1上的N端序列41Arg-42Ser(R41-S42)被凝血酶水解,肽键断裂并暴露出一个起始序列为S42FLLRN47的新N端。最后,该末端作为一个“栓配体”(tethered ligand)与自身胞外loop区ECL2发生分子内反应,促使PAR-1构象发生改变,进而引发细胞内的信号级联放大反应,最终导致血小板的聚集,见图 1。
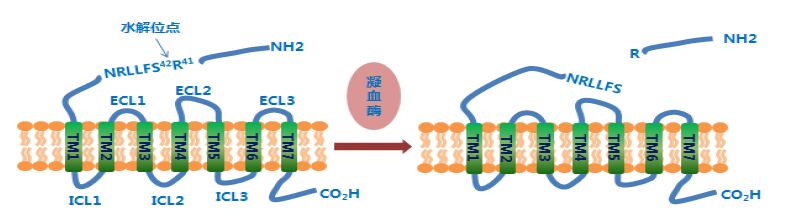
|
图 1 PAR-1的活化机制 Fig. 1 Mechanism of PAR-1 |
按结构特点,PAR-1拮抗剂可分为小分子拮抗剂和多肽类拮抗剂两大类。
1 小分子PAR-1拮抗剂目前已报道的PAR-1小分子拮抗剂包括vorapaxar、atopaxar、F16618、F16357、ML161等。vorapaxar在2014年5月被FDA批准上市,主要用于有心脏病发作史患者以及动脉栓塞患者,以降低心脏病进一步发作、中风等死亡危险;atopaxar的临床研究主要针对患有急性冠状动脉综合症(acute coronary syndrome,ACS)或高危冠状动脉疾病(coronary artery disease,CAD)的患者,但遗憾的是其Ⅱ期临床试验已宣告终止;F16618、F16357、ML161仍处在临床前研究阶段。
1.1 vorapaxarvorapaxar商品名为Zonitivity,是先灵葆雅公司基于天然产物himbacine结构改造后首创的口服、选择性、竞争性PAR-1拮抗剂。临床前研究表明:vorapaxar在体外可有效抑制由10 nmol/L凝血酶和15 μmol/L高亲和力凝血酶受体活化肽(high affinity thrombin receptor actived peptide,haTRAP)诱导的血小板聚集反应(IC50分别为47、25 nmol/L)。但该药对其他血小板活化剂如ADP、胶原蛋白、PAR-4活化肽和血栓烷素模拟物U46619诱导的血小板聚集反应无明显影响[5]。
Ⅰ期和Ⅱ期的临床试验结果表明,vorapaxar可有效降低心肌梗死的发生率,且未导致中重度出血等不良反应[6-8]。随后开展的Ⅲ期临床试验分别评价了vorapaxar联用阿司匹林和氯吡格雷对ACS患者的有效性和安全性(TRA·CER试验)和vorapaxar作为动脉粥样硬化疾病二级预防辅助药物的有效性和安全性(TRA 2P-TIMI 50试验)。然而,两项临床试验均发现vorapaxar组出现了更多的出血事件,颅内出血风险也有所上升。尽管如此,vorapaxar还是表现出一定疗效:在TRA·CER试验中,治疗组的心肌梗死发生率明显下降(11.1% vs 12.5%,P<0.05);而在TRA 2P-TIMI 50试验中,包括心血管原因死亡、心肌梗死和中风在内的主要临床终点发生率也明显降低(9.3% vs 10.5%,P<0.001),次要终点发生率也有所下降[9-10]。基于上述试验结果,vorapaxar于2014年被FDA批准上市,成为首个作用于PAR-1靶点的口服抗血栓药物。
最近Chelliah等[11-12]报道了一系列vorapaxar衍生物1~3,与vorapaxar比较,这些化合物对PAR-1的体外拮抗活性相当或稍强,药动学性质有所改善。Knight等[13]对C-9位置进行了羰基化,得到化合物4,该化合物表现出接近于Vorapaxar的体外PAR-1拮抗活性。见图 2。
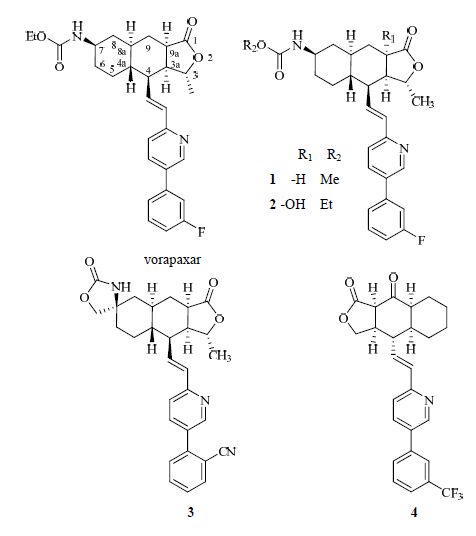
|
图 2 vorapaxar及其衍生物 Fig. 2 Structures of vorapaxar and derivatives |
1.2 atopaxar
atopaxar又名E5555,是由日本卫材株式会社开发的可逆性口服PAR-1拮抗剂,结构见图 3。该化合物经CYP3A4代谢,通过胃肠道消除[14]。临床前研究表明atopaxar可强效抑制凝血酶和凝血酶受体激活肽(TRAP)诱导的血小板聚集反应(IC50分别为0.064、0.031 μmol/L)[15]。Ⅰ期临床试验证实atopaxar在各个治疗组的有效性,且并未发生明显的出血不良反应。后续开展的4项Ⅱ期临床试验评价了atopaxar应用于ACS和CAD患者的安全性。结果表明,治疗组和安慰剂组在总出血概率方面未呈现统计学差异。相对于安慰剂组,治疗组总的主要心血管不良事件发生概率也未有增加。然而,在各项试验的高剂量组,均发现了肝功异常和QT间期延长的现象,且该药缺乏明确的量效关系[16-18],因此日本卫材株式会社已终止了atopaxar的开发。
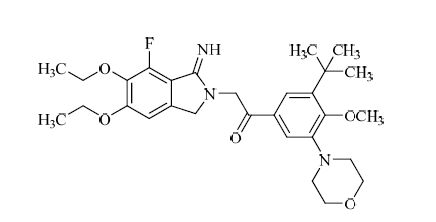
|
图 3 atopaxar的结构 Fig. 3 Structure of atopaxar |
1.3 F16618和F16357
F16618、F16357是由法国Pierre Fabre研究中心基于肉桂哌嗪结构开发的PAR-1拮抗剂,结构见图 4。体外活性测试表明F16618、F16357可有效抑制TRAP诱导的人血小板聚集反应。为进一步证明化合物的体内活性,研究者构建了大鼠的体外动静脉分流模型,以TRAP诱导的血小板聚集抑制率和血管堵塞时间增加率为指标,分别评价经静脉给药(1.25 mg/kg)和口服给药(40 mg/kg)后化合物的抗血小板聚集活性。结果表明,相对于对照药atopaxar(pKb=8.18),F16618(pKb=5.30)、F16357(pKb=5.52)均略低。但是,两者更有效地延长了堵塞时间。总之,在该模型中,F16618、F16357均表现出一定的抗血栓活性[19]。此外,F16618、F16357对PAR-1具有一定的选择性,且对出血时间没有明显影响。加之F16618、F16357的药动学性能良好,合成简单,使其具有一定的开发潜能。
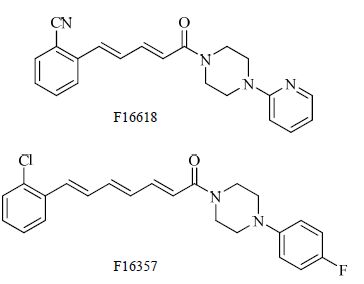
|
图 4 F16618和F16357结构 Fig. 4 Structures of F16618 and F16357 |
1.4 ML161
2012年,Dockendorff等[20]通过高通量筛选发现了新型PAR-1拮抗剂ML161。构效关系研究表明,化合物结构中的1,3-苯二胺骨架对活性发挥着关键的影响,结构见图 5。体外PAR-1拮抗活性测试表明,ML161能够显著抑制由TARP诱导的人血小板表面P-selectin蛋白的表达,且对PAR-1具有一定的选择性。此外,ML161可能以一种全新的“别构调节”机制拮抗PAR-1,即选择性调节下游的G蛋白信号通路。在TARP诱导的人血小板聚集反应测试中,研究者发现ML161仅抑制了血小板的分泌反应,对血小板形状改变没有影响[20]。这种独特的作用机制有可能减少临床应用上出血等不良反应的发生,值得后续深入研究。
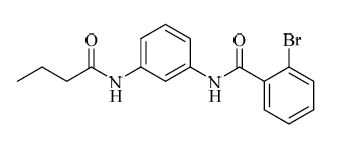
|
图 5 ML161的结构 Fig. 5 Structure of ML161 |
2 多肽类PAR-1拮抗剂
多肽类拮抗剂包括RWJ-58259、PZ-128等。RWJ-58259是早期研发的PAR-1选择性拮抗剂,目前主要作为生物探针应用于PAR-1领域的研究;PZ-128由塔芙茨医疗中心开发,目前正处于临床Ⅱ期试验阶段。
2.1 RWJ-58259RWJ-58259是由强生公司研发的一种选择性PAR-1拮抗剂,结构见图 6。在人体血小板的体外活性测试中,该药可强效抑制由凝血酶介导的血小板活化作用(IC50=0.37 μmol/L)。在非人类灵长类动物血栓形成模型中,RWJ-58259也能产生有效的抑制效果。然而,人肝微粒体代谢测试发现,RWJ-58259的半衰期(t1/2)仅为9.2 min;大鼠静脉给药后的t1/2也仅为19.2 min[21]。药动学性质的缺陷使得RWJ- 58259的研究止步于临床前研究。目前,该化合物主要作为生物探针应用于相关方面。
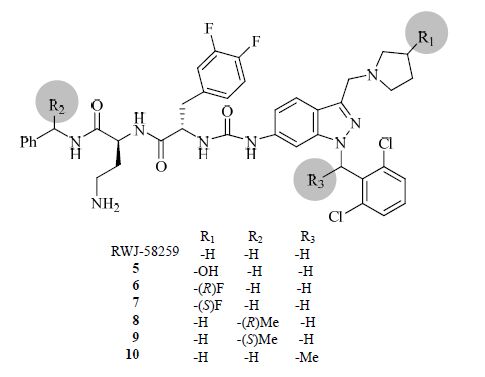
|
图 6 RWJ-58259及其衍生物的结构 Fig. 6 Structures of RWJ-58259 and derivatives |
近期,Robinson等[22]合成了一系列RWJ-58259的类似物,见图 6,旨在保留化合物活性的同时改善其药动学性质。研究者首先通过计算机模拟,预测出RWJ-58259的代谢活性位点;随后在活性位点引入不同基团,以“封闭”活性位点,减少化合物的代谢分解。最终,经细胞内Ca2+水平测试,研究者发现了与RWJ-58259活性相当或稍强的化合物5~10,同时这些化合物的代谢稳定性也得到改善。
2.2 PZ-128PZ-128是由塔芙茨医疗中心开发的一种高效、可逆转的新型PAR-1拮抗剂,该药的结构来源于靶点蛋白ICL3和TM6之间的氨基酸序列,见图 7。
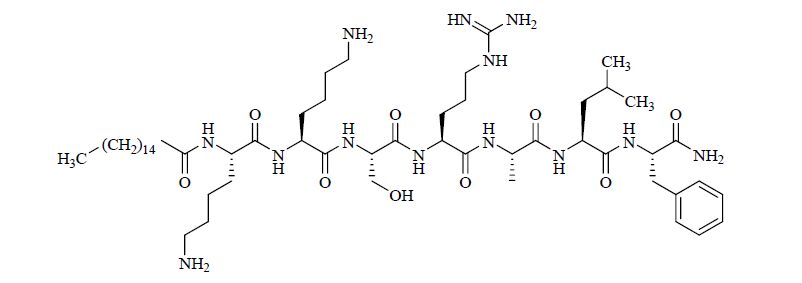
|
图 7 PZ-128的结构 Fig. 7 Structure of PZ-128 |
该区域在PAR-1与G蛋白之间信号转导中发挥重要作用[23]。实验证明,PZ-128可迅速高效地定位于细胞膜表面,并穿过磷脂双分子层进入细胞内部,通过稳定或模拟非活性状态下的PAR-1,进而抑制激活态PAR-1介导的血小板聚集。该机制完全不同于传统PAR-1拮抗剂的作用方式,因此PZ-128有望成为治疗冠状动脉疾病的新型药物[24]。临床前研究证明PZ-128经静脉注射可迅速起效,抑制PAR-1介导的血小板聚集以及动脉血栓生成,且与氯吡格雷有着强烈的协同效应。
PZ-128的Ⅰ期临床试验旨在评价该药对CAD患者的有效性、安全性以及药动学性质[25]。研究表明PZ-128对由TRAP(8 μmol/L)诱发的血小板聚集效应抑制效果明显,且呈现出剂量相关性。此外,该药能够专一性地抑制PAR-1诱导的血小板聚集反应,对ADP、胶原蛋白诱导的血小板聚集反应无抑制作用。而且PZ-128对凝血、心电图等重要参数未产生明显影响。目前PZ-128的Ⅱ期临床试验正在进行,以进一步评价其针对非紧急经皮冠状动脉介入治疗(PCI)患者的有效性和安全性。
3 小结针对PAR-1的作用机制及其拮抗剂的研究已取得较大进展。vorapaxar作为首个被批准的口服小分子PAR-1抑制剂,已被用于有心脏病发作史患者以及动脉栓塞患者。但出血风险增加等不良反应限制了该药物的进一步应用。而新近出现的多肽类拮抗剂PZ-128在保留了抗血小板活性的同时表现出专一性强、安全性好等优点。相信在不久的将来,经过广大药学工作者的艰苦努力,更加安全有效的新型PAR-1拮抗剂一定能用于临床,造福广大患者。
| [1] |
Vu T K, Hung D T, Wheaton V, et al.
Molecular cloning of a functional thrombin receptor reveals a novel proteolytic mechanism of receptor activation[J]. Cell, 1991, 64(6) : 1057–1068.
DOI:10.1016/0092-8674(91)90261-V ( 0) 0)
|
| [2] |
Kahn M L, Nakanishi-matsui M, Shapiro M J, et al.
Protease-activated receptors 1 and 4 mediate activation of human platelets by thrombin[J]. J Clin Invest, 1999, 103(6) : 879–887.
DOI:10.1172/JCI6042 ( 0) 0)
|
| [3] |
Ramachandran R, Noorbakhsh F, Defea K, et al.
Targeting proteinase-activated receptors:therapeutic potential and challenges[J]. Nat Rev Drug Discov, 2012, 11(1) : 69–86.
DOI:10.1038/nrd3615 ( 0) 0)
|
| [4] |
Adams M N, Ramachandran R, Yau M K, et al.
Structure, function and pathophysiology of protease activated receptors[J]. Pharmacol Ther, 2011, 130(3) : 248–282.
DOI:10.1016/j.pharmthera.2011.01.003 ( 0) 0)
|
| [5] |
Chackalamannil S, Wang Y, Greenlee WJ, et al.
Discovery of a novel, orally active himbacine-based thrombin receptor antagonist (SCH 530348) with potent antiplatelet activity[J]. J Med Chem, 2008, 51(11) : 3061–3064.
DOI:10.1021/jm800180e ( 0) 0)
|
| [6] |
Becker R C, Moliterno D J, Jennings L K, et al.
Safety and tolerability of SCH 530348 in patients undergoing non-urgent percutaneous coronary intervention:a randomised, double-blind, placebo-controlled phase II study[J]. Lancet, 2009, 373(9667) : 919–928.
DOI:10.1016/S0140-6736(09)60230-0 ( 0) 0)
|
| [7] |
Goto S, Yamaguchi T, Ikeda Y, et al.
Safety and exploratory efficacy of the novel thrombin receptor (PAR-1) antagonist SCH530348 for non-ST-segment elevation acute coronary syndrome[J]. J Atheroscler Thromb, 2010, 17(2) : 156–164.
DOI:10.5551/jat.3038 ( 0) 0)
|
| [8] |
Shinohara Y, Goto S, Doi M, et al.
Safety of the novel protease-activated receptor-1 antagonist vorapaxar in Japanese patients with a history of ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2012, 21(4) : 318–324.
DOI:10.1016/j.jstrokecerebrovasdis.2010.09.005 ( 0) 0)
|
| [9] |
Tricoci P, Huang Z, Held C, et al.
Thrombin-receptor antagonist vorapaxar in acute coronary syndromes[J]. N Engl J Med, 2012, 366(1) : 20–33.
DOI:10.1056/NEJMoa1109719 ( 0) 0)
|
| [10] |
Morrow D A, Braunwald E, Bonaca M P, et al.
Vorapaxar in the secondary prevention of atherothrombotic events[J]. N Engl J Med, 2012, 366(15) : 1404–1413.
DOI:10.1056/NEJMoa1200933 ( 0) 0)
|
| [11] |
Chelliah M V, Chackalamannil S, Xia Y, et al.
Himbacine-derived thrombin receptor antagonists:c7-aminomethyl and c9a-hydroxy analogues of vorapaxar[J]. ACS Med Chem Lett, 2013, 5(2) : 183–187.
( 0) 0)
|
| [12] |
Chelliah M V, Eagen K, Guo Z, et al.
Himbacine-derived thrombin receptor antagonists:c7-spirocyclic analogues of vorapaxar[J]. ACS Med Chem Lett, 2014, 5(5) : 561–565.
DOI:10.1021/ml500008w ( 0) 0)
|
| [13] |
Knight E, Robinson E, Smoktunowicz N, et al.
Synthesis of novel and potent vorapaxar analogues[J]. Org Biomol Chem, 2016, 14(12) : 3264–3274.
DOI:10.1039/C5OB02541A ( 0) 0)
|
| [14] |
Rollini F, Tello-Montoliu A, Angiolillo D J.
Atopaxar:a review of its mechanism of action and role in patients with coronary artery disease[J]. Future Cardiol, 2012, 8(4) : 503–511.
DOI:10.2217/fca.12.35 ( 0) 0)
|
| [15] |
Kogushi M, Matsuoka T, Kawata T, et al.
The novel and orally active thrombin receptor antagonist E5555(Atopaxar) inhibits arterial thrombosis without affecting bleeding time in guinea pigs[J]. Eur J Pharmacol, 2011, 657(1-3) : 131–137.
DOI:10.1016/j.ejphar.2011.01.058 ( 0) 0)
|
| [16] |
O'Donoghue M L, Bhatt D L, Wiviott S D, et al.
Safety and tolerability of atopaxar in the treatment of patients with acute coronary syndromes:the lessons from antagonizing the cellular effects of Thrombin-Acute Coronary Syndromes Trial[J]. Circulation, 2011, 123(17) : 1843–1853.
DOI:10.1161/CIRCULATIONAHA.110.000786 ( 0) 0)
|
| [17] |
Wiviott S D, Flather M D, O'Donoghue M L, et al.
Randomized trial of atopaxar in the treatment of patients with coronary artery disease:the lessons from antagonizing the cellular effect of Thrombin-Coronary Artery Disease Trial[J]. Circulation, 2011, 123(17) : 1854–1863.
DOI:10.1161/CIRCULATIONAHA.110.001404 ( 0) 0)
|
| [18] |
Goto S, Ogawa H, Takeuchi M, et al.
Double-blind, placebo-controlled Phase II studies of the protease-activated receptor 1 antagonist E5555(atopaxar) in Japanese patients with acute coronary syndrome or high-risk coronary artery disease[J]. Eur Heart J, 2010, 31(21) : 2601–2613.
DOI:10.1093/eurheartj/ehq320 ( 0) 0)
|
| [19] |
Perez M, Lamothe M, Maraval C, et al.
Discovery of novel protease activated receptors 1 antagonists with potent antithrombotic activity in vivo[J]. J Med Chem, 2009, 52(19) : 5826–5836.
DOI:10.1021/jm900553j ( 0) 0)
|
| [20] |
Dockendorff C, Aisiku O, Verplank L, et al.
Discovery of 1,3-diaminobenzenes as selective Inhibitors of platelet activation at the PAR1 receptor[J]. ACS Med Chem Lett, 2012, 3(3) : 232–237.
DOI:10.1021/ml2002696 ( 0) 0)
|
| [21] |
Damiano B P, Derian C K, Maryanoff B E, et al.
RWJ-58259:a selective antagonist of protease activated receptor-1[J]. Cardiovasc Drug Rev, 2003, 21(4) : 313–326.
( 0) 0)
|
| [22] |
Robinson E, Knight E, Smoktunowicz N, et al.
Identification of an active metabolite of PAR-1 antagonist RWJ-58259 and synthesis of analogues to enhance its metabolic stability[J]. Org Biomol Chem, 2016, 14(12) : 3198–3201.
DOI:10.1039/C6OB00332J ( 0) 0)
|
| [23] |
Covic L, Gresser A L, Talavera J, et al.
Activation and inhibition of G protein-coupled receptors by cell-penetrating membrane-tethered peptides[J]. Proc Natl Acad Sci U S A, 2002, 99(2) : 643–648.
DOI:10.1073/pnas.022460899 ( 0) 0)
|
| [24] |
Zhang P, Gruber A, Kasuda S, et al.
Suppression of arterial thrombosis without affecting hemostatic parameters with a cell-penetrating PAR1 pepducin[J]. Circulation, 2012, 126(1) : 83–91.
DOI:10.1161/CIRCULATIONAHA.112.091918 ( 0) 0)
|
| [25] |
Gurbel P A, Bliden K P, Turner S E, et al.
Cell-penetrating pepducin therapy targeting PAR1 in subjects with coronary artery disease[J]. Arterioscler Thromb Vasc Biol, 2016, 36(1) : 189–197.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


