肺癌是最常见的恶性肿瘤之一,源于腺体或支气管黏膜,其发病率位于肿瘤排行榜第一位,且仍在逐年增加[1]。按照病理学分类可分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两类,其中NSCLC占肺癌总数的70%~85%[2],传统化疗对晚期肺癌患者的效果已达平台期。近年来,靶向药物治疗是研究的热点[3],小分子靶向药物的陆续问世,使得晚期NSCLC患者的预后改善。有研究表明继表皮生长因子受体(EGFR)基因后棘皮动物微管相关蛋白样4-间变淋巴瘤激酶(EML4-ALK)被确认为是NSCLC的驱动基因。克唑替尼是EML4-ALK基因的选择性抑制剂。间变淋巴瘤激酶(ALK)基因阳性在NSCLC患者中发生率并不高,3%~13%,ALK阳性的发生率在腺癌患者中约2%~7%[4],ALK阳性发生率在中国NSCLC患者中为3.3%~6.1%[5]。在2007年,克唑替尼成为第一个进入Ⅰ期临床试验的EML4-ALK抑制剂,随后进行的Ⅰ、Ⅱ、Ⅲ期临床试验表明克唑替尼疗效明显优于传统的化疗方案[6-9]。美国食品药品管理局(FDA)于2011年8月批准采用克唑替尼治疗ALK基因阳性的晚期NSCLC患者[10],之后国内外学者们都对克唑替尼疗效及副作用进行了跟踪观察,国内起步较晚,需要对其对ALK阳性晚期NSCLC患者临床效果进行深入评价。本研究对克唑替尼联合紫杉醇和顺铂治疗ALK阳性NSCLC的临床疗效,其肿瘤标志物水平,不良反应和生存情况的影响进行回顾性分析。
1 材料与方法 1.1 临床资料选取2012年1月—2014年3月在榆林市第一医院接受治疗的ALK阳性NSCLC患者67例为研究对象。其中男36例,女31例;平均年龄(50.4±9.3)岁;腺癌24例,鳞癌34例,大细胞癌9例;吸烟49例,无吸烟史18例;Ⅲ期42例,Ⅳ期25例,分期按国际抗癌联盟(UICC)肺癌TNM分期标准(第7版)进行。所有患者均签署知情同意书,所有治疗方案都经过院伦理委员会同意后执行。
纳入标准:(1)经组织学与细胞学检查诊断确诊为NSCLC,且免疫荧光原位杂交技术(FISH)检测ALK基因为阳性(肿瘤细胞中断裂信号比例≥15%);(2)卡氏体能状态(KPS)评分>70分;(3)年龄18岁以上;(4)心、肝、肾、骨髓功能正常;(5)经电子计算机断层扫描(CT)发现可测量病灶;(6)患者的预计生存期>3个月。
排除标准:(1)患其他肿瘤的患者;(2)患糖尿病、高血压及心脏病的患者;(3)患有肝肾功能疾病的患者;(4)妊娠或哺乳期妇女;(5)中途失访的患者;(6)不宜参加本研究的其他情况的患者。
1.2 药物紫杉醇注射液由赫思澳大利亚有限公司生产,规格5 mL∶30 mg,产品批号HAAT20110814;顺铂注射液由赫思澳大利亚有限公司生产,规格50 mL∶50 mg,产品批号HASB20110309;克唑替尼胶囊由辉瑞制药有限公司生产,规格250 mg/粒,产品批号PF20110930。
1.3 分组和治疗方法所有患者随机分为对照组(33例)和治疗组(34例)。对照组男18例,女15例;平均年龄(51.8±7.4)岁;腺癌11例,鳞癌17例,大细胞癌5例;吸烟8例,无吸烟史25例;Ⅲ期20例,Ⅳ期13例。治疗组男18例,女16例;平均年龄(49.3±8.9)岁;腺癌13例,鳞癌17例,大细胞癌4例;吸烟10例,无吸烟史24例;Ⅲ期22例,Ⅳ期12例。两组患者一般资料比较无显著差异,具有可比性。
对照组静脉滴注紫杉醇注射液175 mg/m2,1次/d;并于停药30 min后静脉滴注顺铂注射液75 mg/m2,1次/d。治疗组在对照组基础上口服克唑替尼胶囊,1粒/次,2粒/d。两组均治疗2个月,并随访24个月。
1.4 临床疗效评估标准[11]完全缓解(CR):目标病灶消失;部分缓解(PR):肿瘤病灶最长径之和与基线状态比较减少30%以上;疾病稳定(SD):肿瘤直径缩小范围处于PR与SD之间;疾病进展(PD):肿瘤病灶最长径之和与基线状态比较增长程度大于30%以上。
有效率=(CR+PR)/总例数
1.5 观察指标患者首次疗效评价时间为口服克唑替尼1个周期(28 d)后,以后每2个周期作1次评价,直至随访(24个月)结束。无进展生存期(PFS)被定义为第1次服用克唑替尼治疗至第1次出现疾病进展的时间。
清晨抽取两组患者治疗前后静脉血各5mL,离心后取上清液,冷冻保存。患者血清癌胚抗原(CEA)、糖类抗原(CA125)及细胞角蛋白19片段(CYFRA21-1)含量采用化学发光免疫分析法检测。
1.6 不良反应观察两组患者在治疗过程中不良反应发生情况,包括恶心呕吐、肝功能异常、血小板降低、骨髓抑制、视觉效应、腹泻、便秘和水肿等。不良反应评价标准按美国国家癌症研究所制定的药物不良反应标准(CTCAE第4.0版)进行分级[12],按严重程度分为1~5级。
1.7 统计学方法采用 SPSS 18.0统计软件对收集的数据进行统计学处理,定量资料以x±s描述,组间比较采用t检验,计数资料采用χ2检验。患者的生存曲线绘制采用Kaplan-Meier法,用对log-rank数秩检验进行生存情况单因素分析。
2 结果 2.1 两组临床疗效比较治疗后,对照组PR为9例,有效率为27.27%;治疗组PR为21例,有效率为61.76%,两组有效率比较差异有统计学意义(P<0.05),见表 1。
| 表 1 两组临床疗效比较 Table 1 Comparison on clinical efficacies between two groups |
2.2 两组血清肿瘤标志物比较
治疗后,两组CEA、CA125和Cyfra21-1水平均显著降低,同组治疗前后比较差异有统计学意义(P<0.05、0.01);且治疗组这些观察指标的下降程度明显优于对照组,两组比较差异具有统计学意义(P<0.05),见表 2。
| 表 2 两组血清肿瘤标志物比较(x ± s) Table 2 Comparison on serum tumor marker between two groups (x ± s) |
2.3 两组生存率比较
治疗结束后,每2个月随访1次,随访24个月,无患者失访。对照组8例患者死亡,死亡率为24.24%,中位PFS为13个月;治疗组中5例患者死亡,死亡率为14.71%,中位PFS为17个月。治疗组生存率明显高于对照组,比较差异有统计学意义(P<0.000 1),见图 1。
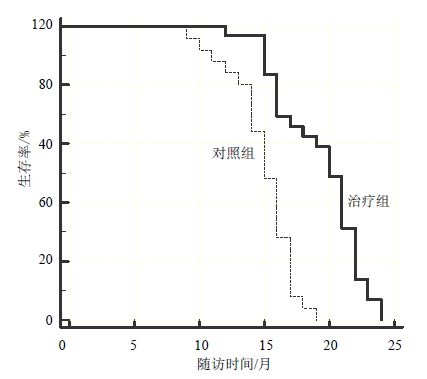
|
图 1 两组生存率比较 Fig. 1 Comparison on survival rate between two groups |
2.4 两组不良反应比较
经治疗后,两组患者均出现恶心呕吐、肝功能异常、血小板降低、骨髓抑制、视觉效应、腹泻、便秘和水肿等不良反应,在对症治疗后,症状均缓解并完成治疗。治疗组视觉效应、腹泻、便秘和水肿的发生高于对照组,而对照组恶心呕吐、肝功能异常、血小板降低、骨髓抑制的发生高于治疗组,但两组不良反应比较差异无统计学意义,见表 3。
| 表 3 两组不良反应比较 Table 3 Comparison on adverse reactions between two groups |
3 讨论
NSCLC患者约占肺癌患者总数的70%~85%,且患者多数在确诊时已经为中晚期,常出现转移,临床上主要采用化疗来治疗晚期NSCLC患者,可以部分有效控制病情,可以有效提高生存率[13]。临床上现如今主要采用含铂类联合化疗方案来治疗NSCLC患者,该方案对分期较差的患者治疗效果较好[14],但治疗中老年患者不良反应率较高[15]。
近年来,分子靶向治疗为晚期NSCLC患者的治疗提供一个新方向,EGFR基因激活突变或ALK基因重排的肿瘤患者可以通过EGFR或ALK抑制剂进行分子靶向治疗[16]。ALK阳性患者是NSCLC中一个独立的亚群,多发生于不吸烟、较年轻的肺癌患者,与EGFR及K-ras突变同时存在的概率很低[17-18]。自从在NSCLC患者中发现EML4-ALK基因以来,克唑替尼作为针对ALK基因阳性的NSCLC患者靶向药物越来越受到人们的关注。克唑替尼主要通过剂量相关性的方式抑制细胞内ALK与c-Met激酶磷酸化,选择性抑制ALK,同时上调Bim基因的表达水平和下调抗凋亡蛋白B淋巴细胞瘤-2(Bcl-2)、B细胞淋巴瘤-特大(Bcl-xL),从而抑制肿瘤细胞的增殖,促进肿瘤细胞的凋亡[19]。该治疗方案对EML4-ALK阳性的NSCLC患者疗效高,无进展生存期长,反作用小[20]。并且国外Ⅱ期临床试验结果说明克唑替尼对ALK阳性晚期NSCLC患者疗效比传统方法好[21],可见克唑替尼值得在ALK阳性晚期NSCLC患者临床治疗中推广应用[22]。
CEA糖蛋白是一种广谱的肿瘤标志物[23]。CA125可用于肺癌、卵巢癌、子宫内膜癌、肠癌患者的评价诊断[24]。CYFRA21-1作为诊断NSCLC的特异性指标,其血清浓度与肿瘤临床分期呈现正相关,可用来预测患者病情。本研究中,两组患者治疗后血清CEA、CA125和Cyfra21-1水平与治疗前相比明显降低,比较差异具有统计学意义(P<0.05),说明接受传统和靶向药物治疗都够降低患者肿瘤标志物水平。本研究中,治疗组患者治疗后血清CEA、CA125和Cyfra21-1水平明显低于对照组治疗后,说明应用靶向药物治疗的患者CEA、CA125和Cyfra21-1水平降低的程度较高,可能与克唑替尼靶向性阻断生长因子受体等有关。
本研究中,对照组患者治疗有效率显著低于治疗组,治疗组患者生存率明显高于对照组,说明应用克唑替尼治疗晚期NSCLC患者可以有效减少病情恶化。
在本研究中,两种不同方案治疗后发现,两组均出现不良反应,治疗组在视觉效应、腹泻、便秘和水肿的发生上高于对照组,而恶心呕吐、肝功能异常、血小板降低、骨髓抑制的发生则低于对照组。治疗组大部分不良反应分级为Ⅰ、Ⅱ级。大部分患者可以耐受克唑替尼的不良反应,患者经过两年随访后,通过Kaplan-Meier生存分析,治疗组患者中位PFS也明显长于对照组。说明接受克唑替尼联合紫杉醇和顺铂方案化疗的患者死亡率较常规化疗方案治疗的患者的低,治疗效果较好。
综上所述,克唑替尼联合紫杉醇和顺铂治疗ALK阳性NSCLC具有较好的临床疗效,可降低血清肿瘤标志物水平,延长中位PFS,提高患者的生存率,具有一定的临床推广应用价值。
| [1] |
葛均波, 徐永健.
内科学[M]. 第8版, 北京: 人民卫生出版社, 2013: 262.
( 0) 0)
|
| [2] |
Michelsen L, Sørensen J B.
Platinum-vinorelbine induction chemotherapy plus bevacizumab with and without pemetrexed switch maintenance in advanced NSCLC[J]. Anticancer Res, 2015, 35(11) : 6255–6259.
( 0) 0)
|
| [3] |
Xu L, Lei J, Wang Q Z, et al.
Clinical characteristics of patients with non-small cell lung cancers harboring anaplastic lymphoma kinase rearrangements and primary lung adenocarcinoma harboring epidermal growth factor receptor mutations[J]. Genet Mol Res, 2014, 14(4) : 12973–12983.
( 0) 0)
|
| [4] |
Casaluce F, Sgambato A, Maione P, et al.
ALK inhibitors:a new targeted therapy in the treatment of advanced NSCLC[J]. Target Oncol, 2013, 8(1) : 55–67.
DOI:10.1007/s11523-012-0250-9 ( 0) 0)
|
| [5] |
刘标, 时姗姗, 王璇, 等.
2011年肺腺癌新分类在评估组织学类型与分子学改变相关性中的意义[J]. 中华病理学杂志, 2012, 41(8) : 505–510.
( 0) 0)
|
| [6] |
Solomon B J, Mok T, Kim D W, et al.
First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J]. N Engl J Med, 2014, 371(23) : 2167–2177.
DOI:10.1056/NEJMoa1408440 ( 0) 0)
|
| [7] |
Phase III trial shows crizotinib superior to single-agent chemotherapy for ALK-positive advanced NSCLC[C]. Vienna:ESMO Congress, 2012.
( 0) 0)
|
| [8] |
Crino L, Kim D, Riely G J, et al. Initial phase II results with crizotinib in advanced ALK-positive non-small cell lung cancer (NSCLC):PROFILE 1005[C]. Chicago:ASCO Annual Meeting Proceedings, 2011.
( 0) 0)
|
| [9] |
Shaw A T, Kim D W, Nakagawa K, et al.
Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J]. N Engl J Med, 2013, 368(25) : 2385–2394.
DOI:10.1056/NEJMoa1214886 ( 0) 0)
|
| [10] |
董江萍.
FDA批准克里唑替尼及其基因测试法治疗晚期非小细胞肺癌[J]. 药物评价研究, 2011, 34(5) : 402.
( 0) 0)
|
| [11] |
Chung W S, Park M S, Shin S J, et al.
Response evaluation in patients with colorectal liver metastases:RECIST version 1.1 versus modified CT criteria[J]. AJR Am J Roentgenol, 2012, 199(4) : 809–815.
DOI:10.2214/AJR.11.7910 ( 0) 0)
|
| [12] |
Diane MF Savarese.
Common terminology criteria for adverse events (CTCAE). version 4.0[J]. National Institutes of Health, National Cancer Institute, 2009, 4(3).
( 0) 0)
|
| [13] |
何雅億, 周彩存, 牛飞玉.
克唑替尼和化疗在进展期ALK阳性肺癌患者中的疗效比较[J]. 循证医学, 2014, 14(1) : 45–47.
( 0) 0)
|
| [14] |
Kalikaki A, Voutsina A, Koutsopoulos A, et al.
ERCC1 SNPs as potential predictive biomarkers in non-small cell lung cancer patients treated with platinum-based chemotherapy[J]. Cancer Invest, 2015, 33(4) : 107–113.
DOI:10.3109/07357907.2014.1001897 ( 0) 0)
|
| [15] |
Zhang T, Zhang D M, Zhao D, et al.
Osteopontin expression is associated with platinum-based chemotherapy response and prognosis of patients with advanced non small cell lung cancer[J]. J BUON, 2014, 19(3) : 742–748.
( 0) 0)
|
| [16] |
Shaw A T, Kim D W, Mehra R, et al.
Ceritinib in ALK-rearranged non-small-cell lung cancer[J]. N Engl J Med, 2014, 370(13) : 1189–1197.
DOI:10.1056/NEJMoa1311107 ( 0) 0)
|
| [17] |
Yang J J, Zhang X C, Su J, et al.
Lung cancers with concomitant EGFR mutations and ALK rearrangements:diverse responses to EGFR-TKI and crizotinib in relation to diverse receptors phosphorylation[J]. Clin Cancer Res, 2014, 20(5) : 1383–1392.
DOI:10.1158/1078-0432.CCR-13-0699 ( 0) 0)
|
| [18] |
Zhao N, Zheng S Y, Yang J J, et al.
Lung adenocarcinoma harboring concomitant EGFR mutation and EML4-ALK fusion that benefits from three kinds of tyrosine kinase inhibitors:a case report and literature review[J]. Clin Lung Cancer, 2015, 16(2) : e5–9.
DOI:10.1016/j.cllc.2014.11.001 ( 0) 0)
|
| [19] |
Cui J J, Tran-Dubé M, Shen H, et al.
Structure based drug design of crizotinib (PF-02341066), a potent and selective dual inhibitor of mesenchymal-epithelial transition factor (c-MET) kinase and anaplastic lymphoma kinase (ALK)[J]. J Med Chem, 2011, 54(18) : 6342–6363.
DOI:10.1021/jm2007613 ( 0) 0)
|
| [20] |
Shaw A, Yeap B, Solomon B, et al. Impact of crizotinib on survival in patients with advanced, ALK-positive NSCLC compared with historical controls[C]. Chicago:ASCO Annual Meeting Proceedings, 2011.
( 0) 0)
|
| [21] |
Kim D W, Ahn M J, Shi Y, et al. Results of a global phase II study with crizotinib in advanced ALK-positive non-small cell lung cancer (NSCLC)[C]. Chicago:ASCO Annual Meeting Proceedings, 2012.
( 0) 0)
|
| [22] |
Cao Y, Xiao G, Qiu X, et al.
Efficacy and safety of crizotinib among chinese EML4-ALK-positive, advanced-stage non-small cell lung cancer patients[J]. PLoS One, 2014, 9(12) : e114008.
DOI:10.1371/journal.pone.0114008 ( 0) 0)
|
| [23] |
Yu D H, Li J H, Wang Y C, et al.
Serum anti-p53 antibody detection in carcinomas and the predictive values of serum p53 antibodies, carcino-embryonic antigen and carbohydrate antigen 12-5 in the neoadjuvant chemotherapy treatment for III stage non-small cell lung cancer patients[J]. Clin Chim Acta, 2011, 412(11) : 930–935.
( 0) 0)
|
| [24] |
Wang X F, Wu Y H, Wang M S, et al.
CEA, AFP, CA125, CA153 and CA199 in malignant pleural effusions predict the cause[J]. Asian Pac J Cancer Prev, 2014, 15(1) : 363–368.
DOI:10.7314/APJCP.2014.15.1.363 ( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31

