2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
甲磺酸阿帕替尼化学名为N-[4-(1-氰基环戊基)苯基]-2-[(4-吡啶甲基)氨基]-3-吡啶甲酰胺甲磺酸盐,是一种酪氨酸激酶血管内皮生长因子受体-2抑制剂[1],用于治疗既往至少接受2种系统化疗后进展或复发的晚期胃腺癌或胃-食管结合部腺癌[2-3]。甲磺酸阿帕替尼的测定方法主要有HPLC法[4]和UV法[5],但是这些方法不仅需要对照品,而且操作繁琐消耗时间,并且UV法经常会受到样品中有紫外吸收杂质的干扰。由于核磁共振法定量检测具有样品需求量小、预处理简单,且不破坏化学结构等优点[6-7],因此本实验建立了核磁共振法测定甲磺酸阿帕替尼原料药中甲磺酸阿帕替尼的方法。该方法无需对照品、样品制备简单,检测结果准确,是一种有效的化学样品测定手段。
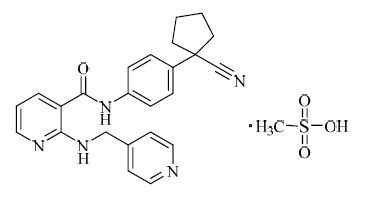
|
图 1 甲磺酸阿帕替尼的结构 Fig. 1 Structure of apatinib mesylate |
1 材料
Bruker Ascend 500型核磁共振谱仪(瑞士布鲁克公司),配有11.74 T的超屏蔽超导磁体,5 mm双核z-梯度探头(DUEL),BVT-2000温控单元和Topspin(3.2)实验控制与数据处理专用软件。Mettler Toledo XP205电子天平(Mettler Toledo公司)。
甲磺酸阿帕替尼原料药(江苏恒瑞医药股份有限公司,批号668110301)甲磺酸阿帕替尼对照品(中国食品药品检定研究院,批号101253-0201101,质量分数96.25%);DMSO-d6(Sigma公司,质量分数99.9%);内标1,4-二硝基苯(TCI Chemical,批号3EUXH-JB,质量分数99.0%)。乙腈为色谱纯,其他试剂均为分析纯。
2 方法 2.1 供试品溶液的制备精密称取甲磺酸阿帕替尼原料药、对照品、内标物1,4-二硝基苯适量,置同一离心管中,用DMSO-d6稀释,使磺酸阿帕替尼、1,4-二硝基苯浓度均约为0.03 mmol/L。取约0.7 mL以上溶液,转入5 mm核磁管中,备用。
2.2 参数设置[8]采用zg30脉冲序列在恒温(25 ℃)下获取1H-NMR谱。试验参数设置:谱宽(SWH)=10 000 Hz,射频中心频率(O1P)=3088 Hz,采样点数(TD)=64 K,采样时间(AQ)=3.3 s,驰豫延迟时间(D1)=20 s,采样次数(NS)=16次,空扫次数(DS)=2次,增益RG=89。
2.3 图谱定性分析测定甲磺酸阿帕替尼的1H-NMR谱,氢谱信号峰见图 2,氢谱解析和化学位移见表 1。
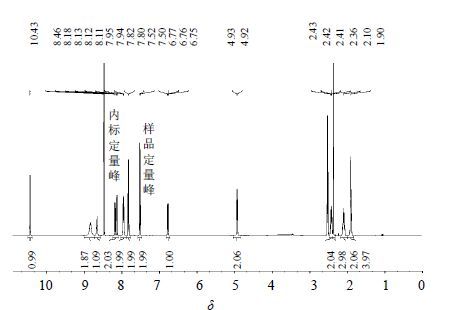
|
图 2 甲磺酸阿帕替尼样品与内标的核磁共振响应峰 Fig. 2 NMR peaks of apatinib mesylate sample and internal standard |
| 表 1 甲磺酸阿帕替尼的1H-NMR谱解析 Table 1 1H-NMR analysis of apatinib mesylate |
2.4 线性关系考察
分别精密称取甲磺酸阿帕替尼对照品5.87、10.48、15.93、20.60、24.76 mg和内标1,4-二硝基苯6.86、6.62、5.76、7.62、7.10 mg,置同一离心管中,精密加入1 mL DMSO-d6试剂使溶解,得0.01、0.02、0.03、0.04、0.05 mmol/L甲磺酸阿帕替尼对照品溶液和0.03 mmol/L 1,4-二硝基苯溶液。取约0.7 mL溶液转入5 mm核磁管中,测定1H-NMR谱,记录积分面积,以δ7.50处样品定量峰和δ8.46处内标峰面积比值为横坐标,甲磺酸阿帕替尼与1,4-二硝基苯质量比为纵坐标进行线性回归,得回归方程Y=6.093 90 X-0.035 41,R2=0.999 9,结果表明甲磺酸阿帕替尼在0.01~0.05 mmol/L线性关系良好。
2.5 精密度试验取0.03 mmol/L甲磺酸阿帕替尼对照品溶液,连续测定6次,记录积分面积,计算δ7.50处样品和δ8.46处内标峰面积定量峰面积比值,结果RSD值为0.78%。
2.6 重复性试验平行配制0.03 mmol/L甲磺酸阿帕替尼对照品溶液6份,按上述试验条件进行测定,以δ7.50处样品定量峰和δ8.46处内标峰面积比值计算甲磺酸阿帕替尼的平均质量分数,结果其RSD值为0.33%。
2.7 稳定性试验取0.03 mmol/L甲磺酸阿帕替尼对照品溶液分别在0、12 h进行测定,以δ7.50处样品定量峰和δ8.46处内标峰面积比值计算,结果其RSD值为0.36%,结果表明甲磺酸阿帕替尼对照品溶液在室温下放置12 h稳定。
2.8 样品测定取甲磺酸阿帕替尼原料药,平行配制6份溶液,采用以δ7.50处样品定量峰和δ8.46处内标峰面积比值定量峰,计算甲磺酸阿帕替尼质量分数,见表 2。原料药中甲磺酸阿帕替尼质量分数为96.66%,RSD值为0.33%。
| 表 2 甲磺酸阿帕替尼原料药中甲磺酸阿帕替尼的测定结果 Table 2 Determination of apatinib mesylate in apatinib mesylate raw materials method |
质量分数=[(AS/Ar)×(nr/ns)×(Ms/Mr)×Wr×mr]/ WS
AS为甲磺酸阿帕替尼定量峰的峰面积,Ar为内标的峰面积,ns为甲磺酸阿帕替尼定量峰包含的质子数(ns=2),nr为内标峰包含的质子数(nr=4),Ms为甲磺酸阿帕替尼的相对分子质量(493.58),Mr为内标的相对分子质量(168.11),WS为甲磺酸阿帕替尼的称样量,Wr为内标的称样量,mr为内标质量分数(99.0%)
为了验证核磁共振法测定结果的准确性,实验同时利用质量平衡法测定了甲磺酸阿帕替尼。采用HPLC法,Kromasil 100-5 C18色谱柱;流动相:磷酸盐缓冲液(pH 3.0)(A)-乙腈(B),梯度洗脱,0~10 min,70%A,10~20 min,40%A,20~31 min,25%A,31 min以后,70%A;体积流量1.2 mL/min;检测波长260 nm;进样量10 μL。采用不加校正因子的自身对照计算得质量分数为99.90%。卡氏水分仪测定样品中含水量为3.62%,残留溶剂量结果为0.03%,残渣未检出。根据质量平衡法计算原料中甲磺酸阿帕替尼的质量分数。质量分数=(100%-含水量-残留溶剂量-残渣量)×HPLC法质量分数=(100%-3.62%-0.03%-0)×99.90%=96.25%。
3 讨论 3.1 内标和定量峰的选择1,4-二硝基苯与甲磺酸阿帕替尼均易溶于DMSO-d6,且1,4-二硝基苯的响应信号出现在δ8.46,与甲磺酸阿帕替尼的所有响应信号有良好的分离,互不干扰。于是将1,4-二硝基苯选为内标。内标的响应信号在δ8.46处,样品在δ7.50处氢原子化学环境与内标氢原子类似,该处信号峰不仅与内标峰分离度良好且不受样品中其他氢原子信号峰影响,故选择δ7.50处信号峰为样品定量峰。
3.2 质量平衡法与核磁共振法结果比较甲磺酸阿帕替尼采用氢核磁共振法法定量结果为96.66%,RSD值为0.33%,质量平衡法测定结果为96.25%,两种方法测定结果基本一致,证明核磁共振法可以测定甲磺酸阿帕替尼。采用质量平衡法进行试验时,消耗样品约1 g,且经过数天试验才能得到甲磺酸阿帕替尼的质量分数,而采用核磁共振法对甲磺酸阿帕替尼进行定量时,样品消耗量小于100 mg,数小时内就可以得到结果,大大提高了实验效率。除此之外,核磁定量法测得的质量分数为样品的绝对含量,数据更准确更可靠。
本实验建立了氢核磁共振法法测定甲磺酸阿帕替尼原料药中甲磺酸阿帕替尼的方法,该定量方法样品制备简单,测定快速,结果准确,尤其适用于贵重或难以获得的样品,样品需求量小且无需对照品,可以广泛应用于药品质量控制
| [1] |
Tian S, Quan H T, Xie C Y, et al.
YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 107(7) : 1374–1380.
( 0) 0)
|
| [2] |
秦叔逵, 李进.
阿帕替尼治疗胃癌的临床应用专家共识[J]. 临床肿瘤学杂志, 2005, 20(9) : 841–847.
( 0) 0)
|
| [3] |
Li J, Zhao X M, Chen L, et al.
Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10 : 529.
DOI:10.1186/1471-2407-10-529 ( 0) 0)
|
| [4] |
江苏恒瑞医药股份有限公司. N-[4-(1-氰基环戊基)苯基]-2-[(4-吡啶甲基)氨基]-3-吡啶甲酰胺的盐[P]. 中国:CN200810149651.1, 2008-09-16.
( 0) 0)
|
| [5] |
杜秋江.
紫外分光光度法测定原料药中阿帕替尼的含量[J]. 淮海工学院学报:自然科学版, 2013, 22(1) : 38–40.
( 0) 0)
|
| [6] |
Li C Y, Xu H X, Han Q B, et al.
Quality assessment of Radix Codonopsis by quantitative nuclear magnetic resonance[J]. J Charomatogr A, 2009, 1216(11) : 2124–2429.
DOI:10.1016/j.chroma.2008.10.080 ( 0) 0)
|
| [7] |
罗乔奇, 田祥琴, 张琦, 等.
基于氢核磁共振-主成分分析建立洁尔阴洗液质量控制的研究[J]. 中草药, 2009, 40(12) : 1907–1911.
( 0) 0)
|
| [8] |
刘阳, 张才煜, 程奇蕾, 等.
核磁共振法测定13-顺阿维A[J]. 现代药物与临床, 2014, 29(3) : 251–254.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


 ,
,