2. 北京中医药大学 基础医学院, 北京 100029
2. The School of Preclinical Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
从中医经典方药中发现先导化合物的研究思路,引起越来越多学者的关注[1-4]。当前大量研究表明中医经典方药“桂枝甘草汤”中活性成分甘草次酸、肉桂酸及其类似物可以作为抗癌先导化合物发现的母体结构加以修饰[5-7]。已有研究发现,在甘草次酸的3-OH进行酯化反应,可以有效地提高其抗癌活性[8-9]。另外,肉桂酸及其类似物也因其具有良好的抗肿瘤活性被人们广泛研究[10-11]。其中有研究表明,化合物中接入肉桂酸分子可以增强药物的选择性[12]。因此,将甘草次酸与肉桂酸结合进行研究具有重要意义。本课题组前期基于“桂枝甘草汤”方中活性成分,借鉴中药的配伍法则和药物设计的结构拼合原理,设计、合成系列甘草次酸-肉桂酸衍生物,通过多种体外细胞模型筛选,发现该类结构具有良好的抗癌活性。但前期研究中并没有对3-O-(3-甲氧基肉桂酰)-甘草次酸酯(图 1)深入研究其细胞毒选择性及其抗癌作用的机制,故本实验在前期工作基础上,分别利用HepG2、Hela、HT-29、H9C2、MDCK和HY926细胞模型探讨该样品细胞毒性的选择性,并结合细胞染色法、流式细胞术探讨其作用机制。
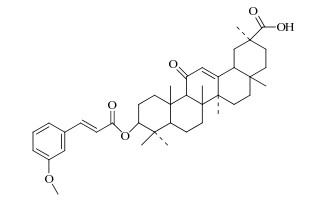
|
图 1 3-O-(3-甲氧基肉桂酰)-甘草次酸酯结构 Fig. 1 Structure of 3-O-(3-methoxy cinnamoyl)-glycyrrhetinic acid ester |
1 材料
人肝癌细胞系HepG2、人宫颈癌细胞HeLa由中国科学院纳米科研中心提供,人结肠癌细胞系HT-29、犬肾上皮细胞系MDCK、血管内皮细胞系HY926、心肌细胞系H9C2购于北京协和医院细胞资源中心。
RPMI-1640培养基、DMEM培养基、0.25%胰蛋白酶溶液、磷酸盐缓冲盐(PBS)、Gibco胎牛血清(FBS)、Giemsa染料、H33342染料均购自北京拜尔迪生物科技有限公司;无水乙醇(北京化工厂);Annexin V-FITC/PI细胞凋亡试剂盒(北京凯基生物有限公司);噻唑蓝(MTT,阿拉丁);二甲基亚砜(DMSO,北京化工厂);青链霉素混合液(100x,Solarbio,100 mL);3-O-(3-甲氧基肉桂酰)-甘草次酸酯(自制,质量分数≥95%)、甘草次酸(批号110408,质量分数≥98%)购自南京泽朗医药科技有限公司,3-甲氧基肉桂酸(批号10123347,质量分数≥98%)购自阿法埃莎(天津)化学有限公司,注射用顺铂(批号301001CF,规格10 mg/支,齐鲁制药有限公司)。
Thermo 3111型CO2培养箱、Multiskan GO酶标仪、Olympus倒置荧光显微镜、流式细胞仪、细胞计数器、25 cm2细胞培养瓶、96孔板(北京拜尔迪生物科技有限公司),其他耗材均为国产耗材。
2 方法 2.1 细胞培养冻存HepG2、HeLa、HT-29、HY926、MDCK、H9C2细胞复苏,培养在RPMI-1640或DMEM培养液(含10% FBS,1%双抗)中,放置于37 ℃、5% CO2培养箱中培养。细胞均贴壁状态生长,在倒置显微镜下观察生长状况,待细胞数量适量,生长状态良好(对数生长)时传代培养或铺板。
2.2 对细胞增殖的抑制试验(MTT试验)取对数生长期的细胞,0.25%胰酶消化,培养液制备细胞悬液至密度约3×104/mL,以每孔3 000个细胞(100 μL)接种于96孔板中,37 ℃、5% CO2条件下培养24 h,空白对照组每孔加入100 μL培养液,给药组加入3-O-(3-甲氧基肉桂酰)-甘草次酸酯,对照组加入甘草次酸、3-甲氧基肉桂酸,每孔均加入100 μL不同浓度的化合物溶液,使终浓度分别为100、50、25、12.5、6.25、3.125 μmol/L,阳性对照组每孔加入100 μL不同浓度的顺铂稀释液,使终浓度分别为20、10、5、2.5、1.25、0.625 μmol/L,每一个浓度设3个平行孔。37 ℃、5% CO2条件下继续培养72 h后,每孔加MTT 20 μL,置于37 ℃、5% CO2条件下继续培养4 h,弃去孔内液体,每孔加入二甲基亚砜150 μL,用酶标仪于490 nm下测吸光度(A)值。实验重复3次,计算对细胞生长的抑制率。采用Graphpad Prism 5.0软件计算半数有效抑制浓度(IC50)值。
2.3 细胞染色试验 2.3.1 Giemsa染色试验取对数生长期的HepG2细胞,以5×104/孔(1 mL)接种于12孔培养板中,在含5% CO2的湿化培养箱中37 ℃培养24 h,空白对照组加入1 mL培养液,给药组每孔分别加入1 mL不同浓度3-O-(3-甲氧基肉桂酰)-甘草次酸酯,使最终浓度分别为5、10、20 μmol/L,每个浓度重复3孔。培养箱中继续培养72 h后,弃去细胞培养液,用PBS清洗2次,用PBS-乙醇(1:1)浸润2 min,弃去,用乙醇固定10 min,弃去,Giemsa染料染色2 min,清水洗去染料,在倒置显微镜200倍下观察细胞形态。
2.3.2 H33342染色试验取对数生长期的HepG2细胞,以5×104/孔(1 mL)接种于12孔培养板中,在含5% CO2的湿化培养箱中37 ℃培养24 h,空白对照组加入1 mL的培养液,每孔分别加入1 mL不同浓度3-O-(3-甲氧基肉桂酰)-甘草次酸酯,使最终浓度分别为5、10、20 μmol/L,每个浓度重复3孔。培养箱中继续培养72 h后,弃去细胞培养液,PBS清洗2次,PBS-乙醇(1:1)浸润2 min,弃去,乙醇固定10 min,弃去,H33342染料染色2 min,清水洗去染料,倒置显微镜200倍下观察细胞形态。
2.4 流式细胞术检测药物诱导HepG2细胞凋亡收集对数生长期的HepG2细胞,计数,以5×104个/孔(1 mL)的细胞数接种在12孔培养板中,在37 ℃、5% CO2的培养箱中培养24 h后弃去上层培养液,分别加入5、10、20 μmol/L 3-O-(3-甲氧基肉桂酰)-甘草次酸酯的细胞培养液各2 mL,每个浓度重复3个复孔,空白对照组加入相同体积的空白细胞培养液。继续培养72 h后,分别用适量的0.25%胰蛋白酶溶液(不含EDTA)消化,收集细胞,1 000 r/min、4 ℃离心10 min后,弃上清,用PBS清洗2遍后,将细胞重悬于200 μL Binding Buffer液中,分别加入10 μL AnnexinV-FITC液,轻轻混匀,避光反应15 min后,加入5 μL PI液,用流式细胞仪分析,收集10 000个细胞荧光信号
2.5 统计方法实验数据采用SPSS 16.0软件进行统计学分析,各组实验数据以x±s表示,多组间差异采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法进行。
3 结果 3.1 肿瘤细胞增殖抑制作用和细胞毒性3-O-(3-甲氧基肉桂酰)-甘草次酸酯具有较好的抑制HepG2细胞增殖活性,其IC50为8.28 μmol/L,明显强于甘草次酸的活性(IC50>50 μmol/L),见表 1。
| 表 1 3-O-(3-甲氧基肉桂酰)-甘草次酸酯对6种细胞模型的抑制效果 Table 1 Inhibition of 3-O-(3-methoxy cinnamoyl)-glycyrrhetinic acid ester on six types of cell models |
显微镜下观察发现化合物3-O-(3-甲氧基肉桂酰)-甘草次酸酯作用HepG2细胞后,癌细胞质中颗粒、空泡增多,部分细胞漂浮、死亡,细胞数明显减少;与顺铂对HepG2细胞的抑制效果(IC50=4.57 μmol/L)接近。为了能够获得更好的观察效果,在直接镜下观察基础上,针对药物干预前后细胞进行了Giemsa染色。
此外,通过对非肿瘤细胞MDCK、HY926、H9C2细胞的毒性测试表明,3-O-(3-甲氧基肉桂酰)-甘草次酸酯及其合成原料甘草次酸、3-甲氧基肉桂酸毒性较弱(IC50>24 μmol/L);但顺铂对3种非肿瘤细胞具有较强的细胞毒性,其IC50分别为9.97、5.12、5.31 μmol/L。
3.2 对HepG2细胞、3种正常细胞的毒性选择性3-O-(3-甲氧基肉桂酰)-甘草次酸酯浓度在12.5 μmol/L时,对MDCK、HY926、H9C2细胞抑制率分别为17.05%、16.08%、4.66%,与对HepG2细胞的抑制效果相比差异明显,其中对心肌细胞H9C2的选择指数[selectivity index,SI=IC50(H9C2)/IC50(HepG2)]大于12,具有高效、低毒、抗癌选择性的先导化合物的特点,见图 2。
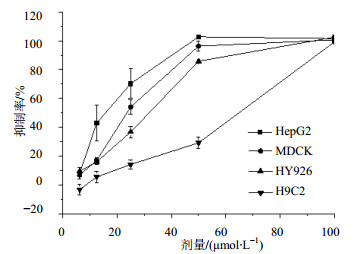
|
图 2 3-O-(3-甲氧基肉桂酰)-甘草次酸酯对HepG2细胞和3种正常细胞增殖的抑制作用 Fig. 2 Inhibition of 3-O-(3-methoxy cinnamoyl)-glycyrrhetinic acid ester on HepG2 and three normal cells |
3.3 细胞染色 3.3.1 Giemsa染色
3-O-(3-甲氧基肉桂酰)-甘草次酸酯诱导细胞形态的改变见图 3。不同浓度3-O-(3-甲氧基肉桂酰)-甘草次酸酯对HepG2细胞形态有明显差异,空白对照组细胞形态完整,胞间联系紧密。随着药物浓度的增加,细胞间的联系丧失、核着色变浅、核溶解、细胞碎片增多;药物浓度为10、20 μmol/L时,没有完整形态的细胞存在,量效关系非常明显。
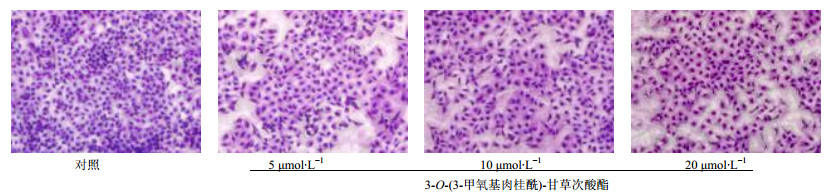
|
图 3 HepG2细胞形态(Giemsa法染色) Fig. 3 Morphological changes of HepG2 cells (Giemsa staining) |
3.3.2 H33342染色
3-O-(3-甲氧基肉桂酰)-甘草次酸酯诱导细胞形态的改变见图 4。不同浓度3-O-(3-甲氧基肉桂酰)-甘草次酸酯对HepG2细胞形态有明显差异,空白对照组细胞形态完整,胞间联系紧密。随着药物浓度的增加,核着色变浅、核溶解破碎、细胞碎片增多、细胞质固缩;药物浓度为10、20 μmol/L时,没有完整的细胞核存在。
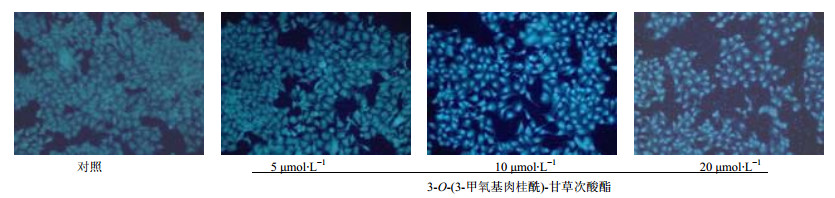
|
图 4 HepG2细胞形态(H33342法染色) Fig. 4 Morphological changes of HepG2 cells (Giemsa staining) |
3.4 流式细胞术检测3-O-(3-甲氧基肉桂酰)-甘草次酸酯诱导HepG2细胞凋亡
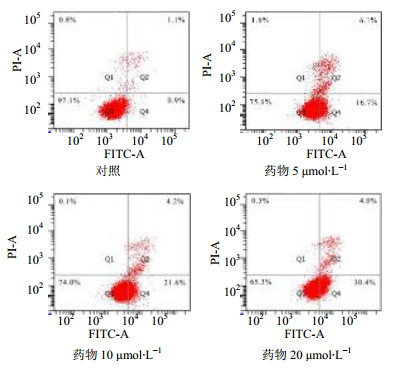
以FITC荧光为横坐标,PI荧光为纵坐标作双参数点图,细胞分为Q1、Q2、Q3、Q4 4个区域,分别代表机械损伤细胞区、晚期凋亡细胞区、正常细胞区、早期凋亡区,见图 5。
|
图 5 3-O-(3-甲氧基肉桂酰)-甘草次酸酯对HepG2细胞凋亡的影响 Fig. 5 Effects of 3-O-(3-methoxy cinnamoyl)-glycyrrhetinic acid ester on apoptosis of HepG2 cells |
根据流式细胞术测试结果可以发现,随着3-O-(3-甲氧基肉桂酰)-甘草次酸酯浓度的升高,早期凋亡率逐渐增加,而晚期凋亡率无明显变化,见表 2。结果提示3-O-(3-甲氧基肉桂酰)-甘草次酸酯可以有效地诱导细胞早期凋亡,并呈现一定的量效关系。
| 表 2 3-O-(3-甲氧基肉桂酰)-甘草次酸酯诱导HepG2细胞凋亡结果 Table 2 Apoptosis results of HepG2 induced by 3-O-(3-methoxy cinnamoyl)-glycyrrhetinic acid ester |
4 讨论
甘草是我国传统中药材,在2 000多种中草药中甘草的用量是最大的,中药配方中素有“十方九草,无草不成方”之说。国内外对甘草中所含的甘草酸、甘草次酸的药理活性进行了深入系统的研究。结果表明,甘草酸及其甘草次酸具有保肝解毒、抗肿瘤活性,并能促进癌细胞的凋亡[13-14]。近年来国内外相关研究证实细胞表面的确存在大量甘草次酸的特异性结合位点。本实验依据甘草次酸的肝靶向性活性特点,选择以甘草次酸及其衍生物作为作为靶向载体,设计合成靶向性抗癌药物[15-16]。
同时,苯丙烯酸类是在植物中广泛存在的酚酸类成分,也是很重要的简单苯丙素类化合物。苯丙烯酸类具有抗肿瘤、抗炎、抗血小板聚集的作用,近几年的国内外研究表明,它具有广泛的抗实体瘤活性,包括难治性前列腺癌、肺癌、胶质细胞瘤、肝癌等,对肿瘤细胞具有抑制其生长增殖、诱导其分化的作用,而且其衍生物抗肿瘤活性呈现一定选择性[7, 10, 17]。
单一中药有效成分并不具备中药的药效及协同起效的优势。本课题组在前期实验中设计拼合3-O-(3-甲氧基肉桂酰)-甘草次酸酯,本实验利用6种细胞筛选模型进行活性筛选,发现3-O-(3-甲氧基肉桂酰)-甘草次酸酯具有良好的抗肿瘤作用,对癌细胞模型HeLa、HepG2、HT-29细胞的抑制效果(IC50<15 μmol/L)明显强于拼合前体甘草次酸和3-甲氧基肉桂酸(IC50>50 μmol/L),其中对HepG2细胞抑制效果最好(IC50=8.28 μmol/L)。而当3-O-(3-甲氧基肉桂酰)-甘草次酸酯给药剂量小于20 μmol/L时,对3种非癌细胞MDCK、HY926、H9C2没有明显抑制效果,尤其对H9C2细胞的影响最弱(SI>12),远远低于阳性对照药顺铂对3种非癌细胞毒性(IC50<10 μmol/L);另外,通过Giemsa染色、H33342染色和流式细胞术等方法进一步验证了3-O-(3-甲氧基肉桂酰)-甘草次酸酯能够诱导HepG2细胞凋亡,且呈现一定的量效关系。
综上所述3-O-(3-甲氧基肉桂酰)-甘草次酸酯具有高效、低毒、选择性好的特点,具有深入研究和开发的价值。本实验选择性抗癌先导化合物的发现过程在一定程度上体现了中医药源头的创新思维,同时也证明了在中医经典方药中探寻具有良好生物活性的先导化合物是发现研究创新药物的有效途径,进一步说明了借鉴中药的配伍法则和药物设计的结构拼合原理设计合成药物具有重要意义。
| [1] |
Liang D, Zhou Q, Zhang J, et al.
A novel chenodeoxycholic acid-verticinone ester induces apoptosis and cell cycle arrest in HepG2 cells[J]. Steroids, 2012, 77(13) : 1381–1390.
DOI:10.1016/j.steroids.2012.08.013 ( 0) 0)
|
| [2] |
Zhang C, Yan W, Li B, et al.
A New ligustrazine derivative-selective cytotoxicity by suppression of NF-κB/p65 and COX-2 expression on human hepatoma cells. Part 3[J]. Int J Mol Sci, 2015, 16(7) : 16401–16413.
DOI:10.3390/ijms160716401 ( 0) 0)
|
| [3] |
Xu B, Chu F, Zhang Y, et al.
A series of new ligustrazine-triterpenes derivatives as anti-Tumor agents:design, synthesis, and biological evaluation[J]. Int J Mol Sci, 2015, 16(9) : 21035–21055.
DOI:10.3390/ijms160921035 ( 0) 0)
|
| [4] |
吴吉洋, 高方圆, 叶晓岚, 等.
创新药物川阿格雷及其拼合分子阿魏酸和川芎嗪的质谱裂解规律[J]. 第二军医大学学报, 2012, 33(7) : 755–758.
( 0) 0)
|
| [5] |
孟艳秋, 刘立伟, 刘冬莹, 等.
甘草次酸C3、C30衍生物的合成及其体外抗肿瘤活性研究[J]. 现代药物与临床, 2015, 30(6) : 610–615.
( 0) 0)
|
| [6] |
康蕾, 李学强, 王凤荣.
18β-甘草次酸结构修饰及生物活性研究进展[J]. 中草药, 2012, 43(7) : 1430–1442.
( 0) 0)
|
| [7] |
Su P, Shi Y, Wang J, et al.
Anticancer agents derived from natural cinnamic acids[J]. Anticancer Agents Med Chem, 2015, 15(8) : 980–987.
DOI:10.2174/1871520615666150130111120 ( 0) 0)
|
| [8] |
Csuk R.
Recent developments in the synthesis of antitumor-active glycyrrhetinic acid derivatives[J]. Mini Re Org Chem, 2014, 11(3) : 253–261.
DOI:10.2174/1570193X1103140915105049 ( 0) 0)
|
| [9] |
Sharma R, Guru S K, Jain S K, et al.
3-(2, 6-Dichloro-benzyloxy)-11-oxo-olean-12-ene-29-oic acid, a semisynthetic derivative of glycyrrhetic acid:synthesis, antiproliferative, apoptotic and anti-angiogenesis activity[J]. Med Chem Comm, 2014, 6(4) : 564–575.
( 0) 0)
|
| [10] |
De P, Baltas M, Bedos-Belval F.
Cinnamic acid derivatives as anticancer agents-a review[J]. Curr Med Chem, 2011, 18(11) : 1672–1703.
DOI:10.2174/092986711795471347 ( 0) 0)
|
| [11] |
Zhang W M, Xing M, Zhao T T, et al.
Synthesis, molecular modeling and biological evaluation of cinnamic acid derivatives with pyrazole moieties as novel anticancer agents[J]. RSC Advances, 2014, 4(70) : 37197–37207.
DOI:10.1039/C4RA05257A ( 0) 0)
|
| [12] |
Xu C C, Deng T, Fan M L, et al.
Synthesis and in vitro antitumor evaluation of dihydroartemisinin-cinnamic acid ester derivatives[J]. Eur J Med Chem, 2016, 107 : 192–203.
DOI:10.1016/j.ejmech.2015.11.003 ( 0) 0)
|
| [13] |
黄敏, 李坤, 靳书语, 等.
18β-甘草次酸类衍生物的设计, 合成及抑制肿瘤细胞增殖活性[J]. 药学学报, 2015, 50(10) : 1263–1271.
( 0) 0)
|
| [14] |
高振北, 胡君, 康潇, 等.
18β-甘草次酸A环官能团化衍生物的合成及抗肿瘤活性[J]. 高等学校化学学报, 2012, 33(4) : 750–754.
( 0) 0)
|
| [15] |
米雪, 赵岩, 杨慧.
甘草次酸及其衍生物在肝靶向药物中的应用[J]. 天津药学, 2014, 26(1) : 41–45.
( 0) 0)
|
| [16] |
周金幸, 臧新龙, 李季, 等.
甘草次酸介导pH敏感主动靶向长循环阿霉素脂质体的制备及其药物动力学[J]. 沈阳药科大学学报, 2015, 32(8) : 587–592.
( 0) 0)
|
| [17] |
陈丽君, 李远, 李磊.
肉桂酸衍生物抗乳腺癌作用分子机制研究进展[J]. 医学综述, 2014, 20(24) : 4461–4463.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31



