2. 中国医学科学院 北京协和医学院 药用植物研究所 中草药物质基础与资源利用教育部实验室, 北京 100193;
3. 黑龙江中医药大学 药学院, 黑龙江 哈尔滨 150040
2. Peking Union Medical College, The Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Institute of Medicinal Plant Development, Beijing 00193, China;
3. College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
雷公藤红素是从雷公藤Tripterygium wilfordii Hook. f.中提取的三萜类化合物,具有抗炎、抗菌作用[1-2],近年来发现其具有抗肿瘤活性,受到国内外的广泛关注[3-4]。但雷公藤红素水溶性差,在胃肠道的溶出慢,口服时吸收差[5],生物利用度低[6]。纳米混悬制剂具有改善难溶性药物的溶解性、能提高口服生物利用度、静脉注射时可因增强渗透滞留(EPR)效应增加药物在肿瘤组织中的分布、给药途径多样等优点[7],同时具有能控制释放和良好的生物相容性特点[8]。因此本实验拟将雷公藤红素制备成为纳米混悬剂,并对其处方工艺、物理特性和体内药效学进行研究,为雷公藤红素的现代制剂研究进行探索。
1 仪器与材料KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司)、RE-52CS旋转蒸发器(上海振捷实验设备有限公司)、LGL-10B冷冻干燥机(北京四环科学仪器厂有限公司)、Zetasizer Nano ZS型粒度仪(英国Malvern Instruments公司)、Meppler Toledo AL204分析天平(梅特勒-托利多仪器有限公司)、U3000高效液相色谱仪(戴安有限公司)、瑞士Tecan M1000多功能连续波长酶标仪、JEM-1400透射电子显微镜(日本电子株式会社)。
雷公藤红素对照品(成都健藤生物有限公司,质量分数>98%,批号141203),乙腈和甲醇为色谱纯,水为去离子水、其余试剂均为分析纯。
H22、HepG2细胞均购自中国医学科学院基础医学研究所细胞资源中心,雄性ICR小鼠购自北京维通利华实验动物技术有限公司,RPMI 1640培养基(批号AAJ207653)、MEM培养基(批号AAK206524)、磷酸缓冲液(PBS,批号AAL208993)、胎牛血清(批号SSH30396)均购自美国Hyclone公司,青链霉素(北京索莱宝科技有限公司,规格100 U/mL,批号20160312)
2 方法与结果 2.1 雷公藤红素纳米混悬剂的制备 2.1.1 不同稳定剂的选择通过单因素试验考察不同稳定剂制备的雷公藤红素纳米混悬剂的粒径变化,拟筛选出粒径最小的处方。以大豆卵磷脂(SPC)、聚乙二醇1000维生素E琥珀酸酯(TPGs)、苄泽78、聚山梨酯80、mPEG 2000-DSPE、聚乙二醇-聚己内酯(mPEG2000-PCL2000)为稳定剂在超声的条件下制备雷公藤红素纳米混悬剂,见表 1。结果发现以mPEG 2000-PCL 2000为稳定剂制备的雷公藤红素纳米混悬剂粒径最小,粒度分布也较窄。
| 表 1 处方中不同稳定剂的筛选 Table 1 Screening of different stabilizers in prescription |
2.1.2 不同药载比的选择
随后,增加药物与载体比例,结果显示药载比1∶1时,粒径最小,见表 2。
| 表 2 处方中不同药载比对粒径的影响 Table 2 Effect of different drug loading ratio on particle size in prescription |
综合粒径、粒度分布和表面电位等因素,鉴于粒径对于药物组织分布影响更大,故选择mPEG 2000-PCL 2000为稳定剂、药载比1∶1为处方。
2.1.3 超声温度对粒径的影响采用上述处方进行单因素试验考察超声温度对粒径的影响,发现25 ℃超声注入制备的纳米粒粒径最小,见表 3。同时进一步的高压均质5次后平均粒径从67.1 nm增加到82.3 nm,高压均质非但没有能将粒径减小,反而有所增大,因为粒径达到了预期的要求,就只进行了这些单因素考察,没进一步优化工艺。
| 表 3 制备工艺中超声温度对粒径的影响 Table 3 Effect of ultrasonic temperature on particle size in preparation process |
2.1.4 最佳处方和制备工艺条件
根据上述处方工艺筛选过程,在25 ℃下采用超声注入法,以mPEG 2000- PCL 2000为稳定剂制备雷公藤红素纳米混悬剂,因此最终选用如下处方:将5 mg雷公藤红素与5 mg mPEG 2000-PCL 2000共溶于0.3 mL甲醇中,25 ℃超声下缓慢滴注到5 mL去离子水中,旋转蒸发法除去有机溶剂,定容至5 mL,即得雷公藤红素纳米混悬剂,质量浓度为1 mg/mL。
2.1.5 雷公藤红素注射液的制备[9]将雷公藤红素3 mg先溶于0.5 mL DMSO,再与0.5 mL聚山梨酯80混合,后以9 mL生理盐水逐步稀释到10 mL,必要时超声辅助溶解,使成澄清透明的溶液。
2.2 雷公藤红素纳米混悬剂的性质考察 2.2.1 粒径、电位、多分散性指数考察将制备好的雷公藤红素纳米混悬剂用粒度仪测定粒径、电位、多分散性指数。雷公藤红素纳米混悬剂粒径为(67.1±3.0)nm,Zeta电位为(-10.4±1.45)mV,多分散性指数为0.232±0.08,粒径见图 1。与王敏等[10]制备的脂质纳米粒比较,雷公藤红素纳米混悬剂制备方法简单,不需要较高的温度。
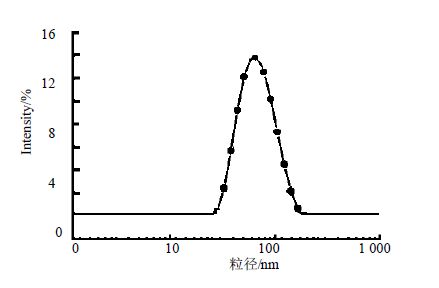
|
图 1 雷公藤红素纳米混悬剂的粒径分布 Fig. 1 Particle size distribution of Celastrol Nanoparticles |
2.2.2 透射电镜照片考察
将雷公藤红素纳米混悬剂稀释到雷公藤红素理论质量浓度为100 μg/mL,取6.0 μL滴到300目铜网上,静置5 min,用滤纸吸干,室温放置10 min后,滴加6.0 μL醋酸铀于铜网上染色5 min,用滤纸吸干,室温放置过夜,透射电镜下加速电压为120 kV观察纳米粒子的形态、大小和分布情况。雷公藤红素纳米混悬剂的透射电镜照片见图 2。可以看出雷公藤红素纳米混悬剂近乎为球形,分布比较均匀。在200 nm的标尺下,目测粒径50 nm左右,比动态光散射法测得的结果稍小。这主要是动态光散射测的是纳米颗粒在分散介质中的等效半径,是在湿态和具有水化层时的粒径,而透射电镜测的是干颗粒的粒径,故透射电镜观察到的粒径往往小于动态光散射法测得的粒径。

|
图 2 雷公藤红素纳米混悬剂的透射电镜照片 Fig. 2 Transmission electron microscope photo of Celastrol Nanoparticles |
2.3 在不同介质中的稳定性以及溶血性考察 2.3.1 雷公藤红素纳米混悬剂在不同介质中的稳定性
将雷公藤红素纳米混悬剂分别与1.8%生理盐水、10%葡萄糖、2×PBS(pH 7.4)等体积混合,与大鼠血浆按照1∶4的体积比混合,37 ℃孵育,分别在0、2、4、6 h测量粒径,见图 3。可见雷公藤红素纳米混悬剂在PBS、0.9% NaCl、5%葡萄糖和血浆孵育6 h后粒径变化均较小,没有出现任何浑浊或沉淀现象,说明雷公藤红素纳米混悬剂在这些生理介质中稳定性好,雷公藤红素纳米混悬剂可以调成PBS、生理盐水、5%葡萄糖等渗溶液,用于注射给药。
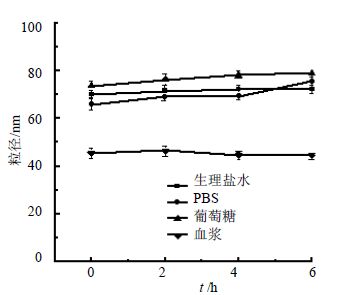
|
图 3 粒径随时间变化曲线 Fig. 3 Curves of particle size over time |
2.3.2 雷公藤红素纳米混悬剂溶血性考察
将1.00、0.40、0.20、0.10、0.02 mg/mL雷公藤红素纳米混悬剂等渗样品与生理盐水调配的4%红细胞悬浮液等体积比混合作为实验组,对照组为上述不同浓度的等渗样品与生理盐水混合。阴性组为4%红细胞悬浮液与等体积生理盐水混合,阳性组为4%红细胞悬浮液与等体积去离子水混合,37 ℃水浴下孵育4 h后,5 000 r/min离心3 min,取上清液,用酶标仪在540 nm处测定吸光度(A)值,见表 4。
| 表 4 不同浓度下雷公藤红素纳米混悬剂的溶血率 Table 4 Hemolysis rate of Celastrol Nanoparticles at different concentrations |
溶血率=(A实验-A对照-A阴性)/(A阳性-A阴性)
不同浓度的雷公藤红素纳米混悬剂等渗样品与生理盐水调配的4%红细胞悬浮液等体积比混合时,0.2 mg/mL及以下浓度时不溶血,为下步拟采取尾iv给药方式的动物实验给药剂量提供方向。检索文献并未发现有关雷公藤红素的溶血性考察,猜测雷公藤红素纳米粒高浓度下可能使红细胞膜某些结构发生改变,致使其发生溶血现象。
2.4 雷公藤红素纳米混悬剂冻干保护剂筛选取1 mL雷公藤红素纳米混悬剂样品于西林瓶中,冻干,冻干后用1 mL去离子水复溶,观察复溶情况。另各取1 mL雷公藤红素纳米混悬剂于西林瓶中,分别加入质量比为0.5%的蔗糖、葡萄糖、乳糖、半乳糖、海藻糖、麦芽糖、甘露醇、牛血清白蛋白(BSA)的冻干保护剂冻干,冷冻干燥,加入1 mL去离子水尝试复溶,必要时辅以震荡、超声,观察溶解情况,测定冻干复溶前后的粒径变化。
1mL雷公藤红素纳米混悬剂样品冻干后加入1 mL去离子水后,样品即便在超声作用下也无法复溶。雷公藤红素纳米混悬剂中分别加入0.5%的蔗糖、葡萄糖、乳糖、半乳糖、海藻糖、麦芽糖、甘露醇、BSA后冻干,再加原体积的去离子水后,只有以BSA为稳定剂的样品能够在振荡后复溶,但平均粒径增加到128.1 nm左右。而添加其他冻干保护剂的雷公藤红素纳米混悬剂均不能复溶,见表 5。
| 表 5 雷公藤红素纳米混悬剂不同冻干保护剂筛选 Table 5 Various freeze-drying protective screening of Celastrol Nanoparticles |
尽管存在冻干保护剂用量不够的可能性,但表 5结果显示BSA为雷公藤红素纳米混悬剂的良好冻干保护剂。由于纳米混悬剂本身是一种热力学不稳定体系,长期放置会出现粒径变大、聚集甚至沉淀等现象,而冷冻干燥后能将纳米混悬剂的结构以固态的形式“冻结固化”,临用前加合适的水性介质分散,分散后又立即恢复原来的状态,重新成为纳米混悬剂,同时便于运输和较长时间储存的优点。
2.5 载药量测定和体外释放考察 2.5.1 色谱条件[11-12]Reprosil-pur 120 C18-AQ色谱柱(250 mm×4.6 mm,5 μm),流动相为5 mmol/L磷酸-乙腈(15∶85),检测波长为425 nm,体积流量为1 mL/min,柱温为25 ℃,进样量为20 μL。
2.5.2 线性关系考察精密称取雷公藤红素对照品5 mg,置5 mL量瓶中,甲醇溶解并加至刻度,作为储备液。取储备液适量,用甲醇稀释,分别配制质量浓度分别为0.1、0.5、1.25、2.5、5、10、20、50、100 μg/mL雷公藤红素对照品溶液。按照上述色谱条件,进样测定,分别记录峰面积。以质量浓度为横坐标,峰面积为纵坐标,进行线性回归,得回归方程Y=0.505 3 X-0.075 8(r=0.999 9),表明雷公藤红素在0.1~100 μg/mL与峰面积线性关系良好。
2.5.3 载药量的测定取5 mL雷公藤红素纳米混悬剂放入西林瓶中,用LGL-10B冷冻干燥机冻干,空瓶质量为W1,冻干后瓶与样品质量为W2。取冻干后的粉末加入5 mL甲醇溶解,13 000 r/min离心10 min,进样测定,计算质量W,平行3份,计算载药量。
载药量=W/(W2-W1)
HPLC实测雷公藤红素纳米混悬剂平均载药量为46.7%,与理论载药量50%相比略低,可能是在转移过程中有少量损失,但显著高于文献报道的纳米结构脂质载体[13]。
2.5.4 体外释放考察取药物质量浓度为1 mg/mL的雷公藤红素纳米混悬剂,置于截留相对分子质量为8 000~14 000的透析袋中,两端扎紧放置于含50 mL 0.5%聚山梨酯的PBS释放介质中,于37 ℃进行释放研究,每个样品平行3份。分别在15、30 min,1、2、4、8、12、24 h取1 mL释放外液,同时补充1 mL释放介质,48、72、96、120、144 h更换释放外液,13 000 r/min离心20 min,HPLC法测定药物质量浓度,计算累积释放度,结果见图 4。可见雷公藤红素纳米混悬剂在前100 h近乎为零级释放,整体无突释,在144 h的累积释放率达到74.04%,具有良好的缓释效果。

|
图 4 雷公藤红素纳米混悬剂的体外释放 Fig. 4 In vitro release of Celastrol Nanoparticles |
2.6 雷公藤红素纳米混悬剂体外细胞毒实验
体外培养HepG2细胞至对数期,按8.0×103/孔的细胞密度接种于96孔板中,37 ℃、5% CO2培养箱中培养24 h后,用不含胎牛血清的MEM培养基将雷公藤红素纳米混悬剂、雷公藤红素的DMSO溶液(20 mg/mL)稀释成20、10、5、2、1、0.5、0.1、0.01 μg/mL,空白对照只加不含胎牛血清的MEM培养基,每个质量浓度平行给药6组,孵育48 h。随后每孔加入MTT的PBS溶液(5 mg/mL)20 μL,在37 ℃、5% CO2培养箱中孵育4 h,吸出各孔液体,每孔加入DMSO溶液200 μL,用微孔振荡器震荡15 min,酶标仪570 nm处测其吸光度(A)值,用GraphPad Prism 5软件测其IC50值,SPSS软件计算是否有显著性差异。
抑制率=(A空白-A实验)/A空白
雷公藤红素纳米混悬剂和溶液对人肝癌细胞HepG2的生长抑制情况见表 6。
| 表 6 雷公藤红素纳米混悬剂和溶液对HepG2细胞的抑制率(x ± s,n = 3) Table 6 Inhibition against HepG2 cells of celastrol nanoparticle suspension and solution (x ± s,n = 3 ) |
可见两者对HepG2的生长抑制都呈现出剂量相关性。雷公藤红素纳米混悬剂对HepG2细胞的IC50较溶液低约1倍(1.179 μg/mL vs 2.377 μg/mL,P<0.05),说明将雷公藤红素制备成纳米混悬剂之后能显著提高药物的体外抗肿瘤效果。有文献报道,癌细胞和纳米粒之间存在非特异性相互作用,较容易通过吞噬作用或内吞作用对纳米粒进行摄取[14],雷公藤红素纳米混悬剂也可能是基于同样的原因增加了被HepG2的摄入,从而提高了对癌细胞的抑制作用。
2.7 药效学研究复苏冻存的H22细胞,用1640培养基养至对数期后,用无菌PBS调整H22细胞悬液至浓度为1×107/mL备用。将10只6周龄的ICR雄性小鼠ip 0.2 mL的上述细胞悬液,待1周后腹水长好,取出,用无菌PBS调整细胞悬液至浓度为1×107/mL,给每只ICR小鼠右侧腋下sc 0.2 mL的H22细胞(1×106/mL)的PBS悬液,隔天观察肿瘤生长情况,至肿瘤体积大于100 mm3,筛选肿瘤大小相对一致的30只小鼠进行实验,每组10只,对照组尾iv生理盐水溶液,阳性对照组选择雷公藤红素注射剂2.0 mg/kg尾iv给药,实验组为雷公藤红素纳米混悬剂2.0 mg/kg尾iv给药,正常饮食,每2天给药一次,测量瘤体积和体质量的变化。第8天给药结束24 h后,脱椎处死小鼠,解剖完整肿瘤组织,称定质量,计算抑瘤率。
雷公藤红素纳米混悬剂的抑瘤率达到70.36%,雷公藤红素注射剂的抑瘤率为51.1%,根据SPSS 8.0软件计算两组抑瘤率差异有显著性(P<0.05)。由于雷公藤红素对新生血管的抑制作用[15],而肿瘤组织新生血管较多[16],因此对肿瘤组织有明显抑制作用。但雷公藤红素纳米混悬剂的肿瘤抑制率相对较高,可能是因为EPR效应增加了药物在肿瘤组织中的分布。实验过程中的体质量变化是衡量药物毒副作用的指标,抗肿瘤药效学研究过程中,小鼠体重变化曲线见图 5,肿瘤体积变化曲线见图 6。可见雷公藤红素纳米混悬剂组和注射剂组的体质量均较生理盐水组轻,说明雷公藤红素具有一定的毒副作用[17];但雷公藤红素纳米混悬剂组和注射剂组之间的体质量差异无显著性,且体质量均呈上升趋势,说明在给药剂量下没有明显的毒副作用,2.0 mg/kg的给药剂量是接受的。
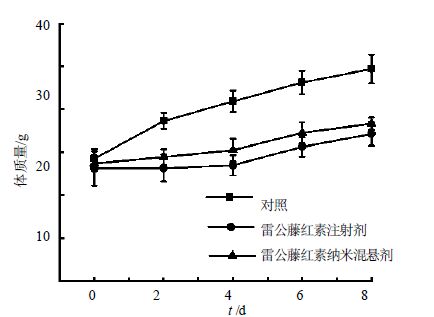
|
图 5 H22荷瘤小鼠给药后体质量随时间变化曲线(x±s,n = 10) Fig. 5 Change curveof body weight of H22 hepatoma- bearing mice along with time (x ± s,n = 10 ) |
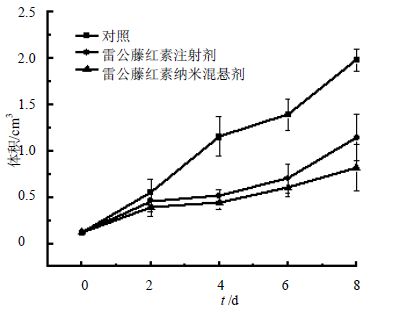
|
图 6 H22荷瘤小鼠给药后肿瘤体积随时间变化曲线(x ± s,n = 10) Fig. 6 Change curveof tumor volume of H22 hepatoma- bearing mice along with time (x ± s,n = 10 ) |
3 讨论
由于雷公藤红素溶解性较差,口服时生物利用好度较低,本实验针对这一缺点制备了雷公藤红素纳米混悬剂,解决了因难溶而带来的难于给药的问题。在以往的研究中,几乎没有将雷公藤红素制备成纳米混悬剂的先例,但有研究将雷公藤红素制备成为脂质体和脂质体纳米粒,但制备温度较高(70 ℃左右),同时载药量非常低(大约6.3%,而本实验的载药量为46.7%)[12, 18]。在以往的动物体内研究中发现雷公藤红素对白血病、前列腺癌、乳腺癌均有较明显的抑制作用[19-21],本研究显示雷公藤红素对肝癌细胞也有抑制作用,且雷公藤红素纳米混悬剂较游离药物表现出更强的肿瘤抑制作用。体外细胞毒试验中,雷公藤红素纳米混悬剂显著提高了药物对HepG2肿瘤细胞的生长抑制作用,推测可能是纳米混悬剂与肿瘤细胞之间存在非特异性相互作用,从而较容易通过吞噬作用或内吞作用为肿瘤细胞摄取。H22荷瘤小鼠模型中,雷公藤红素纳米混悬剂的肿瘤抑制率也显著高于游离药物,除雷公藤红素纳米混悬剂具有更强的肿瘤细胞毒性之外,制备的雷公藤红素纳米混悬剂粒径较小,由于EPR效应而提高了药物在肿瘤细胞中的被动靶向性,可能是更重要的原因。制备的雷公藤红素纳米混悬剂还可继续进行主动靶向修饰,从而进一步提高其肿瘤靶向性,这为雷公藤红素的增效减毒提高在抗肿瘤治疗中的可行性提供了可能,为雷公藤红素新型给药系统的进一步研发提供参考。
| [1] |
任献青, 鲁静, 孟祥乐, 等.
雷公藤红素药理作用最新研究进展[J]. 中华中医药杂志 , 2013, 28 (9) : 2679–2682.
( 0) 0)
|
| [2] |
He M F, Liu L, Ge W, et al.
Antiangiogenic activity of Tripterygium wilfordii and its terpenoids[J]. J Ethnopharmacol , 2009, 121 (1) : 61–68.
DOI:10.1016/j.jep.2008.09.033 ( 0) 0)
|
| [3] |
Boridy S, Le P U, Petrecca K, et al.
Celastrol targets proteostasis and acts synergistically with a heat-shock protein 90 inhibitor to kill human glioblastoma cells[J]. Cell Death Dis , 2014 (5) : 1216.
( 0) 0)
|
| [4] |
Salminen A, Lehtonen M, Paimela T, et al.
Celastrol molecular targets of Thunder God Vine[J]. Biochem Biophys Res Commun , 2010, 394 (3) : 439–442.
DOI:10.1016/j.bbrc.2010.03.050 ( 0) 0)
|
| [5] |
贺艳丽, 张迎庆.
难溶性药物纳米混悬剂的制备方法[J]. 中国药房 , 2016, 27 (4) : 556–559.
( 0) 0)
|
| [6] |
蒲晓辉, 张晓, 孙进, 等.
纳米混悬剂的应用及体内外行为研究进展[J]. 东南大学学报:医学版 , 2011, 30 (4) : 630–635.
( 0) 0)
|
| [7] |
Jethara S I, Patel A D, Patel M R, et al.
Recent survey on nanosuspension:a patent overview[J]. Recent Pat Drug Deliv Formul , 2015, 9 (1) : 65–78.
DOI:10.2174/1872211308666141028214003 ( 0) 0)
|
| [8] |
刘凯, 孙进, 何仲贵.
新型纳米结构脂质载体系统的研究进展[J]. 沈阳药科大学学报 , 2008, 25 (3) : 236–242.
( 0) 0)
|
| [9] |
李艳红, 张健, 李之韬, 等.
高载药量蓝萼甲素纳米混悬剂的制备及体内外研究[J]. 中国药学杂志 , 2015, 50 (7) : 606–612.
( 0) 0)
|
| [10] |
王敏, 谢鹏.
雷公藤红素固体脂质纳米粒的制备及理化性质[J]. 中国医院药学杂志 , 2014, 34 (1) : 46–49.
( 0) 0)
|
| [11] |
陈小云, 张振海, 胡绍英, 等.
基于硬脂酸改性纳米碳酸钙的雷公藤红素缓释固体分散体的研究[J]. 中国药学杂志 , 2013, 48 (16) : 1380–1384.
( 0) 0)
|
| [12] |
袁菱, 周蕾, 陈彦, 等.
雷公藤红素纳米结构脂质载体的制备及其体外透皮研究[J]. 中草药 , 2012, 43 (8) : 1514–1518.
( 0) 0)
|
| [13] |
袁菱, 周蕾, 陈彦, 等.
雷公藤红素纳米结构脂质载体的制备及其理化性质考察[J]. 中成药 , 2013, 35 (9) : 2023–2027.
( 0) 0)
|
| [14] |
Cho H, Indig G L, Weichert J, et al.
In vivo cancer imagingbypoly (ethylene glycol)-b-poly (ε-caprolactone) micellscontaininga near-infrared probe[J]. Nanomedicine , 2012, 8 (2) : 228–236.
( 0) 0)
|
| [15] |
郭艳红, 谭垦.
雷公藤的毒性及其研究概况[J]. 中药材 , 2007, 30 (1) : 112–117.
( 0) 0)
|
| [16] |
黄煜伦, 周幽心, 周岱, 等.
雷公藤红素抑制血管生成的实验研究[J]. 中华肿瘤杂志 , 2003, 25 (5) : 429–432.
( 0) 0)
|
| [17] |
姜华.雷公藤红素抑制荷SHG-44胶质瘤裸鼠移植瘤的实验研究[D].苏州:苏州大学,2005.
( 0) 0)
|
| [18] |
黄煜伦.雷公藤红素纳米脂质体的制备及抗胶质瘤的实验研究[D].苏州:苏州大学,2009.
( 0) 0)
|
| [19] |
Lu Z, Jin Y, Qiu L, et al.
Celastrol,a novel HSP90 inhibitor,depletes Bcr-Abl and induces apoptosis in imatinib-resistant chronic myelog-enous leukemia cells harboring T315I mutation[J]. Cancer Lett , 2010, 290 (2) : 182–191.
DOI:10.1016/j.canlet.2009.09.006 ( 0) 0)
|
| [20] |
Jang S Y, Jang S W, Ko J.
Celastrol inhibits the growth of estrogen posi-tive human breast cancer cells through modulation of estrogen receptor alpha[J]. Cancer Lett , 2011, 300 (1) : 57–65.
DOI:10.1016/j.canlet.2010.09.006 ( 0) 0)
|
| [21] |
Sanna V, Chamcheu J C, Pala N, et al.
Nanoencapsulation of natural triterpenoid celastrol for prostate cancer treatment[J]. Int J Nanomedicine , 2015, 10 : 6835–6846.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


