西格列汀化学名为(3R)-3-氨基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基) -1-丁酮,是默克公司研发的一种新型降糖药二肽基肽酶-4(DPP-4)抑制剂,2006年10月17日获得美国食品药品管理局批准上市。西格列汀是非胰岛素治疗药物,主要涉及2型糖尿病病理过程中的信号传导过程,通过抑制在体内降解外源性肠促胰岛素(GLP-1)的DPP-IV,抑制胰高血糖素的分泌和胰岛β细胞增殖,提高葡萄糖耐受水平,与易增加体质量、引起水肿的传统口服降糖药比较,该药的疗效明显[1-2]。
文献报道[3-10]的西格列汀合成路线主要有3种:第一种路线为Kim等发表了西他列汀的第一代合成路线,由手性原料(2S)-(+)-2,5-二氢-3,6-二甲氧基-2-异丙基吡嗪为起始原料,经烷基化、氨基保护、酯基水解、重氮化、Arndt-Eistert反应、缩合、脱保护获得西格列汀,该路线所用试剂昂贵,反应条件比较苛刻,用到-78、-30 ℃等低温条件,部分中间产物需要经过柱色谱分离,不适宜当前工业化生产条件[4]。第2、3种路线为分别用手性磷根钉催化剂对p-酮酸酷和[(COD)RhCI]2、R,S-t-BuJosiphos进行不对称氢化烯胺(氢化转化率82%~89%,ee值89%~95%),该路线需昂贵的催化剂,且反应条件苛刻[810]。
在第3种路线的基础上,改用价格低廉的拆分试剂代替昂贵的手性催化剂制得高纯度的西格列汀,大幅降低了生产成本[9-10]。2,4,5-三氟苯乙酸与丙二酸亚异丙酯反应得5-[1-羟基-2-(2,4,5-三氟苯基)亚乙基]-2,2-二甲基-1,3-二氧六环-4,6-二酮(1);再缩合制得4-氧代-4-[3-(三氟甲基)-5,6-二氢[1, 2, 4]三唑并[4,3-a]哌嗪-7(8H)-基]-1-(2,4,5-三氟苯基)丁烷-2-酮(2);2在甲醇中氨化制得3;3经NaBH4还原制得西他列汀外消旋体;改进后的合成工艺稳定性好,操作简便,生产成本降低,光学纯度较高(ee值在98%以上),总收率约28%。合成路线见图 1。
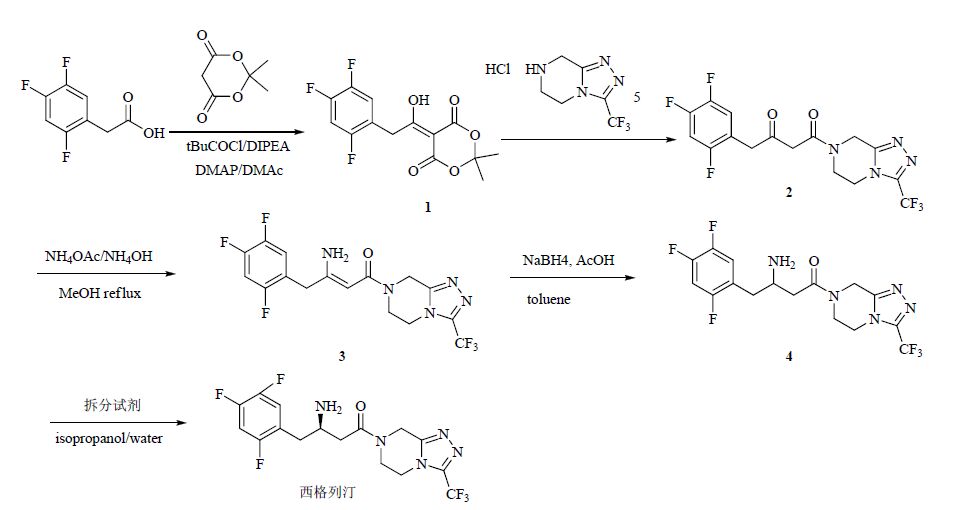
|
图 1 西格列汀的合成路线 Fig. 1 Synthetic route of sitagliptin |
1 仪器与试剂 1.1 仪器
Bruker TENSOR 27型傅里叶变换红外光谱仪(KBr压片)、Bruker Avance 400型核磁共振仪(德国Bruker公司);Finigan LCQ-MS液质联用仪(美国赛默飞);LC20A高效液相色谱仪(Shimadzu公司)。
1.2 试剂2,4,5-三氟苯乙酸,质量分数≥98%,江苏明化合晟生物科技有限公司;丙二酸亚异丙酯,质量分数≥95%,常州莱茵达医药原料有限公司;L-扁桃酸,ee≥99.5%,常州安轩化工有限公司;(-)-二对甲苯酰-L-酒石酸,ee≥99%,北京韵邦生物科技有限公司;所用溶剂均来自于国药集团化学试剂有限公司提供,使用前未经进一步提纯。
2 方法与结果 2.1 4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1, 2, 4]三唑并[4,3-A]吡嗪-7-(8H)-基]-1-(2,4,5-三氟苯基)-2-丁酮(2)的合成向500 mL三口烧瓶中加入200 mL四氢呋喃溶液,依次加入2,4,5-三氟苯乙酸(80 g,0.42 mol),丙二酸亚异丙酯(60.8 g,0.42 mol)、DMAP(4.2 g,0.34 mol)、N,N-二异丙基乙胺(0.11 g,0.86 mol),常温下搅拌l0 min,降温至0 ℃,滴加特戊酰氯(53.2 g,0.44 mol),升温至35 ℃,搅拌反应4 h,室温下加入化合物5(101 g,0.44 mol),升温至70℃搅拌5 h,加入NaOH溶液,析出固体,滤过,湿品真空干燥得到化合物2(143 g),收率85.2%,mp 273.5~275.1℃(文献报道[3]收率90%,mp 271.2 ℃)。
1H-NMR(400 MHz,CD3CN)δ:7.22~7.08 (overlapping m,2H,both),4.92(s,2H,major),4.81(s,2H,minor),4.18(t,J=5.5 Hz,2H,major),4.13(t,J=5.6 Hz,2H,minor),4.01(t,J=5.6 Hz,2H,minor),3.95(s,2H,major),3.92( s,2H,minor),3.84(t,J=5.6 Hz,2H,major),3.81(s,2H,major),3.79(s,2H,minor)。
2.2 (2Z)-4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1, 2>,4]三唑并[4,3-A]吡嗪-7(8H)-基]-1-(2,4,5-三氟苯基)丁- 2-烯-2-胺(3)的合成向2 L三口烧瓶中加入无水乙醇(800 mL)、化合物2(140 g,0.35 mol)、醋酸铵(80 g,1.0 mol),室温搅拌1 h,滴加氨水(37.3 g,0.62 mol)升温至回流搅拌2 h,然后冰水浴降温至0 ℃,析出固体,滤过,湿品减压干燥得到白色晶体3(131 g),收率93.6%,(文献报道[3]:收率82%)。
1H-NMR(400 MHz,DMSO-d6)δ:8.48(s,br,1H),7.50(m,2H),6.82(s,br,1H),4.90(s,1H),4.85(s,2H),4.14(t,J=5.1 Hz,2H),3.90(t,J=5.1 Hz,2H),3.44(s,2H)。
2.3 西格列汀消旋体(4)的合成向2 L三口瓶中加入甲苯(560 mL)和化合物3(50 g,0.13 mol),降温至-10 ℃,加入NaBH4(14.5 g,0.38 mol)搅拌下滴加冰醋酸酸 (156 g,0.26 mol),滴加温度保持-5 ℃左右,滴毕,升温至0 ℃左右反应4~6 h。加水(500 mL),用醋酸乙酯(500 mL×2)萃取,合并有机相,用无水硫酸钠干燥,旋干溶剂得淡黄色油状液体4(48 g),收率92.5%。
ESI-MS m/z:408.0[M+H]+。1H-NMR(400 MHz,CDCl3)δ:7.02(m,1H),6.96(m,1H),4.91(m,s,2H),4.15(m,4H),3.62(s,1H),3.50(bs,1H),2.81~2.40(bm,4H),1.71(bs,2H)。
2.4 西格列汀的合成向2 L三口烧瓶中加入甲醇(900 mL)、纯化水(480 mL)、(-)-二对甲苯酰-L-酒石酸(27g,0.07 mol)和化合物4(28.5 g,0.07 mol),回流1 h,降温至40 ℃搅拌8 h,趁热滤过,滤饼再用甲醇(200 mL)、纯化水(105 mL)升温溶解,降温至40 ℃搅拌8 h,趁热滤过,滤饼用10% NaOH水溶液溶解,二氯甲烷萃取,浓缩至干,得到白色固体西格列汀(10.2 g),总收率36%,ee值98.2%,mp 113.9~115.5 ℃(文献报道[10]:mp 114.1~115.7 ℃,ESI-MS m/z:408.2 [M+H]+,1H-NMR(400 MHz,CDCl3)δ:7.15~7.10(m,1H),6.94~6.88(m,1H),5.06~4.88(m,2H),4.22~4.07(m,3H),3.98~3.70(m,1H),3.69~3.64(m,1H),2.95~2.82 (m,2H),2.80~2.57(m,2H)。
3 讨论西格列汀的合成文献[9-10]采用[(COD)RhCI]2、R,S-t-BuJosiphos进行不对称氢化烯胺,但是昂贵的手性催化剂制约了生产的成本。化合物4的拆分影响到整条路线的收率,因此本文着重对拆分步骤进行了优化筛选。分别筛选了拆分剂的种类、温度、溶剂量等条件,将西格列汀的ee值提高至98%以上,拆分收率提高至36%~40%,见表 1。1、2、3号实验中拆分试剂选择,优选L-DTTA;4~8号实验中反应温度及溶剂量的选择,反应温度越高,ee值越高,但收率越低,溶剂量越小,ee值越低,但收率越高,优选反应温度40℃,溶剂量10倍。因此通过科学的实验优化最大提高拆分收率是本文的意义所在。
| 表 1 拆分实验参数优化 Table 1 Experiment parameter optimization |
中间体2的合成方法,采用一锅法反应,优化了特戊酰氯和3-(三氟甲基)-5,6,7,8-四氢-[1,2,4]三唑并[4,3-a]吡嗪盐酸盐的配比,大幅降低了酰胺杂质的产生,原工艺10%的副产物杂质降低至2%以下,将中间体3固液分离了出来了,大大提高了中间体3的纯度,减少了杂质带入下一步产生的风险。
| [1] |
Gallwitz B.
Therapies for the treatment of type 2 diabetes mellitus based on incretin action[J]. Minerva Endocrinol , 2006, 31 (2) : 133–147.
( 0) 0)
|
| [2] |
许菁, 王玉丽, 徐为人, 等.
治疗2 型糖尿病的新型 药物—西他列汀[J]. 中国药物与临床 , 2007, 7 (11) : 861–863.
( 0) 0)
|
| [3] |
Hansen K B, Hsiao Y, Xu F, et al.
Highly efficient asymmetric synthesis of sitagliptin[J]. J Am Chem Soc , 2009, 131 (25) : 8798–8804.
DOI:10.1021/ja902462q ( 0) 0)
|
| [4] |
Kim D, Wang L P, Beconi M, et al.
(2R)-4-oxo-4-[3- (trifluoromethyl)-5,6-dihydro[1,2,4]triazolo[4,3-a]pyrazin- 7(8H)-yl]-1-(2,4,5-trifluorophenyl)butan-2-amine: a potent, orally active dipeptidyl peptidase IV inhibitor for the treatment of type 2 diabetes[J]. J Med Chem , 2005, 48 (1) : 141–151.
DOI:10.1021/jm0493156 ( 0) 0)
|
| [5] |
Hansen K B, Balsells J, Dreher S, et al.
First generation process for the preparation of the DPP-IV inhibitor Sitagliptin[J]. Org Pro Res Dev , 2005, 9 (5) : 634–639.
DOI:10.1021/op0500786 ( 0) 0)
|
| [6] |
陈清奇.
新药化学全合成路线手册(1999-2007)[M]. 北京: 科学出版社, 2008 : 366 -370.
( 0) 0)
|
| [7] |
Bazin H G, Bess L S, Livesay M T, et al.
New synthesis of glycolipid immunostimulants RC-529 and CRX-524[J]. Tetrahedron Lett , 2006, 47 (13) : 2087–2092.
DOI:10.1016/j.tetlet.2006.01.137 ( 0) 0)
|
| [8] |
Dreher S D,Ikemoto N,Njolito E,et al.Process to chiral beta-amino acid derivatives[P].WO:2004085661,2004-10-07.
( 0) 0)
|
| [9] |
Xiao Y,Armstrong J D,Krska S W,et al.Process for the preparation of chiral beta-amino acid derivatives by asymmetric hydrogenation[P].WO:2004085378,2004-10-07.
( 0) 0)
|
| [10] |
Wenslow R M,Armstrong J D,Chen A M,et al.Novel crystal forms of a dihydrogen phosphate salt of a trizolopyrazine dipetidyl prtidase IV inhibitor[P].WO:2005020920,2005-03-10.
( 0) 0)
|
 2016, Vol. ${metaVo.volume}
2016, Vol. ${metaVo.volume}

