2. 天津药物研究院 释药技术与药代动力学国家重点实验室 天津市药物设计与发现重点实验室, 天津 300193;
3. 菏泽医学专科学校, 山东 菏泽 274000
2. Tianjin Key Laboratory of Molecular Design and Drug Discovery, State Key Laboratory of Drug Delivery Technologies and Drug Metabolism, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. Heze Medical College, Heze 274000, China
缓释制剂作为顺应需求的剂型一直是药学研究的热门。亲水凝胶缓释骨架片由于操作工艺简单、便于生产、缓释效果好等特性,在缓释制剂领域地位重要,发展迅速[1]。在亲水凝胶辅料的选择以及辅料的质量稳定重现性方面没有良好的控制指标,使这类产品在研制和放大过程中存在较大的不确定性。羟丙基甲基纤维素(hydroxypropyl methyl cellulose,HPMC)物理和化学性质优良,结构中的非离子型纤维素醚不带离子,亲水亲油基团和疏水基团合理比例使其具有较好的与不同分子相互作用能力,是应用最多、范围最广的亲水凝胶骨架材料[2],选择HPMC研究亲水凝胶具有较好的代表性。托拉塞米利尿作用强,起效缓和,生物利用度高,不良反应少,是治疗高血压、心力衰竭、肾衰、肝腹水的有效药物[3]。托拉塞米极性较大,非常适合结合亲水凝胶实现缓释作用。为了寻找控制亲水凝胶缓释性能的参数,本研究以HPMC为辅料,以托拉塞米为模型药,考察HPMC凝胶对托拉塞米阻滞率的影响,为HPMC辅料HPMC应用到缓释骨架片提供数据。 1 仪器与材料
Laballiance Series Ⅲ 高效液相色谱泵、Laballiance AS1000自动进样器、Spectra100检测器、Laballiance HPLC工作站。电热恒温水浴锅(北京医疗设备厂);Sartorius BP211D电子天平(德国赛多里斯公司);Autoscience AS3120超声波清洗机(奥特赛恩斯仪器有限公司);Evolution 220紫外分光光度计(Thermo Scientific)。三室渗透装置[4]:自制的三室有机玻璃渗透装置,从左向右分别为A、B、C室,三室之间可以半透膜间隔,每室有两孔作为取样和通气之用,膜的渗透面积为10 cm2,每个室体积为10 mL。
托拉塞米原料药(批号050601,质量分数>99%,湖北百科药业有限公司);托拉塞米对照品(批号100605-200401,中国食品药品检定研究院);HPMC K4M(批号ZE15012 N03)、HPMC K15M(批号MJ15012N02)、HPMC K100M(批号ZE15012 N03)均由上海卡乐康包衣技术有限公司提供;HPMC 100M(批号Y-Z01404008)由山东赫达股份有限公司提供;半透膜MWCO 7K(批号100110)、MWCO 3.5K(批号110118)、MWCO 2K(批号120118)、MWCO 1K(批号120118)均由上海绿鸟科技有限公司提供;甲醇(天津市康科德科技有限公司);蒸馏水为纯化水,其余试剂均为分析纯。 2 方法与结果 2.1 托拉塞米的HPLC法测定 2.1.1 色谱条件[5]
VenusiL MP C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇-0.02 mol/L磷酸二氢钾(55∶45);体积流量:1 mL/min;检测波长:290 nm;柱温:40 ℃,进样量:20 μL。 2.1.2 对照品溶液的配制
精密称取托拉塞米对照品适量,流动相溶解,即得100 μg/mL对照品溶液。 2.1.3 供试品溶液的配制
称取适量托拉塞米原料药及适量HPMC,流动相溶解,配制成含托拉塞米2、10、25 μg/mL的供试品溶液。 2.1.4 线性关系考察
精密量取托拉塞米对照品液1.0、2.0、5.0、10.0、15.0、25.0、40.0 mL,置7个100 mL量瓶中,用注射用水稀释至刻度,摇匀,即得1、2、5、10、15、25、40 μg/mL溶液,进样测定,记录色谱图。以质量浓度为横坐标,峰面积为纵坐标,进行回归分析,得回归方程Y=18 825 X-7 226.1,r=0.999 5,结果表明托拉塞米在1~40 μg/mL与峰面积的线性关系良好。 2.1.5 稳定性试验
取2、10、25 μg/mL供试品溶液,于37 ℃密封放置,分别于0、1、3、7、10、24 h进样测定,结果峰面积的RSD值分别为1.9%、1.7%、1.9%。表明供试品溶液在24 h内稳定性良好。 2.1.6 重复性试验
取托拉塞米原料药6份,加入适量HPMC,制备供试品溶液,进样,测定峰面积,计算托拉塞米质量分数,结果其RSD值为1.5%。 2.1.7 回收率试验
精密称定托拉塞米原料约5 mg、HPMC 5 mg各6份,置同一个500 mL量瓶中,加适量流动相溶解,制备供试品溶液,进样测定,结果平均回收率为99.8%,RSD值为0.5%。 2.1.8 测定
精密称取托拉塞米对照品适量,流动相稀释,制成30 μg/mL对照品溶液。取供试品溶液进样测定,外标法计算托拉塞米的质量浓度。 2.2 渗透试验
半透膜的截留相对分子质量(MWCO)可以影响药物在模型中的渗透速度,MWCO越大的半透膜对药物透过的影响越小,因此在确保HPMC不透过的情况下,尽可能使用MWCO大的半透膜[6]。根据前期的考察选择MWCO 7K半透膜,制成4.5 cm的正方形,浸泡于水中30 min后使用。把模型及半透膜固定紧密于各室之间,于中间B室注满水,置于白纸上30 min,观察中间室液面的变化,检验模型的紧密性。通过密封性检查的装置,把中间室的水排空,按A室为空白水、B室为HPMC溶液、C室为托拉塞米溶液,顺序装液、编号,把模型置于37 ℃水浴锅中保持恒温,在1、3、7、10、24 h取样0.15 mL作为样品溶液,并以蒸馏水及时补液。进样测定,计算托拉塞米的质量浓度。 2.3 参数的计算
体系平衡状态下的托拉塞米药物浓度有两种计算方法:第一种方法是将1/3的起始质量浓度作为“理论平衡状态下的质量浓度”;第二种方法是将A室和C室浓度的平均值作为“平衡状态下的质量浓度”。分别计算透过率和阻滞率,衡量渗透效果。
透过率=从C室透过到A室的药物质量浓度/体系平衡状态下的药物质量浓度
阻滞率=(空白组透过率-对照组透过率)/空白组透过率
2.4 药物本身渗透速度的测定A室、B室加入10 mL蒸馏水,C室加入10 mL 25、50、100 μg/mL托拉塞米溶液,实验温度为37℃,测定在1、3、7、10、24 h时C室向A室渗透的速度。中间B室为空白水时,托拉塞米从C室到A室的扩散需要透过两层半透膜,不同浓度药物的渗透速度的结果见图 1。
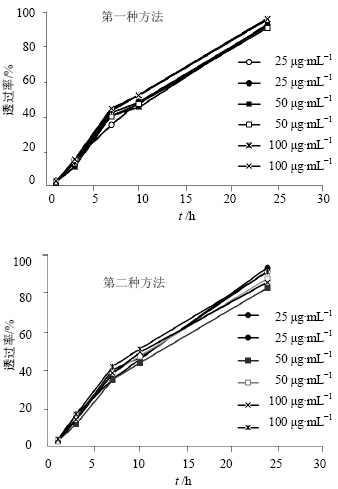 | 图 1 药物本身的渗透速度Fig. 1 Penetration speed of drugitself |
第一种方法以A室药物浓度与1/3起始药物浓度比值计算。第二种方法以A室药物浓度/A和C室浓度的平均值计算。第一种方法得到的1、3、7、10、24 h的透过率分别为3.1%、15.0%、38.7%、47.9%、90.2%,RSD值分别为13.1%、10.2%、4.9%、4.5%、3.5%,表明除了1、3 h本身透过率较低引起误差较大以外,7 h以后药物3种质量浓度的透过率基本一致,RSD值都小于5%。
为了消除半透膜可能存在吸附等因素,同时测定了两侧的药物质量浓度,以平均值作为实际平衡药物质量浓度,将透过的质量浓度除以平衡药物质量浓度后,第二种方法得到的1、3、7、10、24 h的透过率分别为2.3%、13.4%、40.8%、48.8%、93.3%,与第一种方法测定的数据非常接近,因此,可以采用第一种方式,直接用理论平均质量浓度计算,减少了测定的工作量。因此采用第一种方法计算透过率。
从渗透速度的数据来看,半透膜对药物的平衡速度有一定影响,托拉塞米在37 ℃下10 h透过率约50%,24 h基本达到平衡。 2.5 HPMC质量浓度对阻滞率的影响
A室加入10 mL蒸馏水、B室加入不同质量浓度(5、10、20 mg/mL)的HPMC溶液,C室加入10 mL 50 μg/mL托拉塞米溶液,实验温度为37 ℃,测定在1、3、7、10、24 h时C室向A室渗透的速度,计算阻滞率。固定HPMC黏度为15M,托拉塞米质量浓度为50 μg/mL,考察5、10、20 mg/mL HPMC对于托拉塞米阻滞率的影响。结果见图 2。
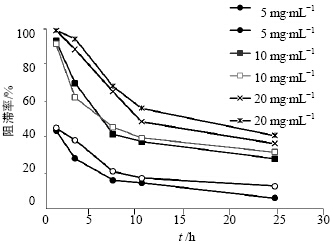 | 图 2 不同HPMC质量浓度对托拉塞米阻滞率的影响Fig. 2 Effect of different concentrations of HPMC on block rate of torasemide |
HPMC各质量浓度对托拉塞米阻滞率的影响随着测定时间的延长而逐步减少,7 h后趋于平缓。定义阻滞率=(透过率空白-透过率凝胶)/透过率空白,在1、3 h由于药物透过率过低,数据稳定性差,7~10 h时药物本身的透过率在50%左右,凝胶的阻滞作用容易评价。随着时间的延长,尽管凝胶存在阻滞作用,药物也会逐步平衡,24 h以后体现出来的阻滞率下降正是这种表现,因此选择7~10 h考察阻滞率比较合理。
还可以看到,HPMC的质量浓度对托拉塞米的阻滞率影响很大,阻滞率与质量浓度不完全是线性倍数关系,高、中质量浓度间的差异小于中、低质量浓度,提示凝胶对药物阻滞作用可能存在一个质量浓度相关的拐点。
总体来看,在同样的HPMC黏度条件下,HPMC的质量浓度越大,凝胶对托拉塞米的阻滞率越大。 2.6 HPMC黏度对阻滞率的影响
A室加入10 mL蒸馏水、B室加入不同黏度(4M、15M、100M)的HPMC溶液,C室加入10 mL 50 μg/mL托拉塞米溶液,实验温度为37 ℃,测定在1、3、7、10、24 h时C室向A室渗透的速度,计算阻滞率。固定HPMC的质量浓度为10 mg/mL,托拉塞米质量浓度为50 μg/mL,考察了不同黏度(4M、15M、100M)HPMC对托拉塞米透过的影响。结果见图 3。
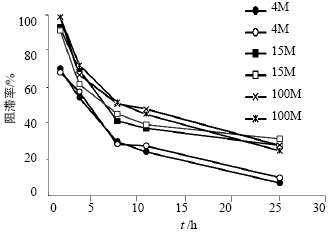 | 图 3 不同HPMC黏度对托拉塞米阻滞率的影响Fig. 3 Effect of different viscosity of HPMC to torasemide |
不同黏度HPMC对托拉塞米的阻滞率同样随着测定时间的延长而逐步减少,7 h后趋于平缓。HPMC的黏度对托拉塞米的阻滞率影响较大,HPMC的质量浓度为10 mg/mL时,随着黏度升高阻滞率增加。提示阻滞率这个指标对不同黏度的辅料具有较好的区分作用。
根据以上结果,推测在HPMC黏度为100M,质量浓度为20 mg/mL的条件下,对于50 μg/mL托拉塞米的阻滞率最大。 2.7 验证试验
为了验证HPMC的黏度和质量浓度对托拉塞米的阻滞率的影响,选择了100M的黏度进行考察,同时选择了进口和国产两种HPMC,3个质量浓度5、10、20 mg/mL,考察阻滞率指标的重现性和适用性。
A室加入10 mL蒸馏水、B室加入100M国产或进口的HPMC溶液,质量浓度分别为5、10、20 mg/mL,C室加入10 mL 50 μg/mL托拉塞米溶液,实验温度为37 ℃,测定在7、10 h时C室向A室渗透的速度,计算阻滞率。结果见表 1。
| 表 1 进口和国产HPMC样品的阻滞率 Table 1 Block rate of domestic and imported HPMC |
可见进口HPMC与国产HPMC本身在7、10 h的阻滞率重现性良好,RSD值都在5%以内,表明固定条件后可以得到稳定的实验参数。比较相同型号(100M)的进口与国产HPMC,发现两者在10、5 mg/mL质量浓度时阻滞率基本一致,但在20 mg/mL时,国产的阻滞率明显大于进口产品,提示两产品的质量浓度对药物的阻滞特征不完全一致。
根据以上结果,可以确定比较合理的HPMC凝胶对托拉塞米的阻滞率的测定条件为:HPMC K100M质量浓度分别为5、10、20 mg/mL,托拉塞米质量浓度为50 μg/mL,在37 ℃水浴条件下,测定时间为10 h。 3 讨论
亲水凝胶在缓释制剂中常作为骨架材料使用,在亲水凝胶骨架片中,HPMC溶胀形成一个连续的浓度梯度,最外层的HPMC浓度稀到一定程度,出现骨架溶蚀[7],溶胀和溶蚀一直伴随进行,直至达到片芯全部溶蚀[8, 9]。本研究考察溶胀形成的凝胶层对托拉塞米的阻滞作用,这也是一种主要的缓释机制。因此,本研究旨在对亲水凝胶的缓释能力起到表征作用。
实际的亲水凝胶的浓度梯度可以看作是一个连续的浓度,理想状态是考察一系列浓度的HPMC对药物阻滞的影响,但实际操作中超过20 mg/mL后配制非常困难,因此,选择了3个浓度进行了考察,从国产和进口的HPMC(100M)的阻滞率结果来看,两者高阻滞率端存在差异,表明这个指标具有较好的区分性,对HPMC在实际应用中的差异起到指导作用。综合各实验的结果,推测凝胶的浓度对托拉塞米阻滞率形成一个S形曲线,可能存在两个特征性拐点,对决定辅料性质的具有精确描述的意义,选择拐点和中间的HPMC浓度结果更具代表性,值得进一步探索。
亲水凝胶对托拉塞米的缓释机制从本质上来看是两个方面:一种是HPMC对托拉塞米物理的滤过作用,主要与分子间的空隙大小相关;另一种主要与HPMC对托拉塞米的相互作用的强弱有关。进一步通过对HPMC的浓度和托拉塞米之间的曲线的研究,可以得到系统的参数,将对HPMC对HPMC应用到缓释骨架片的研究提供参考。
| [1] | 刘朋朋, 季金苟. 缓控释制剂给药系统的研究进展 [J]. 河北化工, 2007, 30(12): 14-17. |
| [2] | 沈丽琳. 羟丙甲纤维素在药物制剂方面的应用和研究 [J]. 中国药业, 2007,16(12): 64-65. |
| [3] | 华 潞, 李一石, 宋 珍. 新型袢利尿剂托拉塞米 [J]. 中国新药杂志, 2003, 12(11): 888-892. |
| [4] | 吴国顺, 孟 策, 李均艳, 等. NE30D作为膜控材料的盐酸氨溴索缓释特征参数的研究 [J]. 药物评价研究, 2015, 38(1): 56-60. |
| [5] | 姚晓敏, 冒宜兰, 倪 桃, 等. HPLC法测定注射用托拉塞米含量及有关物质 [J]. 中国药科大学学报, 2008, 39(2): 185-187. |
| [6] | 王 博, 张来华, 李怨新, 等. 亲水凝胶骨架缓释片释药机制评价方法的研究进展 [J]. 中国医药工业杂志, 2009, 40 (10): 782-786. |
| [7] | Reddy K R, Mutalik S, Reddy S. Once-daily sustained-release matrix tablets of Nicorandil: formulation and in vitro evaluation [J]. AAPS PharmSciTech, 2003, 4(4): 1-9. |
| [8] | 许伯慧, 郭丽慧, 徐洪玲. 氢氯噻嗪HPMC骨架片释药机制影响因素研究 [J]. 中国现代应用药学, 2010, 27(6): 527-531. |
| [9] | Shoaib M H, Tazeen J, Merchant H A, et al. Evaluation of drug release kinetics from Ibuprofen matrix tablets using HPMC [J]. Pak J Pharm Sci, 2006, 19(2): 119-124. |
 2015, Vol. 30
2015, Vol. 30


