2. 河北医科大学 药学院, 河北 石家庄 050017
2. College of Pharmacy, Hebei Medical University, Shijiazhuang 050017, China
1 仪器与试剂 1.1 仪器
XW-80A漩涡混合器(苏州江东精密仪器有限公司);TDL-5-A离心机(上海安亭科学仪器厂);CU600电热恒温水浴箱(上海一恒科技有限公司);KQ-250E医用超声波清洗器(昆山市超声仪器有限公司);CPA225D电子天平(德国Sartorius);UV-2550紫外可见分光光度计(日本岛津)。 1.2 药品及试剂
白芍总苷(自制,其中含芍药苷41.3%、芍药内酯苷14.7%)。DPPH、L-抗坏血酸(VC)购自Sigma公司;磷酸氢二钠、邻菲罗啉、双氧水溶液、磷酸二氢钠、乙醇购自天津市永大化学试剂开发中心;硫酸亚铁购自天津市风船化学试剂科技有限公司;硫代巴比妥酸、邻苯三酚、三氯乙酸购自国药集团,试剂均为分析纯;氯化钠注射液(河北天成药业有限公司)。
1.3 实验动物
清洁级新西兰家兔,雌雄不限,体质量2.0~2.5 kg,购于河北省实验动物中心,动物使用许可证号SCXK(冀)2008-1-003。
2 方法与结果 2.1 ·OH的清除能力的测定
实验通过Feton反应产生·OH[3]。向具塞试管中加入不同质量浓度(0.2、0.4、0.6、0.8、1.0 g/L)的白芍总苷溶液1.0 mL、150 mmol/L磷酸缓冲盐溶液(PBS,pH 7.4)2.0 mL、0.75 mmol/L邻菲罗啉2.0 mL、0.75 mmol/L硫酸亚铁2.0 mL,混匀。加入3.00 mmol/L双氧水1.0 mL,在532 nm处测得吸光度值(A0)。另取试管,以乙醇代替白芍总苷溶液,按上述方法操作,测得吸光度值(A1);以乙醇代替白芍总苷和双氧水溶液,按上述方法操作,测得吸光度值(A2)。以VC为标准抗氧化剂,计算·OH自由基清除率,结果见图 1。
·OH自由基清除率=(A0-A1)/(A2-A1)
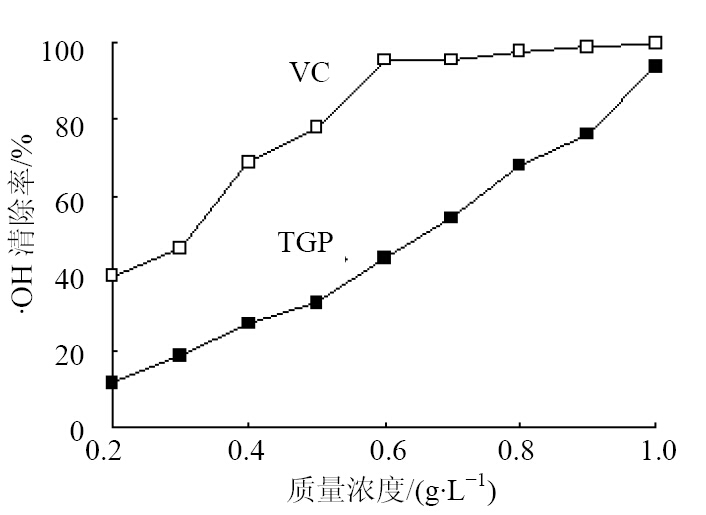 | 图 1 白芍总苷对·OH的清除作用Fig. 1 Scavenging effect of total glucosides of paeony (TGP) on ·OH radicals |
2.2 DPPH·的清除能力的测定
向具塞试管中加入0.13 mmol/L DPPH溶液2.0 mL、乙醇2.0 mL,室温避光放置30 min,在517 nm处测定吸光度值(A0)。另取具塞试管,以不同质量浓度(0.2、0.4、0.6、0.8、1.0 g/L)的白芍总苷溶液代替乙醇,按上述方法操作,测定吸光度值(A1);以乙醇与白芍总苷混合液吸光度值记为A2。计算DPPH·的清除率[4, 5, 6],结果见图 2。
DPPH·清除率=[1-(A1-A2)/A0]
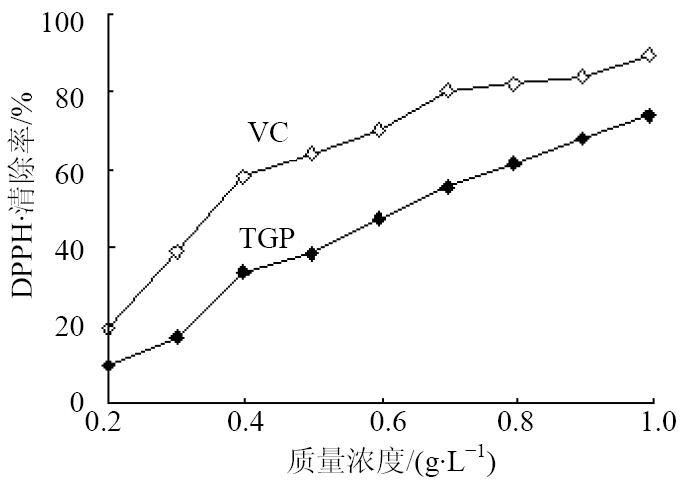 | 图 2 白芍总苷对DPPH·的清除作用Fig. 2 Scavenging effect of TGP on DPPH· radical |
2.3 对·OH引发的红细胞膜破裂的抑制作用
取家兔颈动脉血,肝素钠抗凝,1 500 r/min离心10 min,弃去血浆,加生理盐水至全血36倍体积得红细胞混悬液[7]。取具塞试管加入0.4 mL红细胞混悬液、 1.75 mol/L双氧水0.4 mL、6.00 mmol/L硫酸亚铁0.4 mL、0.04 mol/L PBS(pH 7.0)2.0 mL、不同质量浓度(10、20、30、40 mg/L)的白芍总苷溶液1.3 mL。37 ℃振摇60 min后取出,离心,取上清液于500 nm处测定吸光度值(A1)。另取具塞试管,以蒸馏水代替白芍总苷溶液,记为A0。计算白芍总苷对红细胞膜破裂抑制率,并计算IC50。
红细胞膜破裂抑制率=(A0-A1)/A0
红细胞富含不饱和脂肪酸和Fe2+,自由基攻击膜磷脂层诱发链式反应,发生脂质过氧化、膜脆性增加,导致细胞肿胀、破裂、溶血[8, 9]。如图 3所示,白芍总苷对·OH引发的红细胞膜破裂有一定的抑制作用。以白芍总苷质量浓度对红细胞膜破裂抑制率进行回归分析,得回归方程Y=0.40 X+37.93(r=0.989 4),其IC50为30.17 mg/L,优于VC对红细胞膜破裂的抑制率,后者的IC50值在实验浓度范围内未测出。
2.4 对肝、脑匀浆脂质过氧化的抑制作用
取家兔肝脏、脑,洗净,剪碎,以生理盐水制成15%的肝匀浆和10%的脑匀浆[8]。向具塞试管中依次加入匀浆0.9 mL、1.75 moL/L双氧水0.2 mL、6.00 mmoL/L硫酸亚铁0.2 mL、不同质量浓度(10、20、30、40 mg/L)的白芍总苷溶液0.5 mL,37 ℃振摇60 min。然后加入1.25 mol/L三氯乙酸1.5 mL、23.50 mmol/L硫代巴比妥酸1.5 mL,90 ℃振摇15 min,冷却,离心,取上清液于532 nm波长处测定吸光度值(A1)。另取具塞试管,以蒸馏水代替白芍总苷溶液,记为损伤A0。计算药物对脂质过氧化抑制率,并计算IC50,结果见图 3。
脂质过氧化抑制率=(A0-A1)/A0
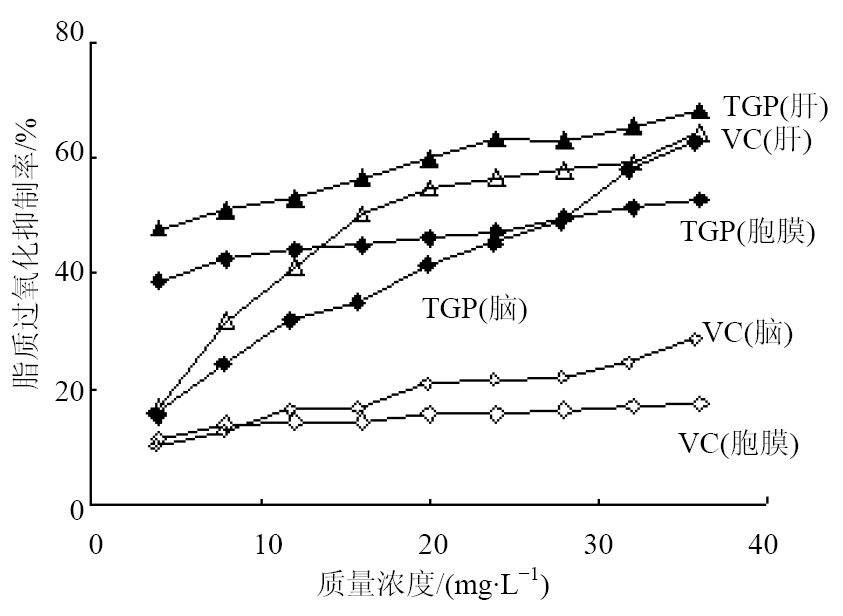 | 图 3 白芍总苷对红细胞膜及肝、脑匀浆脂质过氧化的抑制作用Fig. 3 Inhibition of TGP on hemocytocatheresis, liver, and brain homogenate lipid peroxidation |
3 讨论
自由基是指最外层电子含有一个或多个不成对电子的原子或原子团,化学性质极活泼。一定水平自由基是维持生命活动所必需的,但由于多种原因,如外源性药物、辐射、自身抗氧化系统功能失调等原因,机体自由基水平升高,过量的自由基通过链式反应,对蛋白质、脂类、核酸等生物分子产生严重的损害。当红细胞膜被自由基损伤发生溶血,仅留下一个双凹圆碟形血影细胞,血影细胞失去正常红细胞的可塑性变形能力,易堵塞小梁网眼使房水回流发生障碍,结果导致眼压升高[11]。肝、脑细胞中含有大量脂质,自由基与不饱和类脂发生抽氢反应,形成以碳原子为中心的自由基,引发自由基链反应。脂质过氧化作用一旦被引发,即可持续的进行(产生LO·、LOO·、和LOOH等)。脂质受自由基攻击生成脂褐素,导致老年性痴呆及肝损伤[12, 13, 14]。脂质过氧化作用导致膜物理构成比例失调,使膜结构的变形性和通透性改变,引起细胞生理活性变化。减缓自由基对膜结构及类脂的氧化,是减缓相关疾病发生发展的手段之一[15]。近年来,自由基对机体毒害受到重视,源自中药的自由基清除剂研究已成为药学研究重点领域之一。
DPPH·是一种N中心自由基,由于3个苯环的空间障碍,使夹在中间的与三硝基苯基连接的N原子有一个稳定的单电子。DPPH·与自由基清除剂反应时,反应能力主要受到位阻效应影响。VC分子较白芍总苷分子更小,所以更容易与DPPH·自由基结合,发挥较强的清除DPPH·自由基作用。
羟自由基电子亲和能为569.3 kJ,容易进攻高电子云密度点[16]。白芍总苷中的苷类含有大量羟基,可提供抽氢反应所需质子。·OH通过抽氢反应形成H2O和新的白芍总苷自由基。新生成的白芍总苷自由基氧化性较·OH活性低,不足以使膜脂质过氧化起到保护细胞膜的作用。本研究中羟自由基清除实验结果可见白芍总苷对生物反应体系作用优于化学反应体系,可能是由于VC极性较高,在水中分散好、溶解度高,所以VC在以水为介质的化学实验体系清除羟自由基活性高。白芍总苷中有效成分萜类脂溶性较好,细胞器为脂性膜,白芍总苷中有效成分更利于聚集,中断自由基链式反应,从而发挥其保护细胞器的作用。
| [1] | 武晓旭, 章超群, 许 坤, 等. 白芍总苷对糖尿病大鼠肾组织中内质网应激的影响 [J]. 安徽医科大学学报, 2014, 49(6): 768-772. |
| [2] | 刘月丽, 吕俊华. 白芍总苷的降血脂抗氧化作用及其对脂肪肝的防治研究 [J]. 海南医学院学报, 2012, 18(2): 158-161. |
| [3] | 蔡凌云. 乌饭树叶总黄酮体外抗氧化活性 [J]. 中成药, 2011, 33(6): 1054-1057. |
| [4] | Arife A K, Bengi E, Yelda C E, et al. Antioxidant activity and proline content of leaf extracts from Dorystoechas hastate [J]. Food Chem, 2008, 111: 400-407. |
| [5] | Socha R, Juszczak L, Pietrzyk S, et al. Antioxidant activity and phenolic composition of herbhoneys [J]. Food Chem, 2008, 113: 568-574. |
| [6] | Wu C, Duckett S K, Neel J, et al. Influence of finishing systems on hydrophilic and lipophilic oxygen radical absorbance capacity (ORAC) in beef [J]. Meat Sci, 2008, 80: 662-667. |
| [7] | 金 越, 吕 勇, 韩国柱, 等. 槲皮素及异槲皮素、芦丁抗自由基活性的比较研究 [J]. 中草药, 2007, 38(3): 408-412. |
| [8] | 王晓红, 宋 儒, 周 波, 等. 玉米紫色植株色素对溴代苯小鼠肝脂质过氧化的保护作用 [J]. 中国工业医学杂志, 2007, 20(5): 323-326. |
| [9] | 金 鸣, 李金荣, 吴 伟. 羟基红花黄色素A抗氧化作用的研究 [J]. 中草药, 2004, 35(6): 665-666. |
| [10] | 崔力剑, 窦玉红, 黄 芸, 等. 三消草总黄酮的抗氧化活性研究 [J]. 中成药, 2012, 34(10): 1094-1097. |
| [11] | 史桂桃, 李晓芳, 朱 丹. 78例眼挫伤性血影细胞性青光眼临床分析 [J]. 内蒙古医学杂志, 2009, 41(12): 1501-1502. |
| [12] | Sonnen J A, Breitner J C, Lovell M A, et al. Free radical-mediated damage to brain in Alzheimer's disease and its transgenic mouse models [J]. Free Radical Bio Med, 2008, 45: 219-230. |
| [13] | 刘志婷, 黄 晶, 王永香, 等. 沙棘提取物对老龄大鼠脑脂褐素的影响 [J]. 中国老年学杂志, 2001, 21(7): 300-301. |
| [14] | 申秀英, 许晓路, 章子贵, 等. 碘硒氟联用对小鼠肝肾脂褐素含量的影响 [J]. 浙江师范大学学报: 自然科学版, 2003, 26(1): 51-53. |
| [15] | Grice H C. Safety evaluation of butylated hydroxyanisole from the perspective of effects on forestomach and oesophageal squamous epithelium [J]. Food Chem Toxicol, 1988, 26(8): 717-723. |
| [16] | 柯跃斌, 郑荣梁. 自由基毒理学 [M]. 北京: 人民卫生出版社, 2012: 20. |
 2015, Vol. 30
2015, Vol. 30

