2. 山东大学 化学与化工学院, 山东 济南 250100
2. School of Chemistry and Chemical Engineering, Shandong University, Jinan 250100, China
痛风是由于尿酸单钠盐(MSU)在关节等部位沉积而引起的以关节炎症和疼痛为主要特征的疾病,也是困扰人类的最古老的疾病之一。痛风的发病前提是高尿酸血症,后者一般是由于尿酸产生过多和/或尿酸代谢异常引起[1]。痛风目前已经逐渐发展为继高血压、高血脂和高血糖后的第4种代谢性疾病,其发病率正迅速增加。尿酸转运体1(URAT1)是近年来发现的一个可用于高尿酸血症和痛风治疗的新靶点[2, 3]。URAT1位于肾脏的近曲小管上,负责肾脏中大部分的尿酸重吸收[2]。lesinurad是美国Ardea生物科学公司研发的URAT1抑制剂,目前处于III期临床阶段[4, 5]。lesinurad最早是由抗病毒药物REDA806发展而来,为后者的体内代谢产物[6, 7],REDA806的结构见图 1。lesinurad的合成方法已有文献报道[8, 9, 10, 11, 12, 13, 14, 15],但是工艺描述不清楚,部分反应步骤产率很低。因此,本课题组对lesinurad的合成路线进行了研究,明确了一条实用的合成路线,见图 2。在此过程中,重点对由化合物4合成关键中间体7的步骤进行了深入研究,获得一种收率更高的合成化合物7的方法。
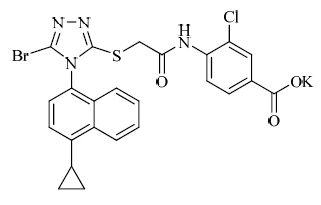 | 图 1 RDEA806的结构Fig. 1 Structure of RDEA806 |
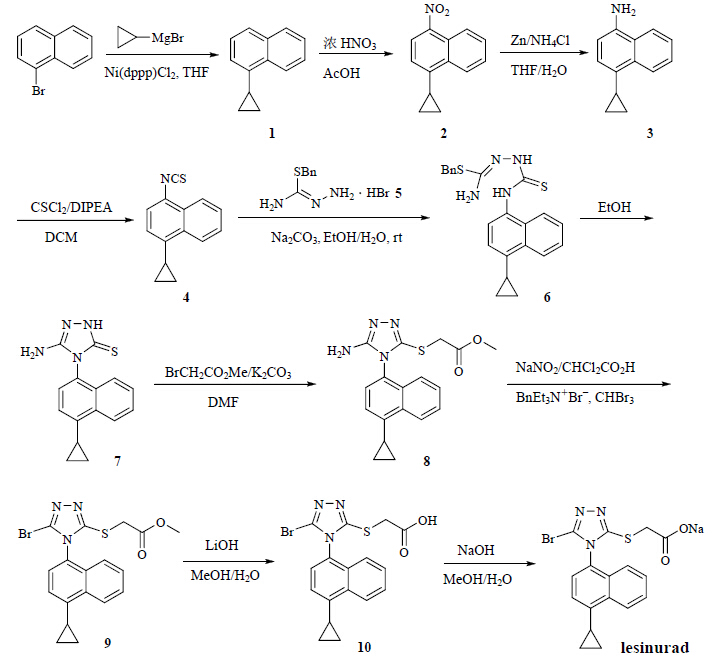 | 图 2 lesinurad的合成路线Fig. 2 Synthetic route of lesinurad |
RY-2显微熔点测定仪(天津天光光学仪器有限公司);Bruker AV 400 MHz型核磁共振仪、Bruker Vector 22型傅里叶变换红外光谱仪(瑞士Bruker公司);Agilent Q-TOF 6510型高分辨质谱仪(美国Agilent公司)。干燥的THF是以二苯甲酮作指示剂从金属钠中蒸馏获得;干燥的CH2Cl2是从CaH2中蒸馏获得。
2 方法与结果 2.1 1-环丙基萘(1)的合成向干燥的2 L圆底烧瓶中,加入1-溴萘(41.41 g,200 mmol)、[1,3-双(二苯基膦基)丙烷]氯化镍(16.50 g,40 mmol)和100 mL干燥的THF,冰水浴冷却下搅拌,用恒压滴液漏斗慢慢往体系中滴加1.0 mol/L环丙基溴化镁的THF溶液300 mL。滴加完毕后,反应化合物在氮气保护下室温搅拌5 h,然后升温至回流,反应24 h。反应完成后,反应混合物冷却至室温,然后小心倾倒至2 L搅拌的冰水中,搅拌,用浓盐酸调pH值至2,CH2Cl2(500 mL×3)萃取。合并有机相,用500 mL 5%氯化钠溶液洗涤,无水Na2SO4干燥。旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,正己烷洗脱纯化得到化合物1的纯品,无色液体26.92 g,收率80%。ESI-MS m/z:359.08 [2M+Na]+。1H-NMR(400 MHz,DMSO-d6)δ:8.36(1H,d,J=8.0 Hz,Ar-H),7.90(1H,d,J=8.4 Hz,Ar-H),7.74(1H,d,J=8.0 Hz,Ar-H),7.50~7.58(2H,m,Ar-H),7.39(1H,t,J=7.6 Hz,Ar-H),7.23(1H,d,J=6.8 Hz,Ar-H),2.34~2.40(1H,m,环丙基-CH),1.00~1.05(2H,m,环丙基-CH2),0.68~0.71(2H,m,环丙基-CH2)。上述数据与文献报道[16]基本一致。
2.2 1-环丙基-4-硝基萘(2)的合成向1 L的圆底烧瓶中加入化合物1(25.23 g,150 mmol)和250 mL冰醋酸,冰水浴冷却下搅拌,慢慢滴加50 mL浓硝酸。滴加完毕后,反应混合物在室温下继续搅拌5 h。反应完成后,反应混合物倾倒至1 L搅拌的冰水中,继续搅拌5 min,CH2Cl2(300 mL×3)萃取。合并有机相,用饱和NaHCO3溶液洗涤至水相pH值大于7,再用500 mL 5%的氯化钠溶液洗涤,无水Na2SO4干燥,旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,醋酸乙酯-正己烷(1∶30)洗脱纯化得到化合物2的纯品,黄色液体26.87 g,收率84%。ESI-MS m/z:214.02 [M+H]+。1H-NMR(400 MHz,DMSO-d6)δ:8.59~8.61(1H,m,Ar-H),8.38~8.41(1H,m,Ar-H),8.19(1H,d,J=8.0 Hz,Ar-H),7.75~7.83(2H,m,Ar-H),7.38(1H,d,J=8.0 Hz,Ar-H),2.53~2.58(1H,m,环丙基-CH),1.14~1.18(2H,m,环丙基-CH2),0.83~0.87(2H,m,环丙基-CH2)。
2.3 1-氨基-4-环丙基萘(3)的合成向1 L的圆底烧瓶中加入化合物2(25.59 g,120 mmol)、锌粉(78.46 g,1.2 mol)、NH4Cl(64.19 g,1.2 mol)、300 mL THF和90 mL水,在回流下搅拌,反应10 h。反应完成后,反应混合物冷却到室温,抽滤除去固体,滤液倾倒至1 L的冰水中,继续搅拌5 min,CH2Cl2(300 mL×3)萃取。合并有机相,用500 mL 5%氯化钠溶液洗涤,无水Na2SO4干燥。旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,醋酸乙酯-正己烷(1∶15)洗脱纯化得到化合物3的纯品,红色液体19.13 g,收率87%。ESI-MS m/z:184.10 [M+H]+。1H-NMR(400 MHz,DMSO-d6)δ:8.24(1H,d,J=8.4 Hz,Ar-H),8.07(1H,d,J=8.4 Hz,Ar-H),7.46~7.50(1H,m,Ar-H),7.37~7.41(1H,m,Ar-H),6.99(1H,d,J=7.6 Hz,Ar-H),6.59(1H,d,J=8.0 Hz,Ar-H),5.52(2H,bs,NH2),2.10~2.15(1H,m,环丙基-CH),0.89~0.93(2H,m,环丙基-CH2),0.53~0.57(2H,m,环丙基-CH2)。
2.4 4-环丙基-1-萘基异硫氰酸酯(4)的合成一只500 mL的干燥圆底烧瓶中加入化合物3(16.49 g,90 mmol)、二异丙基乙基胺(DIPEA,23.26 g,180 mmol)和150 mL干燥的CH2Cl2,所得混合物在冰水浴冷却下搅拌,慢慢滴加溶解硫光气(CSCl2,10.35 g,90 mmol)的干燥的CH2Cl2溶液20 mL。滴加完毕后,反应混合物在室温下继续搅拌0.5 h。反应完成后,反应混合物小心倾倒至500 mL搅拌的冰水中,继续搅拌1 min,CH2Cl2(150 mL×3)萃取。合并有机相,依次用200 mL 5%的稀盐酸和500 mL 5%的氯化钠溶液洗涤,无水Na2SO4干燥,旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,石油醚洗脱纯化得到化合物4的纯品,无色液体17.03 g,收率84%。ESI-MS m/z:258.04 [M+CH3OH+H]+。1H-NMR(400 MHz,DMSO- d6)δ:8.47(1H,d,J=8.0 Hz,Ar-H),8.01(1H,d,J=1.8、5.8 Hz,Ar-H),7.69~7.75(2H,m,Ar-H),7.55(1H,dd,J=2.8、8.0 Hz,Ar-H),7.23(1H,dd,J=1.6、7.6 Hz,Ar-H),2.40~2.45(1H,m,环丙基-CH),1.05~1.09(2H,m,环丙基-CH2),0.72~0.75(2H,m,环丙基-CH2)。
2.5 3-氨基-4-(4-环丙基萘-1-基)-1H-1,2,4-三唑- 5(4H)-硫酮(7)的合成一只500 mL的圆底烧瓶中加入溴化苄(11.97 g,70 mmol)和36 mL乙醇,冰水浴冷却下搅拌,加入硫代氨基脲(6.38 g,70 mmol),反应混合物升温回流0.5 h,得到化合物5的溶液。冷却至室温,加入180 mL水,搅拌,然后依次加入化合物4(15.77 g,70 mmol)和Na2CO3(3.71 g,35 mmol)的水溶液18 mL,所得混合物在室温下搅拌过夜,反应完成后得到一个浅黄色浆状物。抽滤,收集固体,少量水洗涤,然后室温下真空干燥,得到一个浅黄色固体,即为化合物6的粗品,在150 mL乙醇中回流0.5 h,反应完成后,反应混合物冷却至室温,得到一黄色浆状物,倾入500 mL搅拌的冰水中,继续搅拌1 min,用CH2Cl2(150 mL×3)萃取。合并有机相,用500 mL 5%的氯化钠溶液洗涤,无水Na2SO4干燥,旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,醋酸乙酯洗脱纯化得到化合物7的纯品,浅黄色固体14.63 g,收率74%,mp 260 ℃(分解)。分子式为C15H15N4S,ESI-HR-MS m/z:283.102 9 [M+H]+。IR vmaxKBr(cm−1):3 448,3 291,3 249,3 191,3 116,1 641,1 590,1 514,1 456。1H-NMR(400 MHz,DMSO-d6)δ:12.85(1H,bs,NH),8.51(1H,d,J=8.8 Hz,Ar-H),7.66(1H,t,J=7.2 Hz,Ar-H),7.57(1H,t,J=7.4 Hz,Ar-H),7.37(2H,s,Ar-H),7.31(1H,d,J=8.0 Hz,Ar-H),5.84(2H,bs,NH2),2.49~2.51(1H,m,环丙基-CH),1.11~1.15(2H,m,环丙基-CH2),0.81~0.83(2H,m,环丙基-CH2)。13C-NMR(100 MHz,DMSO-d6)δ:164.92,152.59,141.22,133.75,129.66,127.69,127.53,126.82,126.44,124.73,122.89,122.82,12.86,7.07,6.84。
2.6 2-((5-氨基-4-(4-环丙基萘-1-基)-4H-1,2,4-三唑- 3-基)硫)乙酸甲酯(8)的合成一只250 mL干燥的圆底烧瓶中加入化合物7(14.12 g,50 mmol)、固体K2CO3(8.29 g,60 mmol)和150 mL干燥的DMF,所得混合物在室温下搅拌,再加入溴乙酸甲酯(8.41 g,55 mmol),室温下继续搅拌2 h。反应混合物倾倒入500 mL搅拌的冰水中,继续搅拌1 min,用CH2Cl2(150 mL×3)萃取。合并有机相,用500 mL 5%的氯化钠溶液洗涤,无水Na2SO4干燥,旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,醋酸乙酯洗脱,得到化合物8的纯品,白色固体16.13 g,收率91%,mp 164~166 ℃(分解)。分子式为C18H19N4O2S,ESI-HR-MS m/z:355.122 1 [M+H]+。IR vmaxKBr(cm−1):3 427,3 330,3 080,1 747,1 629,1 561,1 479。1H-NMR(400 MHz,DMSO-d6)δ:8.53(1H,d,J=8.4 Hz,Ar-H),7.67~7.71(1H,m,Ar-H),7.59~7.63(1H,m,Ar-H),7.45(1H,d,J=7.6 Hz,Ar-H),7.38(1H,d,J=7.6 Hz,Ar-H),7.19(1H,d,J=8.4 Hz,Ar-H),5.72(2H,s,NH2),3.76(1H,d,J=15.6 Hz,SCH),3.71(1H,d,J=15.6 Hz,SCH),3.57(3H,s,OCH3),2.51~2.55(1H,m,环丙基-CH),1.12~1.15(2H,m,环丙基-CH2),0.78~0.87(2H,m,环丙基-CH2)。13C-NMR(100 MHz,DMSO-d6)δ:168.61,156.75,142.83,141.71,133.67,129.41,127.30,126.76,124.84,122.76,122.26,52.18,34.26,12.81,7.04,7.02。
2.7 2-((5-溴-4-(4-环丙基萘-1-基)-4H-1,2,4-三唑-3-基)硫)乙酸甲酯(9)的合成一只干燥的500 mL的圆底烧瓶中,将化合物8(14.18 g,40 mmol)溶于200 mL溴仿中,室温下搅拌,加入NaNO2(27.60 g,400 mmol)和苄基三乙基溴化铵(10.89 g,40 mmol),继续搅拌,再加入二氯乙酸(10.63 g,160 mmol),所得混合物在室温下继续搅拌2 h。反应完成后,反应混合物小心倾倒入600 mL搅拌的冰水中,继续搅拌1 min,用CH2Cl2(150 mL×3)萃取。合并有机相,依次用200 mL 5%的Na2S2O3溶液和200 mL 5%的氯化钠溶液洗涤,无水Na2SO4干燥,旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,醋酸乙酯-正己烷(1∶3)洗脱,得到化合物9的纯品,白色黏稠物12.88 g,收率77%。分子式为C18H17BrN3O2S,ESI-HR-MS m/z:418.022 2 [M(79Br)+H]+、420.021 2 [M(81Br)+H]+。IR vmaxKBr(cm−1):3 070,3 002,1 740,1 596,1 513,1 468。1H-NMR(400 MHz,DMSO-d6)δ:8.58(1H,d,J=8.4 Hz,Ar-H),7.74(1H,m,Ar-H),7.62~7.68(2H,m,Ar-H),7.43(1H,d,J=7.6 Hz,Ar-H),7.14(1H,d,J=8.0 Hz,Ar-H),4.08(1H,d,J=16.0 Hz,SCH),4.03(1H,d,J=16.4 Hz,SCH),3.62(3H,s,OCH3),2.53~2.57(1H,m,环丙基-CH),1.12~1.17(2H,m,环丙基-CH2),0.83~0.87(2H,m,环丙基-CH2)。上述数据与文献报道[9]基本一致。13C-NMR(100 MHz,DMSO-d6)δ:168.23,153.14,143.17,133.45,131.50,128.57,128.10,127.24,126.79,126.47,125.12,122.61,121.65,52.47,33.53,12.87,7.30,7.24。
2.8 2-((5-溴-4-(4-环丙基萘-1-基)-4H-1,2,4-三唑-3-基)硫)乙酸(10)的合成一只250 mL的圆底烧瓶中加入化合物9(8.37 g,20 mmol)和40 mL甲醇,室温下搅拌,加入含LiOH·H2O(2.52 g,60 mmol)的水溶液5 mL,室温下继续搅拌1 h,反应完成后,反应混合物小心倾倒入200 mL搅拌的冰水中,继续搅拌1 min,以浓盐酸调pH值至2~3,用CH2Cl2(150 mL×3)萃取。合并有机相,用200 mL水洗涤,无水Na2SO4干燥,旋转蒸发仪上蒸去溶剂,得到的残余物经硅胶柱色谱分离,醋酸乙酯洗脱得到化合物10的纯品,白色黏稠物6.95 g,收率86%。1H-NMR(400 MHz,DMSO-d6)δ:12.91(1H,bs,CO2H),8.52(1H,d,J=8.4 Hz,Ar-H),7.56~7.68(4H,m,Ar-H),7.38(d,1H,J=7.6 Hz,Ar-H),7.10(1H,d,J=8.0 Hz,Ar-H),3.94(s,2H,SCH2),2.47~2.48(m,1H,环丙基-CH),1.08-1.22(m,2H,环丙基-CH2),0.81~0.88(2H,m,环丙基-CH2),上述数据与文献报道[9, 12, 15]基本一致。
2.9 2-((5-溴-4-(4-环丙基萘-1-基)-4H-1,2,4-三唑-3-基)硫)乙酸钠(lesinurad)的合成一只250 mL的圆底烧瓶中,加入化合物10(6.06 g,15 mmol)和30 mL甲醇,室温下搅拌,加入NaOH(0.60 g,15 mmol)的水溶液2 mL,室温下搅拌1 min,然后在旋转蒸发仪蒸干,残余物真空干燥得浅黄色无定型固体,即为lesinurad粗品,约6.39 g,收率100%。取6.00 g上述固体加入24 mL醋酸乙酯中,室温下搅拌,再加入1.926 mL水,所得到的两相混合物在室温下继续搅36 h,得到浅黄色浆状物。抽滤收集固体,滤饼在室温下真空干燥24 h,得到lesinurad的纯品,浅黄色固体5.31 g,收率83%,质量分数为99.17%。分子式为C17H14BrN3NaO2S,ESI-HR-MS m/z:425.987 9 [M(79Br)+H]+、427.986 0 [M(81Br)+H]+。IR vmaxKBr(cm−1):3 445,3 080,3 005,1 598,1 513,1 469。1H-NMR(400 MHz,DMSO-d6)δ:8.56(1H,d,J=8.4 Hz,Ar-H),7.72(1H,t,J=7.4 Hz,Ar-H),7.63(1H,t,J=7.4 Hz,Ar-H),7.58(1H,d,J=7.6 Hz,Ar-H),7.42(1H,d,J=7.6 Hz,Ar-H),7.11(1H,d,J=8.4 Hz,Ar-H),3.69(1H,d,J=14.4 Hz,SCH),3.64(1H,d,J=14.4 Hz,SCH),2.51~2.55(1H,m,环丙基-CH),1.11~1.16(2H,m,环丙基-CH2),0.84~0.88(2H,m,环丙基-CH2)。13C-NMR(CD3OD,100 MHz)δ:173.90,157.71,145.06,135.53,132.44,130.57,129.04,128.33,128.24,127.86,126.35,123.95,122.92,38.99,14.16,7.71,7.64。
该合成工艺的总收率为18.2%。
3 讨论1-溴萘和环丙基溴化镁在Ni(dppp)Cl2催化下发生Kumada交叉偶合,生成化合物1。化合物1在醋酸中室温下用浓硝酸硝化,得到硝基化合物2。化合物2在回流的含水THF中在NH4Cl存在下用锌粉还原,得到对应的氨基化合物3。
对其他的常用于芳基族硝基化物还原为芳胺的试剂及反应条件进行了筛选,见表 1。还原剂为铁粉时,反应体系中容易生成铁泥,后处理不方便;使用Na2S还原时,反应很难完全进行,24 h后仍有不少原料剩余;还原剂为SnCl2时,反应比较顺利,但是后处理时容易生成悬浊液而难以分层;尝试按照文献方法使用Pd/C催化氢化还原时,发现反应速度较慢,副产物较多[14];改用催化活性更高的Pd(OH)2做催化剂进行催化氢化还原时,反应进行迅速(2~4 h),但总伴随比例不同的因环丙烷开环导致的副产物11,见图 3,该副产物的比例有时可高达20%~60%,因此该方法最终被放弃,锌为还原剂时,反应10 h即可反应完全,且后处理简单,收率较高,所以本课题组采用该方法。
| 表 1 化合物2还原为化合物3的方法 Table 1 Methods of reducing compound 2 to compound 3 |
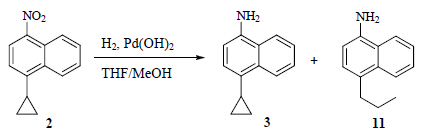 | 图 3 副产物11的生成Fig. 3 Formation of byproduct 11 |
化合物3在DIPEA的存在下使用硫光气处理,得到萘基异硫氰酸酯4。异硫氰酸酯4在Na2CO3存在下,在乙醇/水中与S-苄基化的氨基硫脲5反应,得到化合物6[17];化合物6在乙醇中加热脱去苄硫醇而环化得到化合物7,见图 4中方法A。实际上,化合物6稳定性较差,即使在分离后经过室温干燥,也发现有部分已经自动环化生成化合物7,因此很难分离得到化合物6的纯品。文献报道了由化合物4合成化合物7时,首先是使用氨基胍与化合物4反应得到中间体12,该中间体在NaOH溶液中加热脱氨环化得到化合物7[14],见图 4中方法B。方法B的收率为49%,即使经过了条件优化[18, 19],在实验中实际得到的收率只有23%;而本课题组改进的方法A的收率为74%,远高于方法B的收率。方法B的收率较低可能与其环化时使用的反应条件过于剧烈(3 mol/L NaOH中50 ℃反应60 h[14],或在回流状态下反应15~30 min[18, 19])有关。
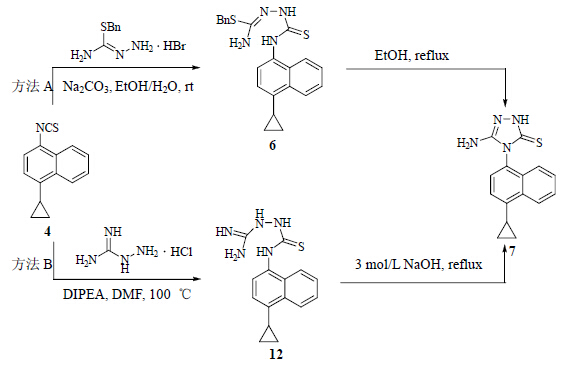 | 图 4 化合物4合成中间体7的路线Fig. 4 Synthetic routes of intermediate 7 from compound 4 |
化合物7在DMF中K2CO3存在下与溴乙酸甲酯在室温下反应,顺利得到硫代乙酸甲酯8。化合物8在溴仿中在相转移催化剂苄基三乙基溴化铵催化下使用二氯乙酸和亚硝酸钠溴化,经过重氮盐中间体(类似Sandmeyer反应),最终生成溴代三氮唑9。化合物9在室温下甲醇中用LiOH水解,然后酸化,得到lesinurad的羧酸形式10。化合物10在MeOH中与等当量的NaOH成盐,蒸干溶剂后得到lesinurad钠盐的粗品;该粗品在含水的醋酸乙酯中室温下搅拌得到lesinurad的水合物形式[14],经过高真空室温干燥后,完全脱水,最终得到lesinurad的钠盐的纯品,其结构经IR、HR-MS和核磁确证。
| [1] | Punzi L, Scanu A, Ramonda R, et al. Gout as autoinflammatory disease: new mechanisms for more appropriated treatment targets [J]. Autoimmun Rev, 2012, 12(1): 66-71. |
| [2] | Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels [J]. Nature, 2002, 417(6887): 447-452. |
| [3] | Burns C M, Wortmann R L. Gout therapeutics: new drugs for an old disease [J]. Lancet, 2011, 377(9760): 165-177. |
| [4] | Singh J A. Emerging therapies for gout [J]. Expert Opin Emerging Drugs, 2012, 17(4): 511-518. |
| [5] | 耿艳艳, 于 冰, 徐为人, 等. 新型痛风治疗药物lesinuard sodium [J]. 现代药物与临床, 2014, 29(6): 685-689. |
| [6] | Moyle G, Boffito M, Stoehr A, et al. Phase 2a randomized controlled trial of short-term activity, safety, and pharmacokinetics of a novel nonnucleoside reverse transcriptase inhibitor, RDEA806, in HIV-1-positive, antiretroviral-nave subjects [J]. Antimicrob Agents Chemther, 2010, 54(8): 3170-3178. |
| [7] | Usach I, Melis V, Peris J E. Non-nucleoside reverse transcriptase inhibitors: a review on pharmacokinetics, pharmacodynamics, safety and tolerability [J]. J Int AIDS Soc, 2013, 16(1): 1-14. |
| [8] | Girardet J L, KOH Y H, De La R M, et al. S-triazolyl α-mercaptoacetanilides as inhibitors of HIV reverse transcriptase [P]. WO: 2006026356, 2006-03-09. |
| [9] | Quart B D, Girardet J L, Gunic E, et al. Novel compounds and compositions and methods of use [P]. WO: 2009070740, 2009-06-04. |
| [10] | Zamansky I, Galvin G, Girardet J L. Polymorphic, crystalline and mesophase forms of sodium 2-(5-bromo- 4-(4-cyclopropylnaphthalen-1-yl)-4H-1,2,4-triazol-3-ylthio) acetate, and uses thereof [P]. WO: 2011085009, 2011-07-14. |
| [11] | Hirano A, Kondo K. Compositions comprising 4-(2-(5- bromo-4-(1-cyclopropylnaphthalen-4-yl)-4H-1,2,4-triazol- 3-ylthio)acetamido)-3-chlorobenzoic aci and pharmaceutically acceptable salts thereof, and methods for preparing and using same [P]. US: 20110244049, 2011-08-06. |
| [12] | Galvin G, Treiber L R, Zamansky I, et al. Polymorphic forms of sodium 2-(5-bromo-4-(4-cyclopropylnaphthalen-1- yl)-4H-1,2,4-triazol-3-ylthio)acetic acid and uses thereof [P]. US: 20120172405, 2012-07-05. |
| [13] | Treiber L R, Zamansky I, Girardet J L. Polymorphic forms of 2-(5-bromo-4-(4-cyclopropylnaphthalen-1-yl)-4H-1,2,4- triazol-3-ylthio)acetic acid and uses thereof [P]. US: 20130331403, 2013-12-12. |
| [14] | Zamansky I, Galvin G, Girardet J L. Polymorphic, crystalline and mesophase forms of sodium 2-(5-bromo- 4-(4-cyclopropylnaphthalen-1-yl)-4H-1,2,4-triazol-3-ylthio) acetate, and uses thereof [P]. US: 20130345271, 2013- 12-26. |
| [15] | Gunic E, Galvin G. Manufacture of 2-(5-bromo-4-(4- cyclopropylnaphthalen-1-yl)-4H-1,2,4-triazol-3-ylthio)acetic acid [P]. WO: 2014008295, 2014-01-09. |
| [16] | Molander G A, Beaumard F, Niethamer T K. Cross- coupling of mesylated phenol derivatives with potassium cyclopropyltrifluoroborate [J]. J Org Chem, 2011, 76(19): 8126-8130. |
| [17] | Indukumari P V, Joshua C P, Rajan V P. Oxidation & eliminative cyclisation of S-alkylisodithioureas [J]. Indian J Chem, 1981, 20B(5): 384-387. |
| [18] | Godfrey L E A, Kurzer F. Heterocyclic compounds from urea derivatives. Part II. Synthesis and cyclisation of 4-substituted 1-amidino-semicarbaxides and thiosemi- carbaxides [J]. J Chem Soc, 1961: 5137-5147. |
| [19] | Kurzer F, Canelle J. Cyclization of 4-substituted 1-amidinothiosemicarbazides to 1,2,4-triazole and 1,3,4- thiadizaole derivatives [J]. Tetrahedron, 1963, 19(11): 1603-1610. |
 2015, Vol. 30
2015, Vol. 30


