复方氨基酸注射液(18AA)为国家基本药物,也是国家药品质量评价抽验品种。该品种最早由广州侨光制药厂于20世纪90年代初研制,采用日本进口氨基酸原料,以异亮氨酸等18种氨基酸与山梨醇配制而成的灭菌水溶液,在临床上用于低蛋白血症、改善手术后患者的营养状况等。目前该品种在我国均采用国内生产的氨基酸原料生产该制剂。笔者共完成161批复方氨基酸注射液(18AA)的检验,将检验结果进行统计分析,并结合探索性研究结果对现行质量标准及国产复方氨基酸注射液(18AA)的质量现状作出评价,为今后对复方氨基酸注射液(18AA)的监督管理提供参考,同时也希望通过对评价结果的信息反馈,使各生产企业加强对产品质量的控制。 1 仪器与试药
岛津LC—AHT高效液相色谱仪,LC-Solution色谱工作站;岛津UV—2450紫外-可见分光光度计;YB—2澄明度测定仪;GWJ—8微粒检测仪;Satorius PB—10型pH计;Wellreader SK601酶标仪(日本生化学工业株式会社)。
氨基酸对照品由中国食品药品检定研究院提供,复方氨基酸注射液(18AA)161批样品均为天津市药品检验所收到的国家评价抽验样品。亚硫酸氢钠为分析纯,乙二胺四乙酸二钠、碱性品红、甲醛均为化学纯。
L-929细胞购自中国科学院上海细胞学研究所;RPMI1640培养基,批号1333032,Gibcorl公司;胎牛血清,批号20090911,兰州民海生物工程有限公司;0.25%胰酶液,TBD生物技术发展中心;MTT,批号M2128,Sigma公司; DMSO,分析纯,天津康德科技有限公司。 2 方法与结果 2.1 抽样统计
目前国内共有101家生产企业生产复方氨基酸注射液(18AA),共有201个批准文号。本次抽验样品自药品生产、销售、流通领域(医院药房、社区卫生中心及乡镇卫生院)抽取样品的比例分别为32.3%、53.4%、14.3%;有250 mL∶12.5 g、250 mL∶30 g、500 mL∶25 g共3种规格161批样品;涉及27个省市37家生产企业50个批准文号,分别占全国总生产厂家和批准文号数的36.6%、24.9%。 2.2 法定检验
按照卫生部药品标准二部第六册(生化药品第一分册)进行检验[1]。氨基酸测定采用异硫氰酸苯酯(PITC)-HPLC法测定。结果161批样品中有152批样品符合规定,合格率为94.4%。 2.3 不合格项分析
法定检验中,检出9批产品质量不符合标准规定。性状不合格涉及2个厂家2批样品,占不合格总数的22.2%,结果均为略显黄色的澄明液体,可能样品在运输、贮存过程中未严格按照贮存条件,使个别氨基酸被氧化引起溶液变黄。透光度不合格的涉及3个厂家4批样品,占不合格总数的44.4%,结果为透光率均低于97.0%,可能样品在运输、贮存过程中未严格按照贮存条件,使个别氨基酸被氧化。可见异物不合格的涉及3个厂家4批样品,占不合格总数的44.4%,主要为在样品中检出玻璃屑及毛屑,考虑可能与企业在注射剂生产中各工艺环节控制不严有关。氨基酸含量不合格的涉及2个厂家2批样品,占不合格总数的22.2%,其中某企业生产的1批样品的氨基酸中异亮氨酸的量为0,而缬氨酸的量高达标示量的170%,推测该企业生产管理未严格执行GMP管理生产注射剂,致使投料错误。 2.4 探索性研究 2.4.1 抗氧剂亚硫酸氢钠的测定
亚硫酸氢钠为制剂中的抗氧剂,从注射剂安全性考虑,需控制其含量。亚硫酸根在EDTA存在的酸性条件下,与甲醛和碱性品红作用,生成具有醌型结构的紫红色络合物,在556 nm波长处有最大吸收。该方法使用分析纯亚硫酸氢钠作为对照品,采用标准曲线法,测定样品中亚硫酸氢钠的含量[2,3]。本制剂处方量含亚硫酸氢钠为0.5 mg/mL(按二氧化硫计算,相当于0.3 mg/mL),经测定,统计结果见图 1。可见90.7%的抽验样品中亚硫酸氢钠的量低于处方量,是由于样品在贮存过程中亚硫酸氢钠发挥抗氧化作用所致其含量降低。有15批样品中亚硫酸氢钠含量超出处方量0.3 mg/mL(按二氧化硫计算)。经统计,超出处方标示量110%以上的共有6家企业,其中1家企业的样品检出亚硫酸氢钠含量高于处方1倍。
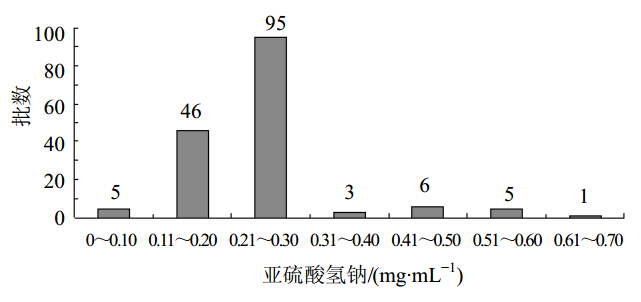 | 图 1 亚硫酸氢钠测定结果Fig. 1 Determination of sodium bisulfite |
溶液的渗透压依赖于溶液中溶质粒子的数量,是溶液的依数性之一,反映溶液中各种溶质对溶液渗透压贡献的总和。复方氨基酸注射液(18AA)为静脉输液,因含18种氨基酸原料,属于高渗溶液。实验采用直接测定法考察所有评价抽验样品的渗透压摩尔浓度范围。结果在161批样品中共有13批为含12%总氨基酸的样品,其渗透压摩尔浓度的结果在1 422~1 627 mOsmol/kg;其余148批样品为含5%总氨基酸的样品,渗透压摩尔浓度在683~870 mOsmol/kg。 2.4.3 相对密度的测定
按照《中国药典》2010年版二部附录ⅥA中第一法(比重瓶法)[4]对该评价抽验样品进行了相对密度测定。在161批样品中共有13批为含12%的总氨基酸样品,相对密度结果在1.052~1.0580;其余148批样品为含5%的总氨基酸样品,相对密度结果在1.030~1.031。 2.4.4 铝含量的测定 经文献查阅[5,6]
,肠外营养液中微量元素铝的污染与中毒是目前关注的焦点,研究结果表明铝存在于多种肠外营养液中,铝的来源主要是铝盐和玻璃容器。铝在人体内的积蓄将对人体产生危害[7]。从2004年7月起,美国FDA要求生产厂家对大多数肠外营养液中铝进行定量测定[8],大容积的注射用溶液,如葡萄糖、氨基酸、脂肪乳要求其铝含量低于25 μg/L。为了更好地控制氨基酸输液品种的安全性,本实验采用原子吸收分光光度法分别对37家企业39批样品进行了铝含量的测定。
量取复方氨基酸注射液(18AA)50 mL,置水浴蒸发至约20 mL,转移置25 mL量瓶中,用水稀释至刻度,摇匀,作为供试品溶液。另制备测定标准工作曲线用0、20、40、120 μg/L对照品溶液。分别取对照品溶液、供试品溶液,使用原子吸收光谱仪于396 nm测定[9]。结果有27批(占69.2%)的样品中铝含量大于25 μg/L,超出了FDA的要求。除了样品自身的铝盐外,也考虑有可能与玻璃瓶装质量有关。从另一方面也提示在药品和玻璃瓶相容性试验中要进行铝盐的考察[10]。 2.4.5 细菌内毒素的测定
复方氨基酸注射液(18AA)现行质量标准为热原项检查,本实验建立细菌内毒素方法考察样品的安全性。参照《中国药典》2010年版二部附录相应的方法检测[11]。按照常规的大输液品种细菌内毒素限值“应小于0.5 EU/mL”进行试验,结果显示该品种适用于细菌内毒素检查。 2.4.6 体外细胞毒性试验
按照相关判定标准,若细胞毒性反应在0~1级时,判定该产品在临床使用上具有一定的安全性。样品检测浓度的大小对细胞毒性的反应有密切影响。出现0~1级细胞毒性反应的样品浓度越高说明产品的细胞毒性反应越小。
采用L-929细胞对复方氨基酸注射液(18AA)进行了体外细胞毒性试验[12]。取复方氨基酸注射液(18AA)与10% RPMI1640培养液按1∶1逐级稀释制成最终浓度为50、25、12.5、6.2、3.12、1.56 mg/mL试验样品液。将5×104/mL细胞悬液接种于96孔板,每孔0.1 mL,在37 ℃、5% CO2条件下培养24 h后,弃去原培养液,加入试验样品液。每孔加入0.1 mL;对照组为10% FBS-RPMI1640,每组3~5个平行孔。在37 ℃、5% CO2条件下继续培养72 h。培养结束前每孔加入5 mg/mL MTT溶液20 μL,继续培养4 h后,弃去培养板孔内液体,每孔加入150 μL DMSO,置振荡器上振荡5 min,在酶标仪545、630 nm波长下测定吸光度(A)值。按相对增值率=A实验/A空白×100%计算,并按表 1标准进行反应分级确定。
| 表 1 细胞相对增值率与细胞毒性分级的关系 Table 1 Relative cell proliferation rate and cytotoxicity grade |
结果发现,在对39个生产企业共计158批样品进行的细胞毒性试验中,所有产品达到细胞毒性反应1级的浓度均在10 mg/mL(以总氨基酸浓度计)以下。但有些厂家生产的同一规格不同批次的产品出现细胞毒性反应的浓度略有差异,初步考虑在排除试验本身的系统误差外,可能为产品中某些成分的差异带来的影响。 3 讨论
按照现行标准检验,复方氨基酸注射液(18AA)评价性抽验合格率为94.4%,增加抗氧剂亚硫酸氢钠(不得过0.33 mg/mL)、相对密度(规格5%为1.031~1.036、规格12%为1.052~1.058)、铝测定(小于25 μg/L)、渗透压(规格5%为700~800 mOsmol/kg、规格12%为1 400~1 600 mOsmol/kg)项目检测后其不合格率增加至34.8%。说明现有部分市售产品存在“仅仅符合法定质量标准规定”的现象,需要有针对性的增加检验项目,以提高产品质量。
建议增加抗氧剂亚硫酸氢钠的检测,严格控制抗氧剂的含量,监督企业按照处方量投料。制订的限度指标不高于处方量的110%。
建议质量标准中,按《中国药典》2010年版要求增订渗透压摩尔浓度检查、相对密度检查,以便进一步控制样品纯度,并将热原项改为细菌内毒素检查。
建议质量标准中参照FDA的要求,增加铝含量的检测限度,要求控制在25 μg/L以下。此次评价中共对37家企业的代表性样品进行铝含量的抽查,抽查结果显示多家企业的含量超过25 μg/L。建议今后的质量标准中应增订铝盐的限度检查,同时关注玻璃瓶装材料的质量,并对样品溶液带来的铝污染。
建议修订氨基酸含量限度,统一氨基酸的测定方法。
检验标准中对样品的贮藏条件为密闭,置凉暗处保存,也就是要求样品在运输、放置过程中要避光、20 ℃以下保存,否则氨基酸氧化、变色。本次评价的样品中共发现4批样品,涉及3家生产企业透光率低于97.0%。建议生产企业、经营企业和使用单位要严格按照标准的贮藏条件放置药品,确保产品在流通使用环节安全有效。
检验标准中对样品的贮藏条件为密闭,置凉暗处保存,也就是要求样品在运输、放置过程中要避光、20 ℃以下保存,否则氨基酸氧化、变色。本次评价的样品中共发现4批样品,涉及3家生产企业透光率低于97.0%。建议生产企业、经营企业和使用单位要严格按照标准的贮藏条件放置药品,确保产品在流通使用环节安全有效。
| [1] | 卫生部药品标准二部第六册 [S]. 生化药品第一分册. 1998: 88-89. |
| [2] | 方海顺, 徐志利. 比色法测定复方氨基酸注射液中亚硫酸氢钠含量 [J]. 中国药品标准, 2007, 8(4): 40-42. |
| [3] | 隋玉荣, 王 培, 黄哲甦. 复方氨基酸注射液中抗氧剂的含量测定 [J]. 天津药学, 2009, 21(1): 6-7. |
| [4] | 中国药典 [S]. 二部. 附录39: 附录Ⅵ A相对密度测定法(比重瓶法). 2010. |
| [5] | 日本药局方 [S]. 第十五改正版. 2006. |
| [6] | 樊新星, 徐 珽, 金朝晖, 等. 肠外营养液中的铝污染[J]. 华西医学, 2008, 23(1): 203-204. |
| [7] | Hewitt C D, Savory J, Wills M R. Aspects of aluminum toxicity [J]. Clin LabMed, 1990, 10(2): 403-422. |
| [8] | Food and Drug Administration. Aluminum in large and small volume parenterals used in total parenteral nutrition-FDA. Proposed rule [J]. Fed Regist, 1998, 63(2): 176-185. |
| [9] | 韩峰超, 王晓黎, 高广慧, 等. 石墨炉原子吸收标准加入法考察复方氨基酸注射液(18)中铝元素含量 [J].实用药物与临床, 2010, 13(5): 346-347. |
| [10] | 国家食品药品监督管理局. 国家食品药品监督管理局办公室关于加强药用玻璃包装注射剂药品监督管理的通知 [EB/OL]. (2012-11-08). [2014-06-20]. http://www.sda. gov.cn/WS01/CL0844/76088.html. |
| [11] | 中国药典 [S]. 二部. 附录99: 附录XI E细菌内毒素检查法. 2010.吴海燕, 陈 颖. 羧甲基魔芋葡甘露聚糖对L929细胞体外毒性的研究 [J]. 食品科学, 2008, 29(7): 416-419. |
 2014, Vol. 29
2014, Vol. 29


