2. 福建医科大学药学院 天然药物学系, 福建 福州 350108;
3. 北京联馨药业有限公司, 北京 102600
2. Natural Medicine Department of Fujian Medical University School of Medicine, Fuzhou 350108, China;
3. Beijing Lianxin Pharmaceutical Co., Ltd., Beijing 102600, China
红花为菊科植物红花Carthamus tinctorius L.的干燥花,夏季花由黄变红时采摘,阴干或晒干[1]。红花味辛,性温,归心、肝经,有活血通经、散瘀止痛的功能,用于闭经、痛经、恶露不行、症瘕痞块、跌打损伤、疮疡肿毒[2]。红花又名红蓝花(《金匮要略》)、黄蓝(《博物志》)、刺红花(《四川中药志》)、草红花(《陕西中药志》)[3],始载于《开宝本草》,《神农本草经》中列为中品。
红花易栽培,喜温暖气候,适应力较强,耐旱、耐盐碱、忌涝,主产于新疆、河南,另外四川、云南、安徽、江苏和浙江等省少量有产。自20世纪80年代起,新疆红花产量较大,高达80%;河南自张骞出使西域以来一直作为最悠久的道地产区,品种培育和产量位于新疆之后。新疆红花主产区主要有3个地区:塔城地区、伊犁地区和昌吉州地区,新疆每年总种植面积约4万公顷左右,其中塔城地区种植最大,约占60%~70%,种植面积达2.5万公顷,主要分布在3个县:裕民县、额敏县和托里县;其次为伊犁地区,种植面积1.3万多公顷;最后为昌吉地区,约6千多公顷。河南主要产区为新乡市卫辉县和延津县以及商丘市的宁陵县和柘城县,约几千公顷。然而从未见新疆产和河南产红花药材整体对比,红花和红花籽用途广泛,可用作药物、油料、食用、天然染料、饲料、化妆品等。由于红花独特的药用和保健价值,目前国内外对红花的需求量日益增加,因此控制红花药材的内在质量[4]已成为当务之急。
近年来,液相指纹图谱技术已经广泛应用于中药材鉴别和质量评价研究,取得较好的效果[5-8]。美国FDA近些年制定的植物草药指南中已经明确把指纹图谱作为这类混合物质群的质量控制方法。同样欧洲也将色谱指纹图谱作为植物药制剂的评价方法。已有报道红花药材HPLC指纹图谱,但信息量不大,分析时间过长,未能较为全面表征红花药材成分。因此本实验建立了红花药材UPLC指纹图谱分析方法,具有更高的分离速度、精确度与灵敏度,为高效、快速地评价红花药材的质量提供参考。本实验对新疆产30批、河南产4批不同产地的红花质量进行了对比。对30批新疆不同产地不同品种的红花进行了UPLC指纹图谱的对比研究,在数据化处理的基础上,结合相似度评价的方法,进行药材质量分析和评价,以期能更为全面地控制红花药材的质量。旨在为评价新疆和河南2个最主要产区红花的质量提供科学依据,为筛选出优良品种和红花产地奠定基础。
1 仪器与材料Waters Acquity UPLC超高效液相色谱系统,配有四元超高压溶剂系统、自动进样恒温样本管理器、柱温箱、PDA检测器、Empover色谱工作站;1/10万电子分析天平(BT224S型,德国赛多利斯科学仪器公司);中药粉碎机(DFT-50型,温岭市林大机械有限公司)。
乙腈为色谱纯;磷酸等试剂为分析纯;屈臣氏蒸馏水;0.22 μm微孔滤膜(津腾公司);羟基红花黄色素(批号111637-201308)。
红花药材于2015年6~8月采于新疆和河南原产地,经北京中医药大学林瑞超教授鉴定为菊科植物红花Carthamus tinctorius L.的干燥花,采收后就地阴干2~4 d至恒定质量,密封保存,临用前过60目筛,红花样品信息见表 1。
|
|
表 1 药材来源 Table 1 Sources of materials tested |
2 方法 2.1 色谱条件
Waters Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);流动相为0.5%磷酸溶液(A)-乙腈(B),梯度洗脱,0~2 min,5%~10% B;2~10 min,10%~20% B;10~16 min,20%~40% B;16~20 min,40%~5% B;检测波长275 nm;体积流量0.2 mL/min;柱温30 ℃;进样量2 μL。
2.2 对照品溶液制备称取适量羟基红花黄色素A对照品置量瓶中,加蒸馏水制成质量浓度为0.50 mg/mL的溶液,0.22 μm微孔滤膜滤过即得。
2.3 供试品溶液制备取干燥的红花药材,粉碎后过3号筛,精密称定样品粉末2.0 g,置平底烧瓶中,加蒸馏水水50 mL,称定质量,90 ℃水浴中提取1 h,称定质量,补足减失质量,滤过,量取续滤液10 mL,微孔滤膜滤过,即得。
2.4 方法学考察 2.4.1 精密度试验取S1号样品制备的供试品溶液连续进样6次,按“2.1”项色谱条件检测指纹图谱。以羟基红花黄色素A为参比峰,考察各共有峰的相对保留时间和相对峰面积的一致性,结果表明各共有峰的相对保留时间和相对峰面积的RSD均<2%,表明仪器精密度良好,符合指纹图谱的检测要求。
2.4.2 重复性试验取S1号红花样品6份,按供试品溶液的制备方法制备供试品溶液,按“2.1”项色谱条件检测,以羟基红花黄色素A的色谱峰为参比峰,计算各共有峰的相对保留时间和相对峰面积,结果表明,各共有峰的相对保留时间和相对峰面积的RSD均<3%,表明该方法具有较好的重复性。
2.4.3 稳定性试验取S1号红花样品制备的供试品溶液,分别于0、4、8、12、16、24 h进样检测指纹图谱,以羟基红花黄色素A的色谱峰为参比峰,计算共有峰的相对保留时间和相对峰面积,结果表明,各共有峰的相对保留时间和相对峰面积的RSD均在2%以下,表明样品溶液在24 h内稳定,符合指纹图谱检测要求。
2.5 样品的测定将34批红花样品按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定UPLC图。
2.6 数据处理采用国家药典委员会《中药指纹图谱相似度评价系统2012.1版本》软件进行处理。S12号样品色谱图中色谱峰形好、分离度良好,基线平整,故选择其为参照指纹图谱。为减小极端数据的影响,选择中位数法作为对照指纹图谱生成方法,时间窗宽度设为0.1,运用多点校正方法对色谱峰进行全谱峰匹配,并计算红花样品和红花对照图谱的相似度。应用SAS 9.30统计软件对新疆各产地指纹图谱数据进行聚类分析和主成分分析,用于实现红花UPLC指纹图谱差异的模式识别。
3 结果与分析 3.1 新疆和河南产红花UPLC图谱质量控制研究 3.1.1 新疆和河南红花质量评价笔者采集新疆原产地样品30份,覆盖全新疆80%以上红花资源,采集河南原产地样品4份,覆盖全河南80%以上红花资源,34批样品全谱峰匹配见图 1-A,并生成30批新疆产(图 1-B)和4批河南产(图 1-C)红花样本的对照图谱,4批河南产红花的UPLC图谱与河南产红花对照图谱及新疆红花对照图谱的相似度结果见表 2。4批河南产红花样本与河南红花对照图谱相似度均大于0.950,可为河南产红花药材的质量评价研究提供参考。4批河南产红花样品和新疆对照图谱相似性较低,均小于0.790,亦说明河南红花和新疆红花UPLC指纹图谱存在着较大的差异。对所建立的新疆和河南的对照图谱进行分析比较,以河南产红花对照图谱为标记见图 1-C,a、b峰在新疆样品中均未检测到,c、e峰明显小于新疆样品,d峰在河南产样品中此色谱条件下分离更好。以峰面积标示量,通过纵坐标响应值和积分面积观察河南和新疆产的差异主要在于各峰峰面积,可用于鉴别新疆和河南产红花药材。
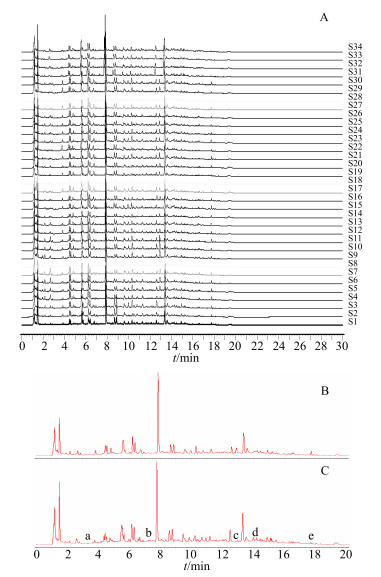
|
图 1 34批新疆和河南产药材色谱峰匹配图 (A)、新疆30批对照图谱 (B) 和河南4批对照图谱 (C) Fig.1 UPLC match chromatograms of 34 batches of C. tinctorrius (A) and UPLC contrast chromatograms of 30 batches from Xinjiang (B) and four batches from Henan (C) |
|
|
表 2 河南红花各样品与新疆和河南对照图谱的相似度结果 Table 2 Results of similarity evaluation ofC. tinctorrius from Henan with two common UPLC fingerprints |
3.1.2 新疆不同产地不同品种红花特征峰
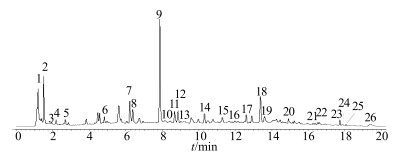
选取30批样品UPLC图谱中共有的、稳定性好、在红花对照图谱中峰面积大于总色谱峰面积的1%且分离度较好的峰作为特征峰,共26个(图 2)。其中9号峰为羟基红花黄色素A,保留时间适中、分离效果较好且峰面积最大,因此选9号峰为参比峰。
|
9-羟基红花黄色素A 9-hydroxysafflor yellow A 图 2 新疆产红花药材的共有模式图 Fig.2 Total pattern diagram of C. tinctorrius from Xinjiang |
3.1.3 新疆红花特征峰相对保留时间及相对峰面积
从30批红花样品的指纹图谱中共得到26个共有峰,见图 2,通过与对照品色谱图中的保留时间比对,初步可指认1个共有峰,其中羟基红花黄色素A(9号峰)分离度好,峰位居中、峰面积最大,又是红花中主要药理活性成分,故以其为参照峰,计算其余各共有峰的相对保留时间RSD值均小于1.36%,表明方法的重复性较好。相对峰面积RSD在0~158.57%,相对峰面积差异较大,表明各样品间差异较大。
3.1.4 新疆不同产地、不同品种红花指纹图谱相似度评价30批新疆红花药材的UPLC图谱相似度结果见表 3。30批新疆红花药材与对照指纹图谱的相似度在0.895~0.947,相似性较好,除S21、S22、S28外,其余各产地的相似度均大于0.900,基本符合中国药典中药质量标准研究制定技术要求,可作为新疆产红花的标准图谱。S21、S22、S28所用红花药材的产地分别为新疆塔城地区额敏县一六六团一连云南矮大头、新疆塔城地区托里县多拉特乡云南大头、新疆伊犁地区霍城县芦草沟乡云南大头。表明3个产地的红花较新疆其他产地的红花在质量上具有一定的差异性。其中,S2、S4、S6~S9、S11~S14、S16、S20、S23~S24与对照指纹图谱的相似度均大于0.930,相似度较好,质量较为均匀。
|
|
表 3 新疆红花药材指纹图谱相似度评价 Table 3 Fingerprint similarity of C. tinctorrius |
3.2 UPLC图谱品种识别研究 3.2.1 聚类分析
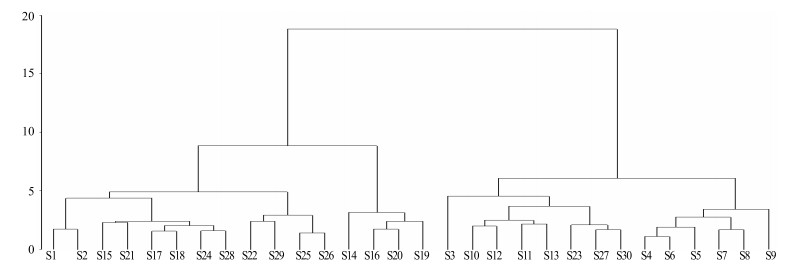
将新疆30份样品26个特征峰峰面积导入SAS 9.30软件,形成26×30阶数据矩阵,采用欧氏距离法类平均法作为样品聚类依据。聚类分析结果见图 3。
|
图 3 聚类分析结果 Fig.3 Results of hierarchical cluster analysis |
当判别条件距离为15时,30批红花样品被分为2大类:一类包含S3~S13、S23、S27、S30,即新疆昌吉地区加塔城和伊犁2个产地红花被聚到一类,另一类包含S1、S2、S14~S22、S24~26、S28、S 29,即大部分塔城地区和伊犁地区红花被聚为一类。S12、S13、S23、S27、S30未与其所属聚为一类,表明即使是同一产地所产红花药材,质量也不尽相同,和指纹图谱相似度结果相似。
3.2.2 主成分分析用Matlab软件对各共有峰峰面积进行标准化处理后,对30批红花样品指纹图谱所得的26个共有峰进行主成分分析,求出相关矩阵的特征值及其方差,见表 4。前3个因子的累积方差贡献率达到74.17%,大于70%。样本间内在的相互关系可较好地表现出来,进而实现样本之间的分类。可代替红花指纹图谱26个共有峰的大部分信息,故选取第1、2、3个因子分别作为主成分1、2和3。
|
|
表 4 主成分特征值及方差 Table 4 Eigen value and total variance of principal component |
主成分载荷矩阵反映了各变量对主成分的贡献大小和方向。由表 5可见,26个变量对主成分1的正负相关,其中以共有峰5、13和3对其的贡献最大,且共有峰13和3与主成分1呈负相关;共有峰5、9和12对主成分2贡献最大;共有峰17、7和14对主成分3的贡献最大,且共有峰14与主成分3呈负相关。
|
|
表 5 主成分载荷矩阵 Table 5 Component matrix |
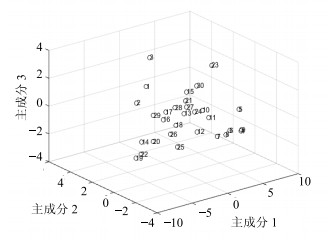
对上述主成分载荷值进行计算,得出各主成分的线性模型,将各样本数据带入模型,得到各批次样本的主成分得分,见表 6;并以样品的第1、2、3主成分得分做三维散点图,见图 4。
|
图 4 主成分得分图 Fig.4 PCA score figure |
|
|
表 6 样本主成分得分 Table 6 PCA score of samples |
图 4中30批新疆样品整体分布较近,说明质量差异不大。其中样品S4~S9、S10~S13分布较近,说明昌吉州地区和部分塔城地区红花质量较为接近;S1~S3样品分布较近,说明乌鲁木齐市产红花药材质量接近;而S23批产地为塔城托里县宾红三号样品分布位置较为独立。
4 讨论 4.1 实验条件的优化本实验对供试品溶液制备中提取溶剂、提取方法、提取时间、提取液料比均进行了考察。结果显示样品90 ℃水浴回流1 h,指纹图谱信息量最大化,峰数较多、峰形较好。
本实验比较了乙腈-水、乙腈-0.1%磷酸、乙腈-0.2%甲酸、乙腈-0.2%磷酸、乙腈-0.3%磷酸及乙腈-0.5%磷酸6种不同的流动相,结果表明流动相乙腈-0.5%磷酸时检测出的色谱峰最多,分离度最佳及峰对称性最好,最终确定了洗脱条件。分析了200~400 nm全波长扫描的图谱,发现275 nm条件下的色谱峰较多且峰形较好,故选择275 nm作为测定波长。考察了25、30、35、40 ℃时柱温对色谱峰分离度的影响,结果在30 ℃柱温条件下,分离效果较好。
羟基红花黄色素A在红花中质量分数最高,是红花中主要有效成分,因此选择羟基红花黄色素A为红花药材指纹图谱的参照峰。红花和红花注射制剂的质量标准,一般是以羟基红花黄色素A的量为指标评价药材和制剂的质量,但仅以羟基红花黄色素A作为指标不能客观地反映药材全貌。
UPLC采用1.7 μm的超细色谱柱填料,从而大大提高柱效,具有高效、快速、灵敏的特点,提高分析效率,同时减少流动相消耗,色谱峰易于匹配。本实验结果显示,UPLC法可标示出26个共有峰,且UPLC色谱方法的分离效果更好、灵敏度更高,使红花药材中的物质在20 min内分离成为可能,为快速评价红花药材的质量,建立红花药材的UPLC特征指纹图谱分析方法,完善红花的质量控制方法提供依据。
4.2 红花识别方法的比较本实验在建立新疆产红花和河南产红花UPLC对照图谱的基础上,比较了各样本的相似性。此方法较好地反映了新疆和河南红花UPLC指纹图谱的差异性。在此基础上,应用聚类分析和主成分分析2种计量学方法对区分新疆红花不同品种展开了进一步研究,将UPLC指纹图谱相似度评价与基于UPLC指纹图谱的数学识别模式结合起来使用,可以相互补充和印证。实验结果也表明红花不同品种的化学成分存在一定的差异,分析与红花原药材本身内在质量存在很大差异有关,以及红花药材在加工、贮藏方法不一致有关。河南和新疆产的红花差异较大,是由于新疆和河南种植品种不同,并且主要由于2个产地地理位置相差较远,气候特点、生长环境、栽培技术等各方面差别较大所致,河南和新疆红花化学成分具有一定地域性,以往研究仅以羟基红花黄色素A和山柰素量作为评价指标,具有一定局限性。可以考虑在红花相关制剂生产中,固定产地来源及药材品种等,本研究建立的鉴别方法可为完善红花药材原材料及其制剂的行业标准提供实验依据,进一步为红花的临床合理用药提供参考。对未知样品进行鉴别评价时,只需按照本实验的色谱方法测定样品,然后比较共有峰的相对保留时间和相对峰面积,值相近者则为该产区的红花药材,该方法简单、快速。鉴于目前实验收集的样本数还相对较少,每个产品量不均衡,后续实验要进一步增加样本量,不断修正红花特征图谱;对于红花指纹图谱中共有峰的定性,还需要借助液质联用、核磁共振等手段进行进一步确认。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 肖培根. 新编中药志[M]. 北京: 化学工业出版社, 2002. |
| [3] | 曹学勤. 红花与藏红花[J]. 内蒙古中医药, 2009, 23:46–47. |
| [4] | Guidance for industry. Botanical drug products[M]. Draft Guidance: CDER/FDA, 2000. |
| [5] | 刘素香, 白雪, 刘毅, 等. 马鞭草HPLC指纹图谱建立及指标性成分的测定[J]. 中草药, 2016, 47(12):2069–2073. |
| [6] | 钟可, 王文全, 靳凤云, 等. 知母的HPLC-ELSD指纹图谱研究[J]. 中草药, 2016, 47(15):2747–2750. |
| [7] | 田妍妍, 周桂荣, 霍志鹏, 等. UPLC法测定羊耳菊中7种成分及其指纹图谱研究[J]. 中草药, 2016, 47(13):2353–2359. |
| [8] | 姚建标, 金辉辉, 何厚洪, 等. 西红花特征图谱研究及真伪鉴别[J]. 中草药, 2015, 46(9):1378–1380. |
 2017, Vol. 48
2017, Vol. 48


