2. 江苏省中医药研究院, 中药组分与微生态研究中心, 江苏 南京 210028
2. Jiangsu Provincial Academy of Traditional Chinese Medicine, Multi-component of Traditional Chinese Medicine and Microecology Research Center, Nanjing 210028, China
浮萍为水面浮生植物,在全国各地分布广泛,资源丰富,为浮萍科植物紫萍Spirodela polyrriza (L.) Schleid.的干燥全草,作为传统中药收载于《中国药典》2015年版一部。浮萍性辛,寒,归肺经,有宣散风热、透疹、利尿的功效。临床上主要用于治疗风湿麻痹、水肿、风热隐疹、吐血和口舌生疮[1-2]等。近年来,对浮萍的研究主要集中在其对污染水质中氮、磷的吸收净化能力[3],所含化学成分的分离鉴定[4],及其多糖的提取、分离[5]等方面,而关于浮萍化学成分测定的研究报道较少,且《中国药典》2015年版对浮萍的质量控制也没有规定定量指标。文献报道浮萍中含有荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素等黄酮类成分[6],这些黄酮类化合物具有抗氧化、抗炎、抗肿瘤、治疗心脑血管疾病等广泛的生物活性[7-8]。为更好地控制浮萍的质量,本实验建立了HPLC测定浮萍中5种黄酮类成分的方法,并对浮萍的抗氧化活性进行测定;采用聚类分析和主成分分析对不同产地不同批次的浮萍药材进行了分析,为浮萍的质量控制与进一步研究和开发利用提供了参考。
1 仪器与材料Agilent 1260高效液相色谱仪(美国安捷伦公司);UV 1800 PC紫外可见分光光度计(上海凤凰光学科仪有限公司);FA2104万分之一分析电子天平(上海良平仪器仪表有限公司);AT201十万分之一电子天平(METTLER TOLEDO);TG16W台式高速离心机(长沙湘智离心机仪器有限公司)。
浮萍药材均购于安徽亳州药材有限公司,经江苏省中医药研究院钱士辉教授鉴定为浮萍科植物紫萍Spirodela polyrriza (L.) Schleid.的干燥全草,产地河南3个批次分别命名为河南1(批号20160529)、河南2(批号20160707)、河南3(批号160401);产地江苏3个批次分别命名为江苏1(批号20160529)、江苏2(批号20160707)、江苏3(批号160320);产地陕西、山西、河北、山东和安徽各两个批次分别命名为陕西1(批号20160529)和陕西2(批号20160707)、山西1(批号20160529)和山西2(批号20160707)、河北1(批号20160529)和河北2(批号20160707)、山东1(批号20160529)和山东2(批号20160707)、安徽1(批号20160201)和安徽2(批号160521);产地湖北命名为湖北(批号160420);对照品荭草素(质量分数≥98%,批号28608-75-5)、牡荆素(质量分数≥98%,批号3681-93-4)、木犀草苷(质量分数≥98%,批号5373-11-5)、大波斯菊苷(质量分数≥98%,批号578-74-5)、木犀草素(质量分数≥98%,批号491-70-3)均购自中国科学院成都生物研究所(供测定用),1, 1-二苯基-2-苦基肼(DPPH,源叶生物),乙腈为色谱纯,水为超净水,其他试剂均为分析纯。
2 方法与结果 2.1 HPLC测定方法的建立 2.1.1 色谱条件Zorbax SB-C18色谱柱(250 mm×4. 6 mm,5 μm);流动相为乙腈-0.1%甲酸水系统,梯度洗脱:0~10 min,18%乙腈;10~16 min,18%~30%乙腈;16~24 min,30%~44%乙腈;检测波长340 nm;体积流量1.0 mL/min;柱温30 ℃,进样量10 μL。
2.1.2 对照品溶液的配制精密称取105 ℃条件下干燥至恒定质量的对照品荭草素3.96 mg、牡荆素3.30 mg、木犀草苷3.22 mg、大波斯菊苷1.60 mg、木犀草素2.04 mg,精密称定。荭草素、牡荆素、木犀草苷和大波斯菊苷对照品直接加入10 mL量瓶;木犀草素对照品置于4 mL容量瓶,用甲醇完全溶解并定容,摇匀,取0.5 mL加入上述10 mL量瓶中,用甲醇完全溶解并定容,摇匀即得含荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素质量浓度分别为0.396、0.330、0.322、0.160、0.026 mg/mL的混合对照品溶液。
2.1.3 供试品溶液的配制取浮萍(干燥、粉碎、过60目筛)0.2 g,精密称定,置于锥形瓶中,加入50 mL甲醇,摇匀,称定质量,超声(功率250 W,频率45 kHz)30 min,放冷后,用甲醇补足损失的质量;滤过,备用。
2.1.4 测定方法分别精密吸取上述对照品溶液与供试品溶液,按“2.1.1”项下的HPLC色谱方法进样测定。HPLC色谱图见图 1。
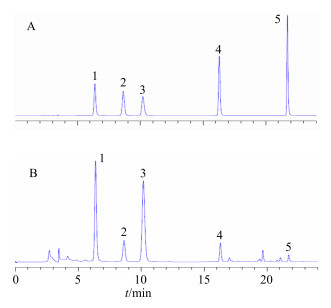
|
1-荭草素2-牡荆素3-木犀草苷4-大波斯菊苷5-木犀草素 1-orientin 2-vitexin 3-cynaroside 4-apigenin-7-glucoside 5-luteolin 图 1 混合对照品 (A) 和供试品 (B) 溶液的HPLC色谱图 Fig.1 HPLC of mixed reference (A) and test (B) solution |
2.2 方法学考察 2.2.1 线性关系考察
精密量取“2.1.2”项下混合对照品溶液,用甲醇等倍稀释成不同质量浓度的混合对照品溶液,其中荭草素质量浓度分别为6.19、12.38、24.75、49.50、99.00、198.00、396.00 μg/mL;牡荆素质量浓度分别为5.16、10.31、20.63、41.25、82.50、165.00、330.00 μg/mL;木犀草苷质量浓度分别为5.03、10.06、20.13、40.25、80.50、161.00、322.00 μg/mL;大波斯菊苷质量浓度分别为2.50、5.00、10.00、20.00、40.00、80.00、160.00 μg/mL;木犀草素质量浓度分别为0.40、0.80、1.59、3.19、6.38、12.75、25.50 μg/mL,按上述HPLC色谱方法进行测定,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归分析,绘制标准曲线,结果见表 1,实验结果表明峰面积与质量浓度呈良好的线性关系。
|
|
表 1 回归方程、相关系数、线性范围 Table 1 Linear regression equations, correlation coefficients, and linear ranges |
2.2.2 精密度试验
按“2.1.1”项下的方法重复进样6次“2.1.2”项下制备的混合对照品溶液,测定和记录峰面积,计算荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素峰面积的RSD值分别为0.97%、0.89%、1.19%、0.50%、1.28%,表明仪器精密度良好。
2.2.3 稳定性试验取同一份安徽1浮萍供试品溶液,室温放置,分别测定其在0、2、4、8、12、24 h内峰面积,计算24 h内荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素峰面积的RSD值分别为1.85%、1.92%、1.93%、1.43%、1.54%,表明供试样品溶液在室温下24 h内稳定性良好。
2.2.4 重复性试验取安徽1样品共6份,精密称定,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件测定其荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素的峰面积,计算各成分的质量分数分别为0.63%、0.14%、0.65%、0.07%、0.012%,RSD值分别为1.93%、1.85%、1.65%、1.96%、1.99%,实验结果表明该方法重复性良好。
2.2.5 加样回收率试验取已测定的安徽1浮萍药材粉末约0.1 g,精密称定,共6份,精密加入混合对照品溶液适量,按“2.1.3”项下制备供试品溶液,分别进样10 μL,测定,计算回收率及RSD值,荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素回收率分别为100.6%、96.1%、99.1%、103.0%、102.1%,RSD值分别为2.54%、2.18%、1.99%、1.98%、3.25%。符合《中国药典》2015年版要求[9]。
2.3 不同产地浮萍黄酮成分的测定取不同产地的浮萍,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下方法测定5种黄酮类成分量,结果见表 2。结果表明荭草素和木犀草苷的量比较高,大波斯菊苷和木犀草素的量相对较低;其中山西、陕西产地及河北2、安徽1和湖北产浮萍中5种黄酮总量值在1.5%~2.2%,质量分数较高;河南、江苏、山东产地及河北1、安徽2产浮萍中的5种黄酮总量值在1.0%~1.5%。
|
|
表 2 不同产地浮萍中黄酮类成分的质量分数及其IC50 Table 2 Contents of flavonoids in Spirodelae Herba from different growing areas and their IC50 values |
2.4 DPPH清除率的测定
取不同产地浮萍粉末0.2 g,精密称定,置50 mL锥形瓶中,加入50 mL甲醇,摇匀,称定质量,超声(功率250 W,频率45 kHz)30 min,放冷后,用甲醇补足缺失的质量,滤过,取滤液,分别用甲醇稀释至适当倍数为供试品溶液;取DPPH 15 mg,精密称定,于250 mL棕色量瓶中,用甲醇超声溶解,定容摇匀放4 ℃冰箱备用。
设置空白对照组、对照组和3个样品组,样品组加入上述制备的DPPH溶液3.5 mL和不同体积(分别为0.9、0.8、0.7、0.6、0.5、0.4、0.2 mL)的供试品溶液,DPPH空白对照组加入相应体积的甲醇,供试品空白对照组加入3.5 mL的甲醇,30 min后在517 nm下测定各组吸光度值(A)[10-11]。计算不同产地浮萍对DPPH自由基的清除率。
DPPH清除率=1-(A样品组-A对照)/A空白对照
以清除率为50%时供试品质量浓度(IC50)为评价指标,IC50越小,表明该产地的浮萍对DPPH自由基的清除能力越强。由SPSS 21.0统计软件计算IC50值并分析其与5种黄酮类成分的相关性,各黄酮成分的量及IC50值结果见表 2。其中陕西、河北、安徽、湖北产和山西1产地浮萍IC50值在0.1~0.2 mg/mL,IC50值较低,抗氧化能力较强;河南、江苏、山东产及山西2产地浮萍IC50值在0.2~0.5 mg/mL,IC50值相对较高,抗氧化能力相对较弱。由相关性分析表明,DPPH清除率与黄酮类成分量具有显著相关性(P<0.05、0.01),浮萍中黄酮类成分量高其氧化清除率也较高,抗氧化能力较强。
2.5 聚类分析将不同产地浮萍中荭草素、牡荆素、木犀草苷、大波斯菊苷、木犀草素的量输入SPSS 21.0统计软件,采用组间均连法,以欧氏距离为指标进行聚类分析,结果如图 2所示。
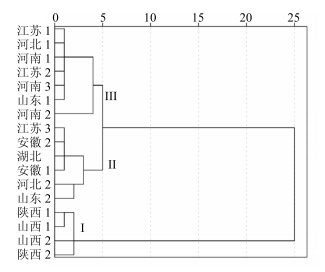
|
图 2 17批浮萍中黄酮类成分的聚类分析结果 Fig.2 Cluster analysis of flavonoids in 17 batches of Spirodelae Herba |
对17批浮萍样品5种黄酮类成分量进行聚类分析,结果显示上述样品可分为3类:Ⅰ类包含山西和陕西两个产地,共计4个批次,其荭草素、牡荆素、木犀草苷的量均较其他产地明显偏高;Ⅱ类包含湖北、安徽、江苏3、河北2、山东2共计6个批次,荭草素、牡荆素、木犀草苷的量较Ⅰ类次之;Ⅲ类包含河南、江苏、河北1、山东1共计7个批次,荭草素、牡荆素、木犀草苷的量均较其他产地偏低,即各产地浮萍5种黄酮类成分量:Ⅰ类>Ⅱ类>Ⅲ类。
2.6 主成分分析通过SPSS 21.0统计软件中的因子分析对不同产地浮萍中5个黄酮类成分量进行处理,主成分分析解释的总方差见表 3。软件默认特征值大于1的成分作为主成分,由表 3知,只有第1个成分的初始特征值大于1,即3.824,但第1个成分对总方差的累积贡献率只有76.477%,偏小,若提取前2个成分,累积贡献率可达到89.022%>85%,表明前两个主成分已基本包含了浮萍黄酮类成分的全部信息,可用前2个主成分对其进行综合评价。主成分1的特征值为3.824,方差贡献率为76.477%,主成分2的特征值为0.627,方差贡献率为12.545%,2个主成分的累积方差贡献率为89.022%,满足主成分分析要求。因子得分、主成分得分、综合得分及排名如表 4所示。
|
|
表 3 主成分分析解释的总方差 Table 3 Principal component analysis of total variance explained |
|
|
表 4 2个主成分的因子得分、主成分得分、综合得分及排名 Table 4 Factor scores, principal component scores, total scores, and ranking of two principal components |
3 讨论
药材质量的优劣直接影响其疗效的发挥,因此建立与疗效相关的质量控制标准与方法对药材质量的控制及疗效的发挥意义重大。
黄酮类成分是浮萍中含有的主要化学成分,有文献虽对浮萍中的黄酮类成分进行了测定,但未与其活性进行相关性研究[8-9]。本实验建立了HPLC测定浮萍中5个黄酮类成分量的方法并对不同产地的浮萍药材进行考察,发现不同产地、不同批次浮萍中5个黄酮类成分总量有一定差异,但差异波动范围不是很大,初步说明不同产地浮萍药材的质量还是比较均衡的。此外,本实验还采用DPPH自由基清除率法对不同产地不同批次浮萍的抗氧化活性及其与黄酮类成分量的相关性进行了研究,发现浮萍的抗氧化活性与5个黄酮类成分量均呈显著正相关,表明这5个黄酮类成分均可作为浮萍药材质量控制的指标,但综合考虑不同产地浮萍黄酮类成分测定结果,荭草素、牡荆素、木犀草苷的量相对较高,易于检测,可能更适于作为浮萍药材测定的指标性成分。聚类分析结合主成分分析结果显示,陕西和山西共计4个批次的浮萍药材统一聚为Ⅰ类,主成分综合得分排名位居前4,表明陕西和山西的浮萍药材质量较好,其不仅荭草素、牡荆素、木犀草苷的量均较其他产地明显偏高,而且抗氧化活性也较好,因此本研究建立的与活性相关的以荭草素、牡荆素等黄酮类成分为考察指标的浮萍药材的质量控制方法是可行的,建议《中国药典》可以增加荭草素、牡荆素和木犀草苷的测定指标,以更好地控制浮萍药材的质量。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 樊修和, 吴启南, 蒋征, 等. UPLC-MS/MS法测定不同产地浮萍中9种核苷类成分的量[J]. 中草药, 2015, 46(21):3253–3257. |
| [3] | Alvarado S, Guédez M, Lué-Merú M P, et al. Arsenic removal from waters by bioremediation with the aquatic plants water hyacinth (Eichhornia crassipes) and lesser duckweed (Lemna minor)[J]. Bioresource Technol, 2008, 99(17): 8436–40. DOI:10.1016/j.biortech.2008.02.051 |
| [4] | 凌云, 何板作, 鲍燕燕, 等. 浮萍的化学成分研究[J]. 中草药, 1999, 30(2):88–90. |
| [5] | Zhao X, Moates G K, Wellner N, et al. Chemical characterisation and analysis of the cell wall polysaccharides of duckweed (Lemna minor)[J]. Carbohydrate Polymers, 2014, 111(1): 410–418. |
| [6] | 罗铁成, 侯恩太, 路锋, 等. 浮萍药用研究概况[J]. 安徽农业科学, 2010, 16:8423–8424. |
| [7] | Wang B, Liang P, Zhu L, et al. Protective effect of total flavonoids from Spirodela polyrrhiza (L.) Schleid, on human umbilical vein endothelial cell damage induced by hydrogen peroxide[J]. Colloids Surfaces B Biointerfaces, 2007, 60(1): 36–40. DOI:10.1016/j.colsurfb.2007.05.020 |
| [8] | 苏春英, 苏本华, 孙静. HPLC法测定浮萍中芹菜素的含量[J]. 中医药信息, 2013(3):32–34. |
| [9] | 王红, 蒋征, 刘杰, 等. HPLC法同时测定15个产地浮萍中4种黄酮类成分[J]. 中成药, 2016(7):1569–1573. |
| [10] | Sun Y, Yuan H, Hao L, et al. Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin[J]. Food Chem, 2013, 141(1): 533–541. DOI:10.1016/j.foodchem.2013.03.030 |
| [11] | Fan S, Zhang Y, Sun Q, et al. Extract of okra lowers blood glucose and serum lipids in high-fat diet-induced obese C57BL/6 mice[J]. J Nutr Biochem, 2014, 25(7): 702–709. DOI:10.1016/j.jnutbio.2014.02.010 |
 2017, Vol. 48
2017, Vol. 48


