2. 浙江省中药研究所, 浙江 杭州 310023
2. Zhejiang Institute of Chinese Meteria Medica, Hangzhou 310023, China
浙贝母为百合科贝母属的一种多年生草本植物,是“浙八味”中最主要的中药之一,其鳞茎为药用部位,具有清热化痰、止咳、开郁、散结等功效,用于咳嗽、心胸郁结、肺炎、急慢性支气管炎等多种疾病的治疗[1]。浙贝母主要产于浙江省,在江苏、福建和江西等地也有种植,目前的主栽品种为狭叶、宽叶和新梅园等[2]。化学分析表明,浙贝母中主要活性成分是甾体类生物碱,包括浙贝甲素、浙贝乙素、贝母辛、鄂贝啶碱等,其中浙贝甲素和浙贝乙素的量相对较高,研究表明甾体类生物碱具有非常广泛的生物学活性,如止咳、平喘、降压、抗菌、消炎、抗肿瘤等[3-6]。
法呢基焦磷酸合酶(FPS)是甲羟戊酸途径(mevalonate pathway,MVA)中的一个关键酶,是一种异戊烯基转移酶,催化异戊烯基焦磷酸(IPP)和二甲基丙烯基焦磷酸(DMAPP)发生缩合反应,形成法呢基焦磷酸[7-8]。MVA途径是植物体内萜类物质合成代谢的主要途径,为萜类、甾醇、激素等物质的合成提供前体化合物,研究表明,在植物中,MVA途径也是甾体骨架的主要合成途径,为甾体类生物碱的合成提供前体物质,因此,MVA途径及该途径的关键酶FPS可能参与浙贝母甾体类生物碱的生物合成[9]。目前,FPS基因已从姜花[10]、腊梅[11]、洋甘菊[12]、虎眼万年青[13]、雷公藤[14]等植物中分离和克隆出来。目前,浙贝母生物碱合成代谢途径及该途径中的关键调控酶基因尚未明确和完善,为探索浙贝母生物碱合成机制,本研究以MVA途径中的关键酶基因FPS为切入点,以其cDNA全长序列的克隆为基础,分析了其在浙贝母狭叶、宽叶和新梅园3个品种10个不同发育时期新鳞茎中的表达量与生物碱量的相关性关系,以初步探究FPS基因在浙贝母生物碱合成代谢途径中的调控作用,为后续浙贝母生物碱合成代谢途径的完善和通过基因工程手段特异性调控关键酶基因从而促进代谢产物大量合成积累奠定基础。
1 材料本研究以2016年3月2日、3月8日、3月15日、3月22日、3月28日、4月5日、4月12日、4月21日、4月28日和5月4日10个不同发育时期的浙贝母狭叶、宽叶和新梅园3个品种的根、茎、叶、花、新鳞茎和老鳞茎等组织部位为材料,经浙江省中药研究所江建铭教授级高工鉴定为百合科浙贝母Fritillaria thunbergii Miq.狭叶、宽叶和新梅园品种,实验材料采集于浙江省宁波市鄞州区章水镇浙贝母种植基地。新鲜材料经酒精擦拭及DEPC处理水洗涤后,放入液氮中速冻,然后置于−80 ℃冰箱中保存备用。
2 方法 2.1 浙贝母总RNA提取及cDNA第一链合成以浙贝母狭叶、宽叶和新梅园3个品种10个不同发育时期的根、茎、叶、花、新鳞茎和老鳞茎等组织部位为材料,按植物总RNA提取试剂盒(RNAprep Pure Plant Kit DP432,TIANGEN,中国)说明书分别提取各组织部位材料的总RNA。采用NanoDropTM 2000分光光度计(Thermo Fisher,美国)测定260、280 nm吸光度(A),测定总RNA纯度,1.5%琼脂糖凝胶电泳鉴定其完整性。A260/280值在1.9~2.1、电泳有3条亮带且28 S条带亮度大约是18 S 2倍的总RNA为高质量RNA,可进行cDNA第一链合成实验[15]。以提取的不同组织部位的高质量总RNA为模版,使用SuperRT cDNA第一链合成试剂盒(SuperRT cDNA Kit CW0741,CWBIO,中国)反转录合成cDNA第一链,操作步骤按说明书进行。
2.2 浙贝母FPS基因全长cDNA的克隆及生物信息学分析在已有的浙贝母部分FPS基因片段的基础上,按照SMART RACE试剂盒(TaKaRa)操作说明,分别设计5’-TCAAGTCAAGCATCTGCCCCGAAGC-3’和3’-TTGCTGATGTCTGGCGAAAACTTGGC-5’引物,并进行5’ RACE和3’ RACE。PCR扩增产物经1.5%琼脂糖凝胶电泳、回收目的条带并克隆到pMD-19T载体中,将重组载体转入到DH5α大肠杆菌感受态细胞中,将转化后的大肠杆菌涂布在含有AMP/X-Gal/IPTG的SOB培养基上,37 ℃培养16 h,PCR筛选阳性克隆,测序,拼接5’端和3’端序列,获得FPS基因cDNA全长序列;根据拼接得到的FPS基因cDNA全长序列设计跨开放阅读框(ORF)全长验证引物FPS-F1:3’-AGCCACATCAT-CAGGTCACT-5’和FPS-R1:3’-CATAATCAGCCCT-TACTCCA-5’,进行RT-PCR反应并将目的条带回收测序,分析测序结果与所拼接得到的全长序列的一致性。
所得FPS基因的3’端序列、5’端序列和已有的部分序列经软件DNAMAN 5.0及DNAStar拼接,寻找ORF并推导氨基酸序列;在NCBI中对FPS基因全长cDNA序列BLAST比对并进行同源性分析;用ClustalX软件及DNAStar软件包中的MegAlign软件对蛋白序列作比对及同源性分析;采用MAGE 4.0软件以邻接法(Neighbour-Joining)根据不同物种的FPS氨基酸序列构建系统进化树。
2.3 浙贝母FPS基因表达差异水平检测根据克隆得到的浙贝母FPS基因序列设计一对荧光引物,FPS-F2:3’-TTTCGCCAGACATCAGCA-5’,FPS-R2:3’-GGATTTATTCAACGAGGTG-5’;以浙贝母β-actin基因作为内参基因(本课题组已克隆出,尚未注册)设计一对上下游引物:β-actin-F:3’-CATAATCCAGAGCCACATA-5’和β-actin-R:3’-TGCCAATCTACGAGGGTT-5’。分别以不同组织部位的cDNA为模板,FPS-F2、FPS-R2为上下游引物进行RT-qPCR反应(Bio-RAD CFX96,美国),检测不同组织部位中FPS基因的表达差异水平。按以下参数配置25 μL qPCR反应体系为12.5 μL SYBR Green PCR混合液(Thermo Scientific)、上下游引物各1 μL、1 μL cDNA、9.5 μL ddH2O。RT-qPCR反应程序:95 ℃初始热变性7 min;95 ℃ 15 s,59 ℃ 30 s,72 ℃ 15 s,重复43个循环。
2.4 HPLC-ELSD法测定浙贝母不同组织中生物碱量 2.4.1 色谱条件色谱柱为Agilent Hypersil BDS-C18(250 mm×4.0 mm,5 μm),流动相为乙腈-水-二乙胺(70:30:0.03),体积流量1 mL/min;样品进样量:20 μL;ELSD参数:温度85 ℃,载气体积流量2.2 L/min。
2.4.2 标准曲线绘制及样品生物碱提取分别称取对照品浙贝甲素5.4 mg,浙贝乙素6.3 mg,加甲醇稀释定容至10 mL量瓶中,再用甲醇依次稀释成浙贝甲素540、270、135、67.5、33.8 mg/L,浙贝乙素630、315、157.5、78.8、39.4 mg/L的混合对照品溶液,按“2.4.1”项色谱条件进行分析,以对照品峰面积为纵坐标,以质量浓度为横坐标,得到线性回归方程。
以浙贝母狭叶、宽叶和新梅园3个品种6个不同组织(根、茎、叶、花、新鳞茎和老鳞茎)及10个不同发育时期的新鳞茎为材料,烘干磨粉、称取3 g于50 mL离心管中,加浓氨水8 mL浸润1 h、精密加入三氯甲烷-甲醇(4:1)的混合溶液40 mL,称定质量、混匀,置32 ℃摇床中震荡12 h,再称定质量,加上述混合溶液补足减失的质量,5 000 r/min离心20 min。精密量取3组下清液10 mL,分别置蒸发皿中蒸干,残渣加甲醇溶液溶解、0.22 μm滤膜滤过并转移至2 mL量瓶中,加甲醇定容即可[16]。
3 结果与分析 3.1 浙贝母FPS基因全长cDNA的克隆及生物信息学分析以浙贝母宽叶品种的新鳞茎cDNA为模版,采用分段克隆法和5’、3’ RACE末端克隆法对FPS基因全长cDNA序列进行克隆,测序得到中间序列414 bp(图 1-C)、5’端序列871 bp(图 1-A)和3’端序列645 bp(图 1-B)。拼接各片段,得到FPS基因cDNA序列全长1 629 bp,ORF为1 056 bp,编码351个氨基酸,cDNA全长中还包含5’非编码区348 bp,3’非编码区225 bp,以及终止密码子TAG和多聚A尾巴。使用全长验证引物FPS-F1和FPS-R1进行RT-PCR扩增,测序获得长1 457 bp的单一条带(图 1-D),序列分析显示其含有完整的ORF,说明已成功获得FPS基因全长cDNA。
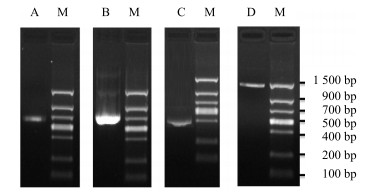
|
A-5’-端序列B-3’-端C-中间片段序列D-全长验证序列M-Marker A-5'-sequence B-3'-sequence C-middle segment sequence D-full length sequence M-Marker 图 1 FPS基因序列片段的克隆 Fig.1 Gene cloning of nucleotide sequences of FPS |
将FPS基因的氨基酸序列通过NCBI网站上的BLAST功能进行氨基酸同源性比较分析,同源性结果显示,浙贝母FPS氨基酸序列与麝香百合Lilium longiflorum Thumb.(ADZ57167.1)、腊梅Chimonanthus praecox (L.) Link(ACJ38671.1)、铁皮石斛Dendrobium catenatum L.(AFX68799.1)、长春花Catharanthus roseus (Linn.) G. Don(ADO95193.1)、烟草Nicotiana tabacum L.(AHM22931.1)、水稻Oryza sativa L.(BAA36276.1)和拟南芥Arabidopsis thaliana L.(AAB07248.1)的相似性分别为95%、80%、79%、79%、77%、75%和72%,其中浙贝母FPS氨基酸序列与同属百合科的麝香百合同源性最高(图 2-A)。根据NCBI网站的氨基酸序列BLAST分析,选取了一部分典型的植物物种并用Mega 4.0软件构建进化树,进行分子系统学分析,系统进化树结果显示,浙贝母与麝香百合、铁皮石斛、腊梅和水稻聚为一大支,长春花、拟南芥和烟草聚为另一大支,其中浙贝母与麝香百合具有最近的亲缘关系,这可能与浙贝母和麝香百合同属百合科有关。

|
数值为Bootstraps值,反映相邻分支间的可靠性,数值越趋近100,可靠性越高 The value in the figure is Bootstraps, which reflects the reliability of adjacent branches. The number was closer to 100, which means the reliability is the higher 图 2 FPS基因氨基酸序列比对 (A) 及分子进化树 (B) 构建 Fig.2 Comparison of amino acid sequences and construction of molecular phylogenetic tree of FPS gene |
3.2 浙贝母FPS基因组织表达特异性分析
以2016年3月8日采集的浙贝母狭叶、宽叶和新梅园3个品种的根、茎、叶、花、新鳞茎和老鳞茎为材料,采用RT-qPCR法检测了FPS基因在不同浙贝母品种、不同组织部位的表达差异水平,基因表达差异结果如图 3所示。FPS基因在浙贝母狭叶、宽叶和新梅园3个品种的根、茎、叶、花、新鳞茎和老鳞茎6个组织部位均有表达,且表达趋势相同,其中在花中的表达量最高,其次为新鳞茎,根中的表达量最低;FPS基因在新梅园品种不同组织中的表达量要明显高于狭叶和宽叶品种。
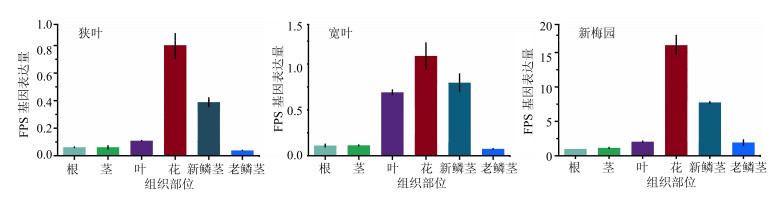
|
图 3 浙贝母FPS基因组织特异性表达分析 Fig.3 FPS gene expression analysis in different tissues of Fritillaria thunbergii |
3.3 FPS基因在不同发育时期新鳞茎中的表达差异水平分析
采用RT-qPCR法检测了FPS基因在浙贝母狭叶、宽叶和新梅园3个品种10个不同发育时期(2016年3月2日、3月8日、3月15日、3月22日、3月28日、4月5日、4月12日、4月21日、4月28日和5月4日)新鳞茎中的表达差异,结果如图 4所示。结果显示,FPS基因在狭叶、宽叶和新梅园3个品种中的总体表达趋势相似,3月2日~4月5日之间FPS基因表达差异水平浮动较大,4月5日~5月4日FPS基因表达处于较低水平且表达稳定;在3月2日、3月22日和3月28日这3个时期不同品种的表达差异较为显著,3月2日宽叶和新梅园FPS基因表达处于较高水平,而狭叶品种在3月22日处于较高水平,狭叶和新梅园品种在3月22日均处于相对高的表达水平,而宽叶要晚些,在3月28日再次处于相对高的表达水平。
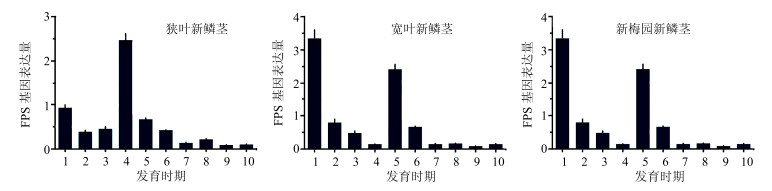
|
1-2016-03-02 2-2016-03-08 3-2016-03-15 4-2016-03-22 5-2016-03-28 6-2016-04-05 7-2016-04-12 8-2016-04-21 9-2016-04-28 10-2016-05-04 图 4 浙贝母FPS基因在不同发育时期新鳞茎中的表达差异水平 Fig.4 Expression of FPS gene in new bulbs at different developmental stages |
3.4 浙贝母不同组织及不同发育时期新鳞茎中生物碱积累量的测定与分析
采用HPLC-ELSD法测定了浙贝母狭叶、宽叶和新梅园3个品种6个不同组织(2016年3月8日的根、茎、叶、花、新鳞茎和老鳞茎)及10个不同发育时期(2016年3月2日、3月8日、3月15日、3月22日、3月28日、4月5日、4月12日、4月21日、4月28日和5月4日)新鳞茎中生物碱(浙贝甲素和浙贝乙素)的量变化,结果如图 5所示。在浙贝母狭叶、宽叶和新梅园3个品种6个不同组织中均含生物碱,其中新鳞茎中总生物碱(浙贝甲素与浙贝乙素量之和)量最高,其次为老鳞茎,根中生物碱量最低;在根、茎、叶、花和老鳞茎中,浙贝甲素的量略高于浙贝乙素,但在新鳞茎中浙贝乙素量高于浙贝甲素。
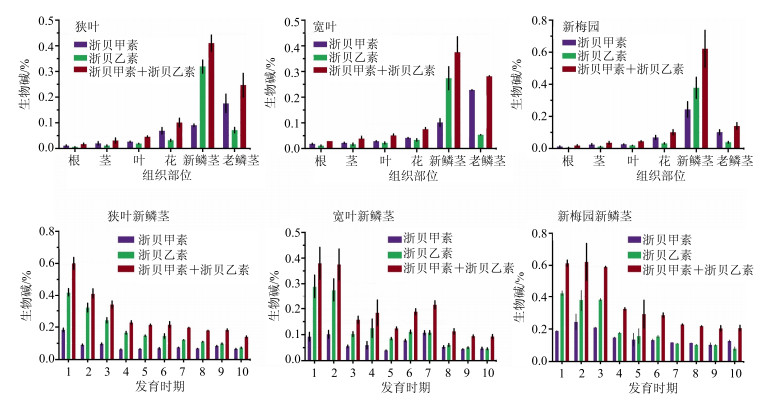
|
1-2016-03-02 2-2016-03-08 3-2016-03-15 4-2016-03-22 5-2016-03-28 6-2016-04-05 7-2016-04-12 8-2016-04-21 9-2016-04-28 10-2016-05-04 图 5 浙贝母不同组织及不同发育时期新鳞茎中生物碱量 Fig.5 Contents of alkaloids in different tissues and at different developmental stages of F. thunbergii new bulbs |
在狭叶、宽叶和新梅园3个品种中,不同时期新鳞茎中浙贝甲素和浙贝乙素的整体量变化趋势相似,3月份生物碱量要高于4月份,其中3月2日生物碱量最高,5月4日量最低,在这10个时期的发育过程中生物碱量呈逐渐降低趋势;发育前期,浙贝乙素的量明显高于浙贝甲素,直至后期,两者量相近,并且浙贝乙素的降低幅度要高于浙贝甲素;狭叶、宽叶和新梅园3个品种生物碱平均量相差不大,其中新梅园品种生物碱平均量要高于狭叶和宽叶品种,宽叶品种量最低。
3.5 浙贝母FPS基因表达量与生物碱量相关性分析采用SPSS Statistics 21.0软件分别对浙贝母狭叶、宽叶和新梅园3个品种6个组织及10个发育时期新鳞茎中FPS基因表达量与生物碱量进行相关性分析,结果分别如表 1和2所示。浙贝母狭叶、宽叶和新梅园3个品种的6个不同组织中(表 1),FPS基因表达量与浙贝甲素、浙贝乙素和总生物碱(浙贝甲素与浙贝乙素量之和)均呈正相关性,FPS基因表达量与浙贝乙素和总碱量的相关系数均高于浙贝甲素;在狭叶和宽叶品种中,FPS基因表达量与浙贝甲素量的相关性较差;浙贝甲素与浙贝乙素量具有正相关性,其中新梅园品种相关性最高。
|
|
表 1 浙贝母FPS基因表达量与不同组织生物碱量相关系数 Table 1 Correlation coefficient of FPS gene expression with alkaloid content in different tissues |
|
|
表 2 浙贝母FPS基因表达量与不同发育时期新鳞茎生物碱量相关系数 Table 2 Correlation coefficient of FPS gene expression with alkaloid content in different developmental stages of new bulbs |
浙贝母狭叶、宽叶和新梅园3个品种10个发育时期新鳞茎中(表 2),FPS基因表达量与浙贝甲素、浙贝乙素和总生物碱(浙贝甲素与浙贝乙素量之和)均呈正相关性,FPS基因表达量与浙贝甲素量的相关系数相比较低,FPS基因表达量与浙贝乙素和总碱量的相关系数均较浙贝甲素高,并且在宽叶和新梅园品种中FPS基因表达量与浙贝乙素和总碱量均呈显著正相关性,但狭叶品种的相关性较差;浙贝甲素与浙贝乙素量具有高度的正相关性。
4 讨论生物碱具有降压、止咳平喘、抗肿瘤、抗菌消炎和抗血栓等广泛的生理活性,为了利用植物基因工程、细胞工程工业化大量生产该重要活性成分,生物碱合成途径及调控的关键酶基因成为研究热点[19]。FPS处于MVA途径中的第一个分支点,是一个关键限速酶,其催化产物法呢基焦磷酸是植物甾醇、固醇类、萜类等物质合成的前体物质,植物甾醇又为甾体生物碱的合成提供甾体母核结构,因此推断MVA途径为甾体生物碱的合成提供前体物质,为甾体生物碱的上游合成途径[20-21]。Sun等[22]对川贝母进行表达序列标签(ESTs)分析,结果分析发现,FPS基因可能参与调控川贝母甾体类生物碱的生物合成。本研究首先克隆了浙贝母FPS基因cDNA全长序列,氨基酸序列同源性和系统进化分析发现其与其他植物具有较高的同源性,表明克隆得到的该基因是浙贝母的FPS基因。FPS基因组织特异性表达显示,FPS基因在浙贝母根、茎、叶、花、新鳞茎和老鳞茎中均有表达,并且在花和新鳞茎中的表达量最高。通过分析FPS基因在浙贝母10个不同发育时期新鳞茎中的表达量,结果发现:3月2日至4月5日之间FPS基因表达差异水平浮动较大,4月5日至5月4日FPS基因表达处于较低水平且表达稳定,这可能与浙贝母生长特性有关,3月份浙贝母老鳞茎生根发芽,代谢作用强、基因表达水平高,而4月份贝母地上部分逐渐变黄枯萎,代谢水平降低、基因表达水平也相应降低。
为进一步研究确定FPS基因是否参与浙贝母生物碱合成代谢调控,本实验测定了3个品种浙贝母6个组织及不同发育期新鳞茎中的生物碱量,并将其与FPS基因的表达量进行相关性分析,以确定FPS基因表达与生物碱量之间的关系。生物碱量测定结果发现,浙贝母狭叶、宽叶和新梅园品种,6个不同组织中均含有生物碱,其中新鳞茎中总生物碱量最高,其次为老鳞茎;3月2日新鳞茎中生物碱量最高,并且呈逐渐降低趋势。相关性分析结果显示,不同组织中FPS基因表达量与浙贝甲素、浙贝乙素量具有较低的正相关性(相关系数分别为0.057、0.476,0.085、0.495,0.375、0.432),其中FPS基因表达量与浙贝乙素量的相关性要高于浙贝甲素;不同发育时期新鳞茎中FPS基因表达量与生物碱量相关性分析显示,在宽叶和新梅园品种中,FPS基因表达量与浙贝甲素、浙贝乙素量均具有明显的正相关性(相关系数分别为0.289、0.613,0.427、0.622),FPS基因表达量与浙贝乙素量的相关性明显高于浙贝甲素,但在狭叶品种中,FPS基因表达量与浙贝甲素、浙贝乙素量相关性相对较低(0.054、0.236),这可能与环境、品种特异性等相关因素有关;因此,可推测出FPS基因参与了浙贝母生物碱(浙贝甲素和浙贝乙素)的合成代谢,即FPS基因表达量提高可促进浙贝母生物碱的合成积累量,并且FPS基因对浙贝乙素合成途径的调控作用比浙贝甲素强。
综上所述,FPS基因在浙贝母不同组织中存在特异性表达,且在高生物碱量的新鳞茎、老鳞茎和花中表达量较高;FPS基因表达量与生物碱浙贝甲素、浙贝乙素量具有明显的正相关性。因此,本研究初步确定FPS基因参与调控浙贝母生物碱(浙贝甲素和浙贝乙素)的合成代谢,关于FPS基因的具体功能有待进一步研究。
| [1] | Kim E J, Yoon Y P, Woo K W, et al. Verticine, ebeiedine and suchengbeisine isolated from the bulbs of Fritillaria thunbergii Miq. inhibited the gene expression and production of MUC5AC mucin from human airway epithelial cells[J]. Phytomedicine, 2016, 23(2): 95–104. DOI:10.1016/j.phymed.2015.12.016 |
| [2] | Lou Y, Cai H, Liu X, et al. Element analysis and characteristic identification of non-fumigated and sulfur-fumigated Fritillaria thunbergii Miq. using microwave digestion-inductively coupled plasma atomic emission spectrometry combined with Fourier transform infrared spectrometry[J]. Pharmacogn Mag, 2014, 10(1): 30–36. |
| [3] | Cho I H, Lee M J, Kim J H, et al. Fritillaria ussuriensis extract inhibits the production of inflammatory cytokine and MAPKs in mast cells[J]. Biosci Biotechnol Biochem, 2011, 75(8): 1440–1445. DOI:10.1271/bbb.110076 |
| [4] | Oh H, Kang D G, Lee S, et al. Angiotensin converting enzyme (ACE) inhibitory alkaloids from Fritillaria ussuriensis[J]. Plant Medica, 2003, 69(6): 564–565. DOI:10.1055/s-2003-40659 |
| [5] | Wang D D, Feng Y, Li Z, et al. In vitro and in vivo antitumor activity of bulbus fritillariae cirrhosae and preliminary investigation of its mechanism[J]. Nutrition & Cancer, 2014, 66(3): 441–452. |
| [6] | Chen L, Lu X, Liang X, et al. Mechanistic studies of the transport of peimine in the Caco-2 cell model[J]. Acta Pharm Sin B, 2016, 6(2): 125–131. DOI:10.1016/j.apsb.2016.01.006 |
| [7] | Baadhe R R, Mekala N K, Palagiri S R, et al. Development of petri net-based dynamic model for improved production of farnesyl pyrophosphate by integrating mevalonate and methylerythritol phosphate pathways in yeast[J]. Appl Biochem Biotechnol, 2012, 167(5): 1172–1182. DOI:10.1007/s12010-012-9583-1 |
| [8] | Thulasiram H V, Poulter C D. Farnesyl diphosphate synthase:the art of compromise between substrate selectivity and stereoselectivity[J]. J Am Chem Soc, 2006, 128(49): 15819–15823. DOI:10.1021/ja065573b |
| [9] | Cárdenas P D, Sonawane P D, Pollier J, et al. GAME9 regulates the biosynthesis of steroidal alkaloids and upstream isoprenoids in the plant mevalonate pathway[J]. Nat Commun, 2016, 7(16): 10654–10669. |
| [10] | Lan J B, Yu R C, Yu Y Y, et al. Molecular cloning and expression of Hedychium coronarium farnesyl pyrophosphate synthase gene and its possible involvement in the biosynthesis of floral and wounding/herbivory induced leaf volatile sesquiterpenoids[J]. Gene, 2013, 518(2): 360–367. DOI:10.1016/j.gene.2013.01.007 |
| [11] | Xiang L, Zhao K, Chen L. Molecular cloning and expression of Chimonanthus praecox farnesyl pyrophosphate synthase gene and its possible involvement in the biosynthesis of floral volatile sesquiterpenoids[J]. Plant Physiol Biochem, 2010, 48(10/11): 845–850. |
| [12] | Su S S, Zhang H M, Liu X Y, et al. Cloning and characterization of a farnesyl pyrophosphate synthase from Matricaria recutita L. and its upregulation by methyl jasmonate[J]. Genet Mol Res, 2015, 14(1): 349–361. DOI:10.4238/2015.January.23.8 |
| [13] | Guo L, Kong J Q. cDNA cloning and expression analysis of farnesyl pyrophosphate synthase from Ornithogalum saundersiae[J]. Z Naturforsch C, 2014, 69(5/6): 259–270. |
| [14] | Zhao Y J, Chen X, Zhang M, et al. Molecular Cloning and characterisation of farnesyl pyrophosphate synthase from Tripterygium wilfordii[J]. PLoS One, 2015, 10(5): e0125415. DOI:10.1371/journal.pone.0125415 |
| [15] | 王峰, 吴秋红, 高辉, 等. 红树林植物杯萼海桑法呢基焦磷酸合酶的基因克隆及序列分析[J]. 中草药, 2013, 44(16):2294–2299. |
| [16] | 郎红, 吴松权. 膜荚黄芪法呢基焦磷酸合酶基因密码子偏性分析[J]. 中草药, 2015, 46(20):3071–3078. |
| [17] | Ogura T, Tsuchiya A, Minas T, et al. Methods of high integrity RNA extraction from cell/agarose construct[J]. BMC Res Notes, 2015, 8(3): 644–651. |
| [18] | Long Z, Guo Z, Acworth I N, et al. A non-derivative method for the quantitative analysis of isosteroidal alkaloids from Fritillaria by high performance liquid chromatography combined with charged aerosol detection[J]. Talanta, 2016, 151(3): 239–244. |
| [19] | Hao D C, Gu X J, Xiao P G, et al. Phytochemical and biological research of Fritillaria medicine resources[J]. Chin J Natural Med, 2013, 11(4): 330–344. DOI:10.1016/S1875-5364(13)60050-3 |
| [20] | Arnqvist L, Dutta P C, Jonsson L, et al. Reduction of cholesterol and glycoalkaloid levels in transgenic potato plants by overexpression of a type 1 sterol methyltransferase cDNA[J]. Plant Physiol, 2003, 131(4): 1792–1799. DOI:10.1104/pp.102.018788 |
| [21] | Suzuki M, Muranaka T. Molecular genetics of plant sterol backbone synthesis[J]. Lipids, 2007, 42(1): 47–54. DOI:10.1007/s11745-006-1000-5 |
| [22] | Sun C, Sun Y Q, Song J Y, et al. Discover of genes related to steroidal alkaloid biosynthesis in Fritillaria cirrhosa by generating and mining a dataset of expressed sequence tags (ESTs)[J]. J Medi Plants Res, 2011, 5(21): 5307–5314. |
 2017, Vol. 48
2017, Vol. 48


