丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge. 的干燥根及根茎,是最常用的活血化瘀中药之一,始载于《神农本草经》,具有祛瘀止痛、养血安神的功效[1]。目前研究主要集中在丹参中水溶性丹酚酸类和脂溶性丹参酮类有效成分[2-3]。丹参药材临床用量较大,国内已大量栽培,其地上茎叶未被有效利用而废弃,造成资源浪费及环境污染。
本草记载和现代研究证实丹参茎叶具有与根和根茎相似的临床疗效及药理活性,在《山东药用植物志》中记载:“丹参茎叶具有活血祛瘀,清心除烦之效”。化学成分研究表明,丹参地上茎叶中几乎不含丹参酮IIA等脂溶性成分,但含有丰富的丹酚酸类化合物,以迷迭香酸和丹酚酸B量最高[4],除此之外,丹参茎叶中还含有黄酮类、三萜类、糖类、皂苷类及香豆素类成分[5-6],可用于治疗心血管疾病、慢性肝炎、糖尿病糖代谢紊乱、因化疗引起的白细胞减少等症[7-8]。目前,尚无对不同产地丹参茎叶指纹图谱的研究,本实验采用具有高分析效率和高灵敏度的UPLC法,建立丹参茎叶UPLC特征图谱,以高分辨率的四极杆-飞行时间(quadrupole time-of-flight,QTOF)串联质谱技术对共有峰进行定性鉴别分析,结合相似度分析、聚类分析和主成分分析(PCA)的方法[9-10],为丹参茎叶质量控制及标准的制定提供科学依据,以期提升丹参资源利用效率,实现经济-社会-生态效益的统一。
1 仪器与材料 1.1 仪器ACQUITY UPLC系统(二元高压泵,自动进样器,柱温箱,二极管阵列检测器,Waters 公司);Synapt TM Q-TOF质谱仪(Lock-spay接口,电喷雾离子源,Waters公司);MassLynxTM质谱工作站(Waters公司);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Sartorius BT125D电子分析天平(德国塞多利斯公司);EPED超纯水系统(南京易普达易科技发展有限公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);AnkeGL-16 GII型离心机(上海安亭科学仪器厂)。
1.2 材料对照品丹参素(批号MUST-13030108)、咖啡酸(批号110885-200102)、芦丁(批号100080-201409)、迷迭香酸(批号111871-201203)均购自中国食品药品检定研究院;异槲皮苷批号(MUST-15070211)、紫草酸(批号MUST-15022407)、丹酚酸B(批号MUST-13030203)、丹酚酸A(批号MUST-13030701)、丹酚酸C(批号MUST-15011305)均购自北京普天同创生物科技有限公司,质量分数均大于98%。甲醇(南京化学试剂有限公司)为分析纯,乙腈(美国TEDIA公司)及甲酸均为色谱纯(美国ACS公司),超纯水由Milli-Q纯水机制备。
12批丹参茎叶样品,其详细信息见表 1。植物基原经南京中医药大学段金廒教授鉴定为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge. 的地上茎叶。所得样品分别于热风(50 ℃)条件下进行烘干,干燥至恒定质量后粉碎成粗粉,常温密封干燥保存备用。
|
|
表 1 12批不同产地丹参茎叶 Table 1 Twelve batches of samples from different habitats |
2 方法与结果 2.1 UPLC 分析条件 2.1.1 色谱条件
Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱;柱温为35 ℃;流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~1 min,5% A;1~3 min;5%~10% A;3~7 min,10%~15% A;7~11 min,15%~21% A;11~15 min,21%~33% A;15~17 min,33%~70% A;17~18 min,70%~80% A;18~20 min,80% A;20~21 min,80%~5% A);体积流量0.4 mL/min;进样量2 μL;检测波长为280 nm。
2.1.2 质谱条件ESI源;扫描方式ESI+、ESI−模式;毛细管电压3.0 kV;锥孔电压30 V;萃取电压4.0 V;离子源温度120 ℃;脱溶剂气温度400 ℃;锥孔气流量50 L/h;脱溶剂气流量800 L/h;碰撞能量6~40 eV,离子能量1 V;质量扫描范围m/z 100~1 000,数据采集方式和模式:Centroid。
2.2 溶液制备 2.2.1 对照品溶液制备分别精密称取丹参素、咖啡酸、芦丁、异槲皮苷、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A、丹酚酸C对照品适量,用甲醇配成质量浓度分别为0.108、0.106、0.354、0.305、0.137、0.132、0.211、0.106、0.120 mg/mL的混合对照品溶液。
2.2.2 供试品溶液制备取样品粉末(40目)1 g,精密称定,置于具塞锥形瓶中,加80%甲醇50 mL,静置过夜,室温超声45 min,摇匀,离心10 min(13 000 r/min)。取上清液适量,0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.3 方法学考察 2.3.1 精密度试验取S1号样品,按照“2.2.2”项下方法制备供试品溶液,连续进样6次,记录色谱图。结果表明,各主要色谱峰的相对保留时间和相对峰面积的RSD值均小于3.0%,符合特征图谱要求,表明仪器精密度良好。
2.3.2 重复性试验取S1号样品6份,按照“2.2.2”项下方法制备供试品溶液,分别检测,色谱图中各主要色谱峰相对保留时间和相对峰面积的RSD 值均小于3.0%,符合特征图谱要求,表明方法重复性良好。
2.3.3 稳定性试验取S1号样品,按照“2.2.2”项下方法制备供试品溶液,分别在0、2、4、8、12、24 h检测色谱图。计算各色谱峰与内参比峰的相对保留时间和相对峰面积,其RSD值均小于3.0%,符合特征图谱要求,结果表明供试品溶液在24 h内稳定。
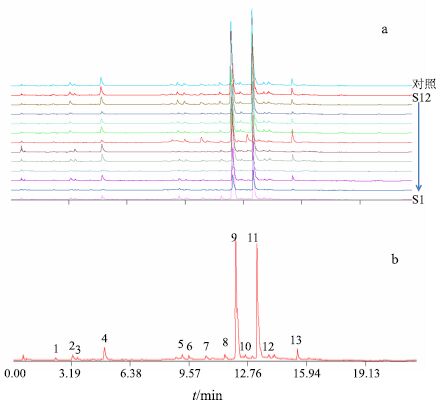
2.4 丹参茎叶UPLC指纹图谱与化学模式识别研究 2.4.1 UPLC-UV特征图谱的建立分别精密吸取12批茎叶样品供试品溶液2 μL,注入液相色谱仪,记录色谱图,将各样品色谱图导入“中药色谱指纹图谱相似度评价系统”(国家药典委员会2004A版),选定S12号样品色谱图为参照图谱,设定时间漂移值0.1,采用中位数法谱峰自动匹配生成丹参茎叶对照图谱,叠加图谱及对照图谱见图 1。将该对照图谱的相似度值定为1,计算12批样品特征图谱的相似度,见表 2。
|
图 1 12批丹参茎叶的叠加UPLC-UV 特征图谱 (a) 及对照图谱 (b) Fig.1 UPLC-fingerprint (a) and reference-fingerprint (b) for 12 batches of samples |
|
|
表 2 12批丹参茎叶相似度分析结果 Table 2 Similarity of 12 batches of samples |
2.4.2 共有峰的确定
以9号峰为参照峰,标示出丹参茎叶UPLC-UV色谱图中13个共有峰,共有峰的峰面积之和大于90%,计算各色谱峰与参照峰相对保留时间的RSD值。结果表明,样品各色谱图共有峰的相对保留时间RSD值均小于3.0%;而相对峰面积的RSD值相差较大,其中3、7、13号峰RSD值较大,结果见表 3和表 4。
|
|
表 3 共有峰相对保留时间 Table 3 Relative retention times of common peaks |
|
|
表 4 共有峰相对峰面积 Table 4 Relative areas of common peaks |
2.4.3 共有峰的归属
采用对照品对照和参考文献中的质谱一级、二级数据和色谱保留行为[11],鉴定了10个共有峰所代表的化学成分,其中1、4、5、6、7、9、10、11、12、13号峰采用对照品对照分别确定为丹参素、咖啡酸、芦丁、异槲皮苷、迷迭香 酸、紫草酸、丹酚酸B、丹酚酸A和丹酚酸C,7号峰经质谱鉴定推测为槲皮素,结果见表 5。
|
|
表 5 共有峰的化学成分鉴定 Table 5 Identification of chemical components from common peaks |
2.4.4 相似度评价
与12批丹参茎叶生成的对照指纹图谱相比较,各批次丹参茎叶样品的相似度在0.823~0.997,表明各批次丹参茎叶样品的质量相对稳定,从图 1可以看出不同产地丹参茎叶的化学成分基本一致,各成分在量上存在差异。由表 2可知,样品S7(产地江苏南京)相似度较低,而产地为山东的丹参茎叶样品(S9~S12)相似度则较高。
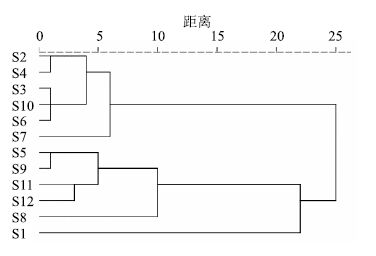
2.4.5 聚类分析聚类分析是通过将观察对象依据某些特征加以归类,从而建立样本与样本之间的相似关系或亲疏关系的一种探索性数据分析手段,目前已广泛应用于中药鉴别、质量评价和品种分类等方面[11-12]。本实验对12个产地的丹参茎叶样品进行指纹图谱分析,获得13个共有色谱峰,将各个共有峰峰面积导入SPSS 19.0版软件,采用组间连接法,选用欧氏距离对12批药材进行聚类分析,结果见图 2。聚类分析结果表明,12个产地的丹参茎叶主要分为两类,除S10外,产地为山东的茎叶样品(S8、S9、S11和S12)与其他产地样品分别聚为一类,说明山东的茎叶样品与其他产地的存在一定差异,观察2类样品各共有峰相对峰面积可以发现,其差异主要表现在3号峰和13号峰(丹酚酸C),提示其可能是造成山东丹参茎叶样品与其他产地样品存在差异的原因之一,且采收期为9月份的丹参茎叶样品(S2和S4)较为相近,说明不同采收期的丹参茎叶中化学成分积量变化明显。
|
图 2 12批丹参茎叶聚类树状图 Fig.2 Dendrogram of 12 batches of samples |
2.4.6 PCA分析
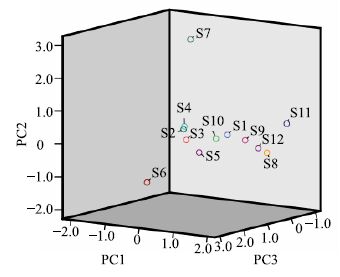
为了更直接地评价13个共有成分对样品的分辨能力,采用SPSS 19.0版软件对12批丹参茎叶样品进行PCA分析,结果得到3个最大特征值的主成分PC1、PC2、PC3,主成分PC1贡献率为55.5%,贡献率最大,包含的信息最多;PC2贡献率为19.3%,PC3贡献率为11.3%,前3个主成分的累计贡献率86.0%,所以选取前3个主成分能反映丹参茎叶中化学成分的基本特征。分别以PC1、PC2、PC3建立坐标系进行投影,得到12批样品的3D-PCA分析投影图(图 3)。由图可知,S7号样品与其他样品投影点相距较远,表明S7号丹参茎叶(产地江苏南京)与其他产地丹参茎叶差异性很大,这一结果与相似度分析结果相一致。
|
图 3 12批丹参茎叶的PCA图 Fig.3 PCA diagram of 12 batches of samples |
3 讨论 3.1 提取方法的考察
考虑不同比例提取溶液(70%、80%、90%甲醇)、不同提取时间(30、45、60 min)对提取效率的影响,结果表明用80%甲醇作为溶剂,超声处理45 min,即能将丹参茎叶中酚酸类成分和黄酮类成分提取充分,且含量稳定。
3.2 色谱条件的优化本实验在色谱图处理过程中比较了280 nm和254 nm不同波长下的色谱峰响应情况,结果表明在280 nm波长下能较好反映各成分的紫外吸收,色谱信息丰富且基线平稳,因此选择280 nm为丹参茎叶UPLC指纹图谱的检测波长。按照“2.1.2”项下UPLC-QTOF/MS分析条件,对上述混合对照品溶液及供试品溶液进行ES+、ES−扫描,发现ES+条件下响应信号较少,而在ES−条件下可以得到良好响应,便于检测,因此,丹参茎叶中特征峰成分采用ES−模式进行分析。
3.3 丹参茎叶指纹图谱评价本实验首次建立丹参地上茎叶指纹图谱,采用的UPLC-UV技术,能较全面反映样品中化学成分的信息,相对于常规HPLC建立指纹图谱,分析时间明显缩短,21 min即可完成分析,且灵敏度高,分离效率好。通过UPLC-QTOF/MS对各共有峰定性分析表明丹参地上茎叶醇提物中主要化学成分为丹酚酸类和黄酮类,提示可能为丹参茎叶发挥活血化瘀、抗氧化、保护肾损伤等作用的活性物质基础[13-14]。由12批丹参茎叶指纹图谱信息可知,各共有峰相对保留时间差异较小,而相对峰面积差异则较大,表明不同批次丹参茎叶样品中化学成分在量上存在较大差异。从表 4中共有峰相对峰面积结果可见,S7号丹参茎叶(产地江苏南京)与其他产地样品差异较大,主要表现在各化学成分量较低,因此说明江苏产丹参茎叶质量相对其他产地较差。综合相似度评价、聚类分析和PCA分析结果,总体来说,来自山西、陕西、河南等地的丹参茎叶聚为一类,而产地为山东的丹参茎叶样品与其他产地的样品存在一定差异,说明由于地域水土、气候等因素的影响,造成不同产地丹参茎叶样品在化学成分和积累量上存在一定差异。S2和S4均为采收期9月份的丹参茎叶,在聚类树状图中聚为一类,因此要规范丹参茎叶质量,必须规范其适宜采收期。研究表明本实验建立的方法简便、准确、可靠,可为丹参茎叶资源的合理应用及产品开发提供科学依据。
| [1] | Su C Y, Qian L M, Khalid R, et al. Salvia miltiorrhiza:Traditional medical uses, chemistry, and pharmacology[J]. Chin J Nat Med, 2015, 13(3): 163–182. |
| [2] | 周晓希, 孔羽, 魏宇昆, 等. RP-HPLC-DAD同时测定丹参及丹参片中6种水溶性成分的含量[J]. 中药材, 2014, 37(2):337–339. |
| [3] | Ma P D, Liu J Y, Zhang C L, et al. Regulation of water-soluble phenolic acid biosynthesis in Salvia miltiorrhiza Bunge[J]. Appl Biochem Biotechnol, 2013, 170(6): 1253–1262. DOI:10.1007/s12010-013-0265-4 |
| [4] | 沙秀秀, 宿树兰, 沈飞, 等. 不同生长期丹参茎叶及花序中丹酚酸类化学成分的分布与积累动态分析评价[J]. 中草药, 2015, 46(22):3414–3419. |
| [5] | 史国玉, 郭庆梅, 周凤琴. 丹参叶的化学成分研究[J]. 山西大学学报, 2015, 38(4):692–695. |
| [6] | Zhang Q, Chang Z, Yang J, et al. Antiatherogenic property of triterpenoids-enriched extract from the aerial parts of Salvia miltiorrhiza[J]. Phytother Res, 2008, 22(8): 1040–1045. DOI:10.1002/ptr.2426 |
| [7] | 张寒, 贾敏, 杨颖. 丹参地上部分抗脑缺血活性部位筛选[J]. 中药药理与临床, 2013, 29(3):133–136. |
| [8] | 李大伟, 蔡洪信, 张玲, 等. 白花丹参叶水提物对糖尿病大鼠糖化血红蛋白的影响[J]. 中成药, 2008, 30(5):764–766. |
| [9] | 沙秀秀, 戴新新, 宿树兰, 等. 丹参茎叶药材的质量标准研究[J]. 药物分析杂志, 2016, 36(6):1096–1100. |
| [10] | 韦卓纯, 姚志红, 王其意, 等. UPLC结合化学计量学方法的肿节风指纹图谱研究[J]. 中草药, 2015, 46(6):895–900. |
| [11] | 赵洪芝, 王静, 姜民, 等. 丹参总酚酸提取物UPLC指纹图谱及成分定性研究[J]. 药物分析杂志, 2012, 32(4):620–622. |
| [12] | 宿树兰, 叶亮, 尚尔鑫, 等. 基于层次聚类分析与数据图形化技术探讨少腹逐瘀汤与温经汤的组方配伍特点[J]. 中华中医药杂志, 2011, 26(10):2228–2233. |
| [13] | 赵琪, 冯春玲, 孙玉珍, 等. 丹参多酚酸盐治疗老年糖尿病肾病的临床研究[J]. 现代药物与临床, 2015, 30(4):441–444. |
| [14] | Chen H, Zhang Q, Wang X M, et al. Qualitative analysis and simultaneous quantification of phenolic compounds in the aerial parts of Salvia miltiorrhiza by HPLC-DAD and ESI/MSn[J]. Phytochem Anal, 2011, 22(3): 247–257. DOI:10.1002/pca.v22.3 |
 2017, Vol. 48
2017, Vol. 48


