缺血性心脏病(ischemic heart disease,IHD)是由于冠状动脉循环改变引起冠状血流和心肌需求之间不平衡而导致的心肌损害[1]。治疗性血管新生能够促进缺血局部新生血管的形成和开放新的侧支循环通路,完成心肌缺血区域血管的自我搭桥,增加缺血区的血流供应,从而减少心肌的损伤。黄芪为传统的补气药,川芎为血中气药,专行血中之气,黄芪配伍川芎补气行气、化瘀通络,针对气虚血瘀之胸痹标本同治。川芎有效单体川芎嗪具有抗心肌缺血及再灌注损伤、保护血管内皮细胞、抗血小板聚集等作用[2]。黄芪中的黄芪甲苷可能具有促进血管生成的作用,从而有利于冠心病侧支循环的形成,减轻心肌缺血缺氧[3]。川芎嗪注射剂与黄芪甲苷注射剂在临床中常被合用治疗缺血性心脏病[4, 5],研究表明,两药合用一方面可通过减少再灌注过程中超氧化物歧化酶(SOD)的消耗,清除氧自由基,减少心肌损伤后心肌酶释放,保护再灌注损伤的心肌,另一方面还可促进缺血区域局部新生血管的形成[6]。然而二药配伍促进新生血管机制尚不明确,因此本实验通过体外培养人脐静脉内皮细胞(humanumbilical vein endothelial cells,HUVECs),采用缺氧损伤模型,探讨二药配伍促缺血心肌新生血管的作用及其机制,为二药临床联合应用提供理论依据。
1 材料 1.1 细胞HUVECs购自上海澳赛尔斯生物技术有限公司。
1.2 仪器Thermo Electron Corporation法国生物安全柜;MCO-18AIC二氧化碳培养箱(日本三洋公司);荧光倒置显微镜(日本Olympus公司);酶标仪(美国伯乐公司);Power Pac Basic电泳仪(美国 Bio-rad 公司);荧光定量PCR(RT-PCR)仪(韩国BIONEER公司);缺氧小室(billups-rothenberg)。
1.3 药品与试剂川芎嗪,质量分数≥98%,批号GR-133-150103,南京广润生物制品有限公司;黄芪甲苷,质量分数≥98%,批号150202,成都锦泰和医药化学技术有限公司;二甲基亚砜(DMSO),批号DH105-2,美国Sigma公司;完全培养基,批号H-004160411,澳赛尔斯生物技术有限公司;基础培养基,批号H-004B160418,澳赛尔斯生物技术有限公司;胎牛血清(FBS),批号1082763,Gibco公司;胰蛋白酶1∶250,批号42H10121,北京鼎国昌盛生物技术有限责任;噻唑蓝(MTT),美国Sigma公司;台盼蓝,上海恒远生物科技有限公司;EDTA-Na2,批号37H13064,北京鼎国昌盛生物技术有限责任公司;血管内皮生长因子(VEGF)抗体,批号WL0009,Wanleibio公司,血管紧张素-II(Ang-II)抗体,批号bs-0587,RBioss公司。
2 方法 2.1 MTT法检测川芎嗪与黄芪甲苷配伍对缺氧损伤HUVECs细胞增殖的影响HUVECs以1×105个/mL接种于96孔板,每孔200 μL,37 ℃、5%CO2、饱和湿度的培养箱中培养,48 h后分别加入不同的药物:DMSO(模型组),川芎嗪(80 μg/mL),黄芪甲苷(40 μg/mL),川芎嗪(80 μg/mL)+黄芪甲苷(40 μg/mL),缺氧小室(1% O2-5% CO2-94% N2)培养24 h,对照组(细胞加培养液)在培养箱中培养24 h。每孔加入MTT溶液(5 mg/mL)20 μL,37 ℃继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加入150 μL DMSO,振荡10 min,选择490 nm波长,在酶联免疫检测仪上测定各孔吸光度(A)值,计算细胞存活率(细胞存活率=给药组A值/对照组A值)。
2.2 激光共聚焦检测川芎嗪与黄芪甲苷配伍对缺氧损伤HUVECs细胞形态的影响HUVECs以1×105/mL孔接种于24孔板(多聚赖氨酸处理过的细胞爬片置于其中),5% CO2、37 ℃孵育48 h后,按“2.1”项方法处理后使用4%多聚甲醛溶液进行细胞固定,室温固定10 min,取200 μL配制好的FITC标记鬼笔环肽工作液(浓度100 nmol/L),覆盖住盖玻片上的细胞,室温避光孵育30 min,用PBS清洗盖玻片3次,每次5 min,使用200 μL DAPI溶液(浓度100 nmol/L)对细胞核进行复染,约30 s,共聚焦显微镜下进行荧光观察。
2.3 免疫组化法检测川芎嗪与黄芪甲苷配伍对缺氧损伤HUVECs细胞VEGF和Ang-II蛋白表达的影响将HUVECs按1×105个/孔铺于24孔板中(多聚赖氨酸处理过的细胞爬片置于其中),按照“2.1”项方法处理后,PBS清洗,4%多聚甲醛固定20 min、脱水和冲洗后,先后加入过氧化酶阻断溶液,非免疫山羊血清等孵育,冲洗后加入羊抗人VEGF、Ang-II的第一抗体,4 ℃湿盒过夜孵育后,PBS清洗标本,再根据试剂盒说明书加入生物素标记二抗室温孵育,加DAB溶液显色,苏木素复染,常规梯度乙醇(70%、80%、90%乙醇5 min×1,95%乙醇5 min×2,100%乙醇5 min×3)脱水之后,二甲苯透明,50%明胶封片。取片观察,并采用Motic Images Advanced 3.2图像分析系统进行灰度扫描,计算灰度值以分析其表达。
2.4 Western blotting法检测VEGF和Ang-II蛋白表达将HUVECs按1×105个/孔铺于6孔板中,按照“2.1”方法处理后,弃去上清,每孔加入100 μL蛋白裂解液,混合均匀2 000 r/min,4 ℃,离心10 min。调整总蛋白含量一致后,取上清后加入5×Loading Buffer蛋白上样缓冲液,沸水煮5 min使充分变性。电泳分离蛋白后,转膜至PVDF膜,室温封闭1 h,经TBS-T漂洗后,4 ℃孵育VEGF(1∶500)、Ang-II(1∶500)和β-actin,12 h后使用TBS-T漂洗。加入二抗羊抗兔IgG-HRP室温孵育2 h,TBST漂洗后进行化学发光。
2.5 RT-PCR法检测VEGF和Ang-II mRNA的表达将HUVECs按1×105个/孔铺于6孔板中,按照“2.1”项方法处理后,按照Simply P总RNA提取试剂盒说明书方法提取总RNA;用BioSpec-nano检测浓度;从基因库Gene Bank中查出β-actin引物序列、VEGF mRNA引物序列、Ang-II mRNA引物序列,由奥科鼎盛生物合成相应引物(表 1),将RNA逆转录成cDNA按照两步法BioRT逆转录扩增试剂盒说明书方法;采用3步法程序按照BioEasy SYBR Green I RT-PCR Kit Manual说明书进行荧光定量PCR扩增。目标基因表达相对定量分析采用2−ΔΔCt法。
|
|
表 1 RT-PCR引物序列 Table 1 Primer pairs used in RT-PCR |
2.6 统计学处理
本实验数据采用SPSS 18.0软件进行统计学处理,实验结果以x±s表示,采用单因素方差分析进行组间数据比较。
3 结果 3.1 对缺氧损伤HUVECs细胞增殖的影响模型组细胞存活率显著低于空白对照组(P<0.001)。川芎嗪、黄芪甲苷组细胞存活率明显增加。二药配伍后较单独给药组细胞存活率明显增加,有极显著差异(P<0.001),由此显示川芎嗪与黄芪甲苷二药配伍有协同作用。结果见表 2。
|
|
表 2 川芎嗪、黄芪甲苷及二者配伍对缺氧损伤HUVECs细胞增殖的影响 (x±s±s,n = 6) Table 2 Effect of ligustrazine,astragaloside IV,and their combination on proliferation of HUVECs injuried by hypoxia (x±s,n = 6) |
3.2 对缺氧损伤HUVECs细胞形态的影响
空白对照组细胞贴壁良好,细胞呈梭形,边缘光滑清晰。模型组细胞呈现萎缩状态,细胞数较对照组明显减少,可见大量细胞悬浮和细胞碎片;川芎嗪组、黄芪甲苷组、二者配伍组细胞形态似对照组,细胞数量增加,细胞碎片和悬浮细胞显著减少。见图 1。
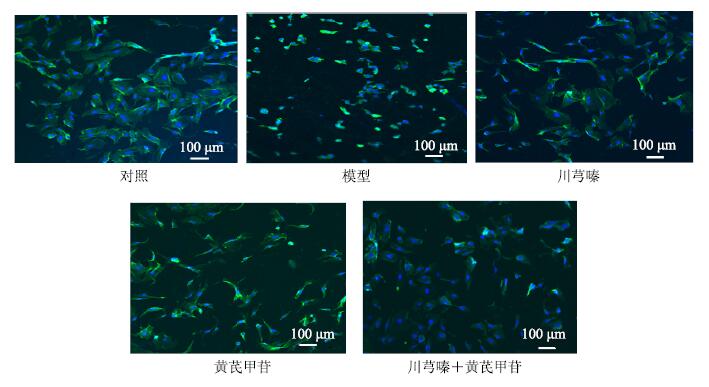
|
图 1 川芎嗪、黄芪甲苷及二者配伍对缺氧损伤HUVECs细胞形态的影响 Fig.1 Effects of ligustrazine,astragaloside IV,and their combination on morphology of HUVECs injured by hypoxia |
3.3 对缺氧损伤HUVECs细胞VEGF、Ang-II蛋白表达的影响
VEGF与Ang-II主要在血管内皮细胞胞浆中表达,阳性反应为产生棕黄色颗粒。灰度扫描将纯黑色定义为灰度值为0,把白色定义为255。结果显示,模型组VEGF与Ang-II在缺氧条件下阳性表达程度强于对照组(P<0.05),黄芪甲苷与配伍组均可进一步提高VEGF与Ang-II阳性表达(P<0.001)。结果见图 2和表 3。
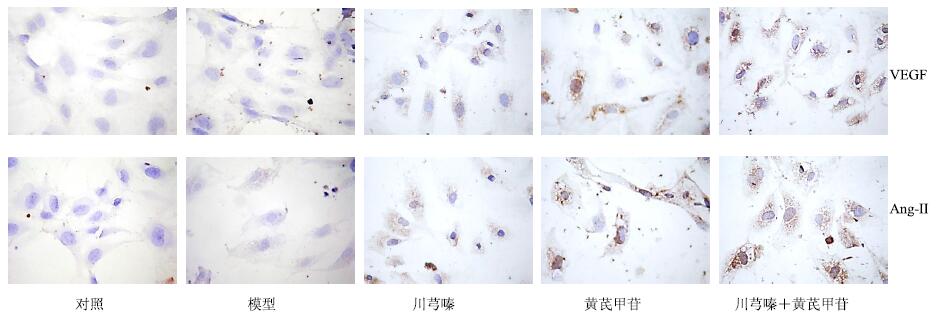
|
图 2 川芎嗪、黄芪甲苷及二者配伍对缺氧损伤HUVECs细胞VEGF和Ang-II蛋白表达的影响 (免疫组化法) Fig.2 Effects of ligustrazine,astragaloside IV,and their combination onprotein expression of VEGF and Ang-II in HUVECs injured by hypoxia (immunohistochemical staining) |
|
|
表 3 各组VEGF、Ang-II蛋白表达灰度分析结果 (x±s±s,n = 6) Table 3 Results of levels of VEGF and Ang-II in each group (x±s,n = 6) |
3.4 Western blotting检测VEGF和Ang-II蛋白表达结果
Western blotting结果显示,模型组在缺氧条件下与对照组相比,VEGF蛋白表达无明显变化,Ang-II蛋白表达增加,但无显著差异。各给药组VEGF蛋白表达明显增加,川芎嗪与黄芪甲苷配伍组差异极显著(P<0.001)。川芎嗪与黄芪甲苷配伍组Ang-II蛋白表达较模型组进一步增加,差异极显著(P<0.001)。结果表明,川芎嗪与黄芪甲苷配伍保护缺氧损伤内皮细胞,可能与增加VEGF和Ang-II蛋白表达相关。结果见图 3。
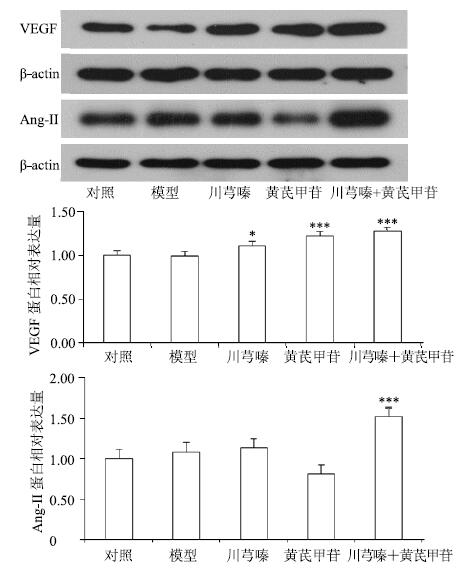
|
与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下同 *P < 0.05 **P < 0.01 ***P < 0.001 vs model group,same as below 图 3 各组缺氧损伤HUVECs细胞VEGF和Ang-II蛋白表达水平 (Western blotting,x±s±s,n = 6) Fig.3 Protein expression of VEGF and Ang-II in HUVECs injured by hypoxia of each group (Western blotting, x±s±s,n = 6) |
3.5 对VEGF和Ang-II mRNA表达的影响
RT-RCR结果显示,模型组与对照组相比,VEGF和Ang-II mRNA表达增加,但是无显著差异。黄芪甲苷与配伍组VEGF mRNA表达明显增加(P<0.01),各给药组Ang-II mRNA表达显著增加(P<0.001)。结果见图 4。以上实验表明,川芎嗪与黄芪甲苷配伍保护缺氧损伤内皮细胞,可能与上调VEGF和Ang-II mRNA表达相关。

|
图 4 川芎嗪、黄芪甲苷及二者配伍对缺氧损伤的HUVECs细胞VEGF和Ang-II mRNA表达的影响 (x±s±s,n = 6) Fig.4 Effect of ligustrazine,astragaloside IV,and their combination on mRNA expression of VEGF and Ang-II in HUVECs injuried by hypoxia (x±s±s,n = 6) |
4 讨论
朱丹溪曰:“新血生则瘀血滑而易去”;清代唐容川谓“盖瘀血去新血已生,新血生瘀血自去,其间初无间隔……”。“生新祛瘀”作为治疗胸痹的治则治法在临床应用中是行之有效的。“生新”既代表了新的血液,生新祛瘀是机体的正常生理功能,相当于血液系统的新陈代谢,从现代医学角度也可以理解为新的血管的再生。血管生成是一个复杂的病理生理过程,血管内皮细胞是“祛瘀生新”作用的主要执行者之一。同时受到多种促进和抑制血管生成的因子调控,以调节血管功能以及发“祛瘀新生”作用。活血化瘀方药具有较好的促进血管新生的作用,可能对冠状动脉血管侧支形成有比较理想的药理效应。益气活血法是治疗冠心病的基本法则。研究者[3]提出某些益气活血中药可能具有促进血管生成的作用,从而有利于冠心病侧支循环的形成,减轻心肌缺血缺氧。黄芪为传统的补气药,川芎为血中气药,黄芪伍川芎补气行气、化瘀通络。本实验采用缺氧诱导HUVECs损伤,按照前期活性筛选结果[7],优选川芎嗪与黄芪甲苷最佳浓度,考察二药配伍对缺氧损伤细胞的保护作用,MTT与细胞形态实验结果表明,川芎嗪组、黄芪甲苷组、配伍组均能提高细胞存活率,保护受损细胞,且川芎嗪与黄芪甲苷配伍有协同作用。
在缺血性心脏病的研究中,VEGF和血管生成素(angiopoietin,Ang)家族是目前发现参与血管生成发挥重要作用的两个因子,二者在多种病理过程中有协同作用,共同参与血管生成的调节。VEGF是一类具有特异性促内皮细胞有丝分裂作用的生长因子,主要通过与血管内皮细胞上的VEGF受体结合而发挥促进内皮细胞增殖的作用,促进血管新生[8]。VEGF除由血管内皮细胞分泌外,缺血和缺氧是诱导其表达上调的强烈因素之一[9]。Ang是一族能刺激新血管生长的蛋白分子,研究表明,Ang对血管生成的影响和局部微环境有关,当VEGF等促血管生成因子存在时,Ang-II竞争抑制Ang-I效应,促进血管结构松解,消除血管基底膜和周围细胞对血管形成的限制,并增加内皮细胞对VEGF等的敏感性,形成新的毛细血管[10-13]。因此考察VEGF与Ang-II在缺氧内皮细胞的表达,对研究缺血性心脏病具有重要意义[14]。本研究免疫组化、Western boltting法和RT-PCR法,从蛋白及mRNA水平上检测缺氧细胞内VEGF、Ang-II的表达情况,结果显示VEGF、Ang-II在正常血管内皮细胞中仅有少量的表达,在缺氧条件下有明显的增高,启动细胞内源性保护机制,有利于缺氧细胞增殖,川芎嗪与黄芪甲苷给药后可进一步提高蛋白VEGF及Ang-II在缺氧细胞中的表达,而促血管生成因子VEGF及Ang-II蛋白表达增高,可能是药物通过激活相应的信号传导通路减少内皮细胞凋亡,促进内皮细胞增生,促进血管新生,利于侧枝循环的建立,改善组织供血,是川芎嗪与黄芪甲苷保护血管内皮细胞的机制之一。
| [1] | Shohet R V, Gareia J A. Keeping the engine primed:HIF factors as key regulators of cardiac metabolism and angiogenesis during ischemia[J]. J Mol Med, 2007, 85(12): 1309–1315. DOI:10.1007/s00109-007-0279-x |
| [2] | 王振涛, 韩丽华, 朱明军, 等. 川芎嗪注射液促心梗后大鼠缺血心肌血管新生作用及对相关生长因子影响的研究[J]. 辽宁中医杂志, 2006, 33(7):888–890. |
| [3] | 戴瑞鸿, 李勇. 冠心病心肌缺血的治疗性血管生成与中药[J]. 中国中西医结合杂志, 2000, 20(3):163–164. |
| [4] | 孙秀梅, 张立永, 张燕. 川芎嗪和黄芪注射液对家兔急性心肌缺血心电图的影响[J]. 河北北方学院学报, 2010, 26(5):47–51. |
| [5] | 宋丽华, 汤碧娥, 张宁, 等. 黄芪配伍川芎嗪抗心肌缺血再灌注损伤的研究[J]. 金华职业技术学院学报, 2007, 7(6):45–48. |
| [6] | 杨珍, 周惠芬, 周鹏, 等. 川芎、黄芪有效成分配伍对缺氧脑微血管内皮细胞的影响[J]. 中草药, 2015, 46(9):1326–1332. |
| [7] | 李玉梅, 杨辛欣, 韩旭, 等. 川芎嗪与黄芪甲苷配伍对过氧化氢诱导人脐静脉内皮细胞氧化损伤的保护作用及机制[J]. 中药新药与临床药理, 2017, 28(1):18–23. |
| [8] | Amano H, Kato S, Ito Y, et al. The role of vascular endothelial growth factor receptor-1 signaling in the recovery from ischemia[J]. PLoS One, 2015, 10(7): 503–509. |
| [9] | Greenberg J I, Shields D J, Barillas S G, et al. A role for VEGF as a negative regulator of pericyte function and vessel maturation[J]. Nature, 2008, 456(7223): 809–813. DOI:10.1038/nature07424 |
| [10] | Sinnathamby T, Yun J, Clavetlanthier M É, et al. VEGF and angiopoietins promote inflammatory cell recruitment and mature blood vessel formation in murine sponge/matrigel model[J]. J Cell Biochem, 2015, 116(1): 45–57. DOI:10.1002/jcb.v116.1 |
| [11] | Brudno Y, Ennettshepard A B, Chen R R, et al. Enhancing microvascular formation and vessel maturation through temporal control over multiple pro-angiogenic and pro-maturation factors[J]. Biomaterials, 2013, 34(36): 9201–9209. DOI:10.1016/j.biomaterials.2013.08.007 |
| [12] | Timke C, Zieher H, Roth A. Combination of vascular endothelial growth factor receptor/platelet-derived growth factor receptor inhibition markedly improves the antiangiogenic efficacy for advanced stage mouse corneal neovascularization[J]. Graefes Arch Clin Exp Ophthalmol, 2011, 249(10): 1493–1501. DOI:10.1007/s00417-011-1709-6 |
| [13] | Lobov I B, Brooks P C, Lang R A, et al. Angiopoietin-2 displays VEGF-dependent modulation of capillary structure and endothelial cell survival in vivo[J]. Proc Natl Acad Sci USA, 2002, 99(17): 11205–11210. DOI:10.1073/pnas.172161899 |
| [14] | 李娜, 吴世政, 张淑坤, 等. 脉络宁注射液对人血管内皮细胞缺氧损伤的保护作用[J]. 中国新药杂志, 2012, 21(11):1273–1277. |
 2017, Vol. 48
2017, Vol. 48


