微生物是药物的重要来源之一,特别是抗生素和抗癌药物很多都来源于微生物。有学者研究发现,所有生命的共同祖先是一个原生物[1],在其漫长的进化过程中产生2个重要分支,一个是原核生物(细菌和古菌),一个是原真核生物。从生物进化的角度,微生物可以说是一切生物的祖先,在地球上出现的时间远远早于人类。曾有人形象地做过一个比喻,如果把地球的年龄视作一年,那么微生物大约在3月20日诞生,而人类则大约在12月31日下午7时许才出现在地球上。微生物和人类有共同的祖先,具有更长的进化史,其来源丰富、种类众多,代谢产物的多样性更是难以估量,因此从中分离出具有抗感染作用的抗生素也就不足为奇了。
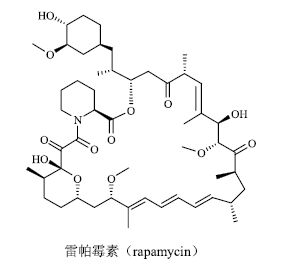
雷帕霉素(rapamycin,rapamune,图 1)又名西罗莫司(sirolimus),从结构上讲为大环内酯类化合物,来源于只存在于复活节岛上的一种微生物Streptomyces hygroscopicus,是链霉素(streptomycin) 来源微生物Streptomyces griseus的近亲,链霉菌属Streptomyces中产生了2个伟大的药物。1999年9月,美国食品药品管理局(US Food and Drug Administration,FDA)批准将雷帕霉素作为免疫抑制剂用于肾移植抗排异治疗,商品名为Rapamune。2015年5月FDA批准雷帕霉素作为孤儿药用于治疗罕见的淋巴管肌瘤(lymphangioleiomyomatosis,LAM),这也是第一个获批准用于这类罕见病的药物。2016年7月美国化学与工程新闻杂志(Chemical & Engineering News)在封面报道了这个神奇的药物(图 2)[2]。2016年9月21日汤森路透(Thomson Reuters)更是预测发现雷帕霉素作用靶点和作用机制的3位生物化学家可能获得2016年度诺贝尔化学奖。虽然最终3位科学家没有获得2016年诺贝尔奖,但他们对雷帕霉素的研究成果意义重大。而对发现雷帕霉素做出重要贡献的微生物学家Georges L. Nógrady(1919—2013,图 3)与化学家Surendra N.Sehgal(1932—2003,图 3)博士均已过世,本文对雷帕霉素进行简要介绍,并以此纪念这2位逝去的科学家。
|
图 1 雷帕霉素的化学结构 Fig.1 Chemical structure of rapamycin |

|
图 2 2016年7月美国化学与工程新闻杂志封面 Fig.2 Cover of Chemical & Engineering News,July 18,2016 |

|
图 3 Stanley C. Skoryna医生、Georges L.Nógrad和Surendra N. Sehgal博士 (从左至右) Fig.3 Dr. Stanley C. Skoryna,Georges L. Nógrad,and Dr. Surendra N. Sehgal (from left to right) |
1 雷帕霉素的发现与研发
遥远而神秘的复活节岛位于东南太平洋上,面积约117平方公里,形状近似三角形,由3座火山组成,距离最近的陆地约2 000多公里,是一个与世隔绝的孤岛。当地居民将该岛称作Rapa Nui或Te Pito te Henua(意为“世界之脐”)。岛上矗立着1 000余座古代巨石像“摩埃(moai)”,复活节岛因此闻名于世,而雷帕霉素的故事也起源于这些巨人石像(图 4)。

|
图 4 含雷帕霉素来源微生物土壤样本的采集地复活节岛(A) 与雷帕霉素发现纪念铭牌 (B) Fig.4 Easter Island (A) and a plaque (B) on island commemorates discovery of rapamycin |
1964年国际卫生组织(World Health Organization)和加拿大医学会(the Medical Research Council of Canada)组织的一个由麦吉尔大学(McGill University)外科医生Stanley C. Skoryna(1920—2003,图 3)率领的由医生和科学家组成的40余人科学考察探测队(Medical Expedition to Easter Island,METEI)乘加拿大海军HMCS Cape Scott号于1964年11月16日从爱德华王子岛(Halifax)出发到南太平洋的复活节岛开始了为期4个月的科学考察,科考队此行目的是研究岛上原住民的遗传性、生活环境和常见疾病[3]。在科考队中,来自加拿大蒙特利尔大学(Université de Montreal)的微生物学家Georges L. Nógrad负责采集植物和收集土壤标本。他发现岛上的居民不患破伤风,这种感染经常在有马匹的地方发生,但是在复活节岛上不仅马匹数量众多,而且当地居民从不穿鞋,赤脚会大大增加接触破伤风孢子的机会。为了探明其中的原因,Georges L. Nógrad从复活节岛上采集了60余份土壤样品进行研究,却仅在一份样品中发现了破伤风孢子,随后他停止了分离工作,并将样品转交给了位于蒙特利尔的Ayerst制药公司研究中心。从此经历了几年的曲折之后,才由当时在Ayerst公司工作的Surendra N. Sehgal博士从中发现了雷帕霉素。
Surendra N. Sehgal出生在巴基斯坦一个名叫Khushab的小村庄,印巴分治后举家迁往印度新德里。1957年于英国获得博士学位后前往加拿大作博士后(National Research Council of Canada,Ottawa),1959年加入Ayerst-McKenna-Harrison研究所的微生物研究室(Claude Vézina博士团队)从事微生物天然产物研究。1972年Sehgal从复活节岛土壤样品中的细菌Streptomyces hygroscopicus代谢物里分离出一种物质,发现其具有很好的抗炎作用[4-6],为了纪念其发现地,Sehgal取当地语言对复活节岛的称谓“Rapa Nui”,将这种物质命名为rapamycin(雷帕霉素)。Sehgal把雷帕霉素样品送到美国癌症研究所(National Cancer Institute),发现其对实体肿瘤也具有很好的抑制作用[7]。此后,雷帕霉素的化学结构通过X射线衍射法得到了确定[8-9]。
但是由于Ayerst公司内外种种原因,对于雷帕霉素的研究并没有沿着药物开发的方向深入进行,相反1983年公司关闭了在蒙特利尔的研究所,剩下部分核心人员转移到了新泽西的普林斯顿,雷帕霉素的研究与开发计划也一度中止,Sehgal只能把雷帕霉素样品放在家中的冰柜里储存,直到1987年Wyeth(惠氏)和Ayerst两家公司合并后,此项研究才开始有了转机。1988年,Sehgal终于说服新的管理层,关于雷帕霉素的研究得以继续。Sehgal及其团队很快发现雷帕霉素除了具有抗炎活性外还具有抑制免疫系统的作用[10]。
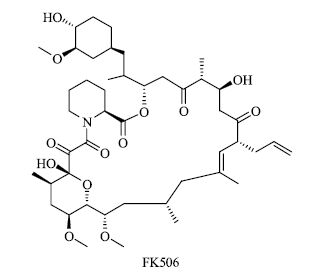
20世纪80年代是抑制自身免疫药物热潮期,1983年作为诺华(Novartis)集团成员之一的山德士(Sandoz)公司刚刚研发了第1个器官移植免疫抑制剂环孢霉素(cyclosporin A),并很快成为公司的重磅产品。与此同时,1987年日本藤泽(Fujisawa)制药也报道了他们从土壤微生物Streptomyces tsukubaensis中得到的免疫抑制剂FK-506(图 5),其结构一半与雷帕霉素相同[11]。20世纪80年代末期到90年代初期,FK-506的活性研究完成,很快在1994年作为第1个大环内酯免疫抑制剂被美国FDA批准上市,通用名为Tacrolimus(他克莫司),最初作为肝脏的器官移植免疫抑制剂,后来扩展到其他类型的器官移植。在FK-506活性和结构的启示下,惠氏公司的药物化学家和药理学家都对雷帕霉素产生了浓厚的兴趣,他们把研究焦点放在剂型开发上,成功制备出雷帕霉素口服剂。
|
图 5 FK506的化学结构 Fig.5 Chemical structure of FK506 |
1998年12月15日雷帕霉素临床试验即将完成时,惠氏公司向美国FDA递交了新药申请(new drug application);1999年2月1日,雷帕霉素获得FDA优先评价资格(priority review status),并于7月27日通过了评审;1999年9月15日,距递交新药申请仅仅过了9个月,惠氏公司拿到了FDA正式批文,随后在加拿大等国家相继批准了该药的使用。2009年惠氏被辉瑞(Pfizer)收购,雷帕霉素被重新包装为rapamune(雷帕鸣)、sirolimus(西罗莫司)。
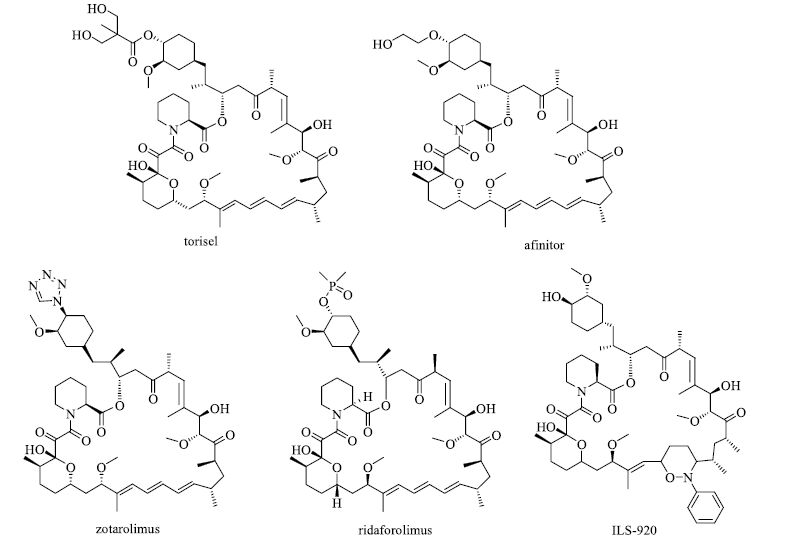
2 雷帕霉素的衍生物20世纪80年代当雷帕霉素抑制肿瘤生长的活性被发现后,化学家们开始着手对其进行化学结构改造以求获得更好的抗癌药物。在此之前,惠氏公司与哥伦比亚大学(Columbia University)合作进行了雷帕霉素与靶标蛋白结合的实验,以指导在分子的哪些部位修饰能不改变其抗肿瘤活性。这时,几个不同的实验室均研究发现雷帕霉素可以结合2个截然不同的蛋白FKBP12和mTOR(图 6)[2]。为了避免干扰雷帕霉素与靶标的相互作用,化学家确定先从在雷帕霉素外围上的环己烷环进行修饰。从化学的角度分析,雷帕霉素的环己烷结构上的羟基非常适宜衍生出新化合物,而不影响与2个蛋白的结合,这种策略催生出了多项成果[12]。很快,惠氏开发了雷帕霉素的酯衍生物Torisel/temsirolimus(驮瑞塞尔/ 坦西莫司,CCI-779,图 7),用于治疗肿瘤,2007年5月被FDA批准为治疗肾癌的药物,现在同样为辉瑞公司的产品。2007年11月被欧盟(European Medicines Agency,EMEA)批准。2010年也被日本批准,在美国国家健康研究所(NHI)的资助下其他各种癌症的临床研究也正在进行当中。

|
外围的羟基(红色和白色)是设计第一代雷帕霉素类似物的关键官能团,它指向2个靶标的外面 Hydroxyl group (in red and white),key for making the first generation of rapalogs,pokes out from between the two 图 6 雷帕霉素结合FKBP12 (蓝色) 和mTOR (绿色) 的晶体结构 Fig.6 Crystal structure of rapamycin bound to FKBP12 (blue) and its binding domain in mTOR (green) |
|
图 7 几种基于雷帕霉素结构开发的大环内酯类药物的化学结构 Fig.7 Chemical structures of some rapamycin-based macrolide drugs |
2014年雷帕霉素的专利已经过期,惠氏的竞争对手也在加紧雷帕霉素的环己烷羟基衍生物的开发,由于作用靶标特殊,现在仍有雷帕霉素衍生物作为新型抗肿瘤药物被科学家研究。Afinitor/ everolimus(飞尼妥/依维莫司,RAD001,Votubia,图 7)[13-14]是诺华公司合成的雷帕霉素类似物,早在2004年就被批准作为免疫抑制剂使用,随后在2009年又首先得到作为肾癌药物的批准,并在2010—2012年分别被批准成为治疗脑肿瘤、胰腺癌和乳腺癌的药物,2015年全球销售额超过19亿美元,成为公司的重磅产品。Zotarolimus(佐他莫司,ABT-578,图 7)是雷帕霉素的一个活性代谢产物,2005年由美国美敦力(Medtronic)研发作为洗脱支架中的携带药物治疗血管再狭窄(arterial restenosis)。Merck(默克)和Ariad联合开发的雷帕霉素的衍生物ridaforolimus(AP23573,MK-8669,deforolimus,图 7)目前在作III期临床试验,主要用于软组织瘤和骨癌的治疗。惠氏制备的雷帕霉素衍生物ILS-920(WAY-265920,图 7)对原化合物结构改动较大,通过改变骨架上的共轭三烯键进而改变了雷帕霉素的作用靶点[15-16],ILS-920治疗急性缺血性脑卒中的I期临床试验正在进行当中。
3 雷帕霉素的作用靶点自1990年起,山德士公司科学家发现雷帕霉素能够阻断细胞内管理生长与代谢的通道。这一通道被发现存在于从单细胞酵母到人体各种生物细胞,在发现雷帕霉素对酵母和人类细胞都具有抑制作用后,研究人员意识到调控生长的基因是一个在长期进化中保留下来的高度保守(highly conserved)基因。1991年,瑞士巴塞尔大学(University of Basel)Michael N. Hall教授(1953—,图 8)在对雷帕霉素耐药突变酵母的遗传及分子生物学研究中发现了通过与雷帕霉素作用对细胞生长和代谢产生影响的关键调控蛋白质,并将其命名为“雷帕霉素靶标(target of rapamycin)”或TOR[17-19]。Hall博士因此获得了2014年的生命科学突破奖(Breakthrough Prize in Life Sciences)和2014年欧洲研究委员会(European Research Council,ERC)Synergy Grant研究经费,并在2014年被评为美国科学院院士(Member of the National Academy of Sciences USA)。

|
图 8 Michael N. Hall教授、Stuart L. Schreiber教授和David M. Sabatini教授 (从左至右) Fig.8 Prof. Michael N. Hall,Prof. Stuart L. Schreiber,and Prof. David M. Sabatini (from left to right) |
特别值得一提的是美国哈佛大学的Stuart L. Schreiber教授(1956—,图 8),早年曾完成一系列大环内酯类复杂天然产物的全合成工作,20世纪90年代起,开始利用小分子探针(small-molecule probes)作为工具,在探索药物作用机制、发病原理等方面做出了开拓性工作,他也被视为化学生物学(chemical biology)这门新兴学科的创始人之一[20]。Schreiber教授长期致力于FK-506、雷帕霉素作用机制的研究[21-25],1994年,Schreiber团队在哺乳动物(mammalian)细胞中发现了TOR相同的雷帕霉素靶点则被命名为mTOR(mammalian target of rapamycin,mechanistic target of rapamycin)[26]。Schreiber教授1995年当选美国科学院院士,因其在化学生物学、分子生物学领域的一系列杰出贡献[20-28],Schreiber教授和Kyriacos C. Nicolaou教授分享了2016年度的Wolf奖(Wolf Prize)[29]。
麻省理工学院怀特黑德生物医学研究所(Whitehead Institute for Biomedical Research)和马赛诸塞技术研究所(Massachusetts Institute of Technology)的David M. Sabatini教授(1968—,图 8)也发现雷帕霉素在哺乳动物细胞中的蛋白靶标(mTOR,RAFT1)[30]。2004年Michael N. Hall研究发现[31],mTOR是2个多蛋白mTORC1和mTORC2的复合物,其中mTORC1包含mTOR、raptor(regulatory-associated protein of mTOR)和其他蛋白,主要调控细胞生长,而mTORC2则由mTOR、rictor(rapamycin-insensitive companion of mTOR)等部分组成,被认为能够促进细胞存活[32]。在对mTOR及其相关信号通路的研究过程中[33-35],Sabatini的团队发现rictor有调节细胞骨架重组作用[36, 37],rictor-mTOR复合体(mTORC2)能够直接激活其下游信号蛋白Akt,Akt则与癌症和糖尿病的发病机制息息相关[37],对于mTORC2感受胰岛素(insulin)信号的作用机制也进行了相关研究[38]。
雷帕霉素可与细胞中的蛋白FKBP12(FK506 binding protein 12)和mTOR结合形成复合物。通过对mTOR的结构与信号通路研究,进一步阐明了雷帕霉素的作用机制,mTOR能够如同中央处理器一样,调控包括氨基酸、糖类、胰岛素、瘦素、氧气等各种营养信号,从而使细胞凋亡或增殖。在mTOR的2种复合物(mTORC1和mTORC2)存在形式中,只有mTORC1对雷帕霉素敏感,通过调控营养物质信号,抑制mTOR,从而抑制了细胞增殖,显示出抗癌活性。同时,雷帕霉素与免疫蛋白FKBP12的结合,抑制了免疫B细胞和T细胞的生长,而抑制哺乳动物雷帕霉素靶蛋白(mTOR)通路,则能产生免疫抑制等作用[39-41]。
4 结语雷帕霉素靶蛋白(TOR)一经被发现,就引起了生物界的极大重视,2010年更被《科学》杂志评为十大最热门的研究领域,雷帕霉素作为TOR信号抑制剂的发现对于理解与治疗癌症具有重要意义,大量的新药研发开始长期关注于mTOR激酶调节剂的识别与开发,并由此得到了一系列作用机制不尽相同的mTOR抑制剂[42-45]。目前,关于雷帕霉素与TOR的研究取得了巨大的成就,已成为2016年诺贝尔化学奖的热门领域,由这些研究成果而开发出的一系列抗癌药物也已经获批上市,雷帕霉素不仅是一种新型免疫抑制剂,也是一种多用途药物,由于美国生产的雷帕霉素在我国未能获得行政保护,故国内企业可以对其进行生产。据了解,自2001年至今先后批准了7家企业生产雷帕霉素,其中浙江新昌制药厂、福建科瑞药业、杭州中美华东制药、华北制药科研开发公司4家为雷帕霉素原料药厂。获批准的雷帕霉素统一命名为“西罗莫司”。相信随着我国雷帕霉素原料药生产技术的不断改进和产量的提高,雷帕霉素将有望成为国内一类高速增长的药物品种,其市场空间巨大。
近年来,对于雷帕霉素新药理作用的探索一直没有停止。2009年,巴夏普长寿与衰老研究所(Barshop Institute for Longevity and Aging Studie)的Randy Strong实验室、Jackson实验室的David E. Harrison小组和密歇根大学安阿伯分校(University of Michiga,Ann Arbor VA Medical Cente)的Richard A. Mille实验室联合报道雷帕霉素可延长小鼠的寿命,研究发现雄性小鼠能延长9%的生命,而使雌性小鼠寿命延长了14%[46]。这几个相关机构在后续的研究中发现,雷帕霉素能够减缓肌腱硬化和肝脏功能退化的速度,恰恰是能延缓衰老的两大指标[47]。2014年,诺华制药在《科学•转化医学》(Science Translational Medicine)上报道,雷帕霉素能明显提高老年人免疫系统功能[48];同时雷帕霉素能对衰老引起的阿尔茨海默病(Alzheimer’s disease)具有治疗作用也得到了报道[49]。上述实验结果让雷帕霉素的抗衰老作用得到了高度关注,但是关于这个问题的结论仍在研究与讨论中。
天然产物作为化学和生物学之间一个天然的通道,是大自然经过漫长的筛选和进化选择出来的,来源多样且种类丰富,对天然产物的结构与功能研究将对新药发现、生命科学的认识、探索药物作用机制具有重要科学意义。作为20世纪后期问世的天然产物新药,雷帕霉素其研发过程是在当代制药工业迅猛壮大、科技水平飞速发展的时代背景下对天然产物进行科学探索与医药应用的一个经典实例。而近年来,对雷帕霉素作用靶标和新药理作用的研究也反映了目前科研领域和医药行业的前沿与热点,天然药物不仅作为新药用于治疗,也能成为分子生物学研究的重要工具,对天然药物深入而全面地研究能够促进药物研发与分子生物学的发展,具有极大的价值和广阔的前景[50-52]。
| [1] | Delaye L, Becerra A. Cenancestor, the last universal common ancestor[J]. Evolution Education Outreach, 2012, 5(3): 382–388. DOI:10.1007/s12052-012-0444-8 |
| [2] | Halford B. Rapamycin's secrets unearthed[J]. Chem Eng News, 2016, 94(29): 26–30. |
| [3] | Tector A. The delightful revolution:The canadian medical expedition to Easter Island, 1964-65[J]. Br J Can Stud, 2014, 27(2): 181–193. DOI:10.3828/bjcs.2014.12 |
| [4] | Vézina C, Kudelski A, Sehgal S N. Rapamycin (AY-22, 989), a new antifungal antibiotic. I. Taxonomy of the producing streptomycete and isolation of the active principle[J]. J Antibiotics, 1975, 28(10): 721–726. DOI:10.7164/antibiotics.28.721 |
| [5] | Sehgal S N, Baker H, Vézina C. Rapamycin (AY-22, 989), a new antifungal antibiotic. II. Fermentation, isolation and characterization[J]. J Antibiotics, 1975, 28(10): 727–732. DOI:10.7164/antibiotics.28.727 |
| [6] | Baker H, Sidorowicz A, Sehgal S N, et al. Rapamycin (AY-22, 989), a new antifungal antibiotic. III. In vitro and in vivo evaluation[J]. J Antibiotics, 1978, 31(6): 539–545. DOI:10.7164/antibiotics.31.539 |
| [7] | Eng C P, Sehgal S N, Vézina C. Activity of rapamycin (AY-22, 989) against transplanted tumors[J]. J Antibiotics, 1984, 37(10): 1231–1237. DOI:10.7164/antibiotics.37.1231 |
| [8] | Swindells D C N, White P S, Findlay J A. The X-ray crystal structure of rapamycin, C51H79NO13[J]. Can J Chem, 1978, 56(18): 2491–2492. DOI:10.1139/v78-407 |
| [9] | Findlay J A, Radics J. On the chemistry and high field nuclear magnetic resonance spectroscopy of rapamycin[J]. Can J Chem, 1980, 58(6): 579–590. DOI:10.1139/v80-090 |
| [10] | Sehgal S N, Molnar-Kimber K, Ocain T D, et al. Rapamycin:a novel immunosuppressive macrolide[J]. Med Res Rev, 1994, 14(1): 1–22. DOI:10.1002/(ISSN)1098-1128 |
| [11] | Tanaka H, Kuroda A, Marusawa H, et al. Structure of FK506, a novel immunosuppressant isolated from Streptomyces[J]. J Am Chem Soc, 1987, 109(16): 5031–5033. DOI:10.1021/ja00250a050 |
| [12] | Luengo J I, Yamashita D S, Dunnington D, et al. Structure-activity studies of rapamycin analogs:evidence that the C-7 methoxy group is part of the effector domain and positioned at the FKBP12-FRAP interface[J]. Chem Biol, 1995, 2(7): 471–481. DOI:10.1016/1074-5521(95)90264-3 |
| [13] | Sendur M A, Zengin N, Aksoy S, et al. Everolimus:a new hope for patients with breast cancer[J]. Curr Med Res Opin, 2014, 30(1): 75–87. DOI:10.1185/03007995.2013.846253 |
| [14] | Niraula S, Ocana A, Amir E. One step forward, two steps back:The story of everolimus in advanced breast cancer[J]. Breast, 2015, 24(5): 529–531. DOI:10.1016/j.breast.2015.04.006 |
| [15] | Ruan B, Pong K, Jow F, et al. Binding of rapamycin analogs to calcium channels and FKBP52 contributes to their neuroprotective activities[J]. Proc Natl Acad Sci, 2008, 105(1): 33–35. DOI:10.1073/pnas.0710424105 |
| [16] | Abou-Gharbia M, Childers W. Targeting neurodegenerative diseases:Drug discovery in a challenging arena[J]. Pure Appl Chem, 2012, 84(7): 1543–1556. |
| [17] | Heitman J, Movva N R, Hall M N. Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast[J]. Science, 1991, 253(5022): 905–909. DOI:10.1126/science.1715094 |
| [18] | Beck T, Hall M N. The TOR signalling pathway controls nuclear localization of nutrient-regulated transcription factors[J]. Nature, 1999, 402(6762): 689–692. DOI:10.1038/45287 |
| [19] | Wullschleger S, Loewith R, Hall M N. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3): 471–484. DOI:10.1016/j.cell.2006.01.016 |
| [20] | Polak P, Hall M N. mTOR and the control of whole body metabolism[J]. Current Ppinion Cell Biol, 2009, 21(2): 209–218. DOI:10.1016/j.ceb.2009.01.024 |
| [21] | Owens J. Stuart Schreiber:biology from a chemist's perspective[J]. Drug Discov Today, 2004, 9(7): 299–303. DOI:10.1016/S1359-6446(04)03063-6 |
| [22] | Harding M W, Galat A, Uehling D E, et al. A receptor for the immunosuppressant FK506 is a cis-trans peptidyl-prolyl isomerase[J]. Nature, 1989, 341(6244): 758–760. DOI:10.1038/341758a0 |
| [23] | Bierer B E, Mattila P S, Schreiber S L, et al. Two distinct signal transmission pathways in T lymphocytes are inhibited by complexes formed between an immunophilin and either FK506 or rapamycin[J]. Proc Natl Acad Sci, 1990, 87(23): 9231–9235. DOI:10.1073/pnas.87.23.9231 |
| [24] | Van Duyne G D, Standaert R F, Schreiber S L, et al. Atomic structure of the rapamycin human immunophilin FKBP-12 complex[J]. J Am Chem Soc, 1991, 113(19): 7433–7434. DOI:10.1021/ja00019a057 |
| [25] | Chen J, Zheng X F, Brown E J, et al. Identification of an 11-kDa FKBP12-rapamycin-binding domain within the 289-kDa FKBP12-rapamycin-associated protein and characterization of a critical serine residue[J]. Proc Natl Acad Sci, 1995, 92(11): 4947–4951. DOI:10.1073/pnas.92.11.4947 |
| [26] | Brown E J, Albers M W, Schreiber S L, et al. A mammalian protein targeted by G1-arresting rapamycin-receptor complex[J]. Nature, 1994, 369(6483): 756–658. DOI:10.1038/369756a0 |
| [27] | Kuruvilla F G, Shamji A F, Sternson S M, et al. Dissection of a glucose-sensitive pathway of the nutrient-response network using diversity-oriented synthesis and small molecule microarrays[J]. Nature, 2002, 416(6881): 653–656. DOI:10.1038/416653a |
| [28] | Shamji A F, Nghiem P, Schreiber S L. Integration of growth factor and nutrient signaling:implications for cancer biology[J]. Molecular Cell, 2003, 12(2): 271–280. DOI:10.1016/j.molcel.2003.08.016 |
| [29] | Halford B K, Nicolaou C, Stuart L. Schreiber share 2016 Wolf prize[J]. Chem Eng News, 2016, 94(4): 9. |
| [30] | Sabatini D M, Erdjument-Bromage H, Lui M, et al. RAFT1:a mammalian protein that binds to FKBP12 in a rapamycin-dependent fashion and is homologous to yeast TORs[J]. Cell, 1994, 78(1): 35–43. DOI:10.1016/0092-8674(94)90570-3 |
| [31] | Jacinto E, Loewith R, Schmidt A, et al. Mammalian TOR complex 2 controls the actin cytoskeleton and is rapamycin insensitive[J]. Nat Cell Biol, 2004, 6(11): 1122–1128. DOI:10.1038/ncb1183 |
| [32] | Sabatini D M. mTOR and cancer:Insights into a complex relationship[J]. Nat Rev Cancer, 2006, 6(9): 729–734. DOI:10.1038/nrc1974 |
| [33] | Laplante M, Sabatini D M. mTOR signaling at a glance[J]. J Cell Sci, 2009, 122(20): 3589–3594. DOI:10.1242/jcs.051011 |
| [34] | Laplante M, Sabatini D M. mTOR Signaling in growth control and disease[J]. Cell, 2012, 149(2): 274–293. DOI:10.1016/j.cell.2012.03.017 |
| [35] | Chantranupong L, Sabatini D M. Cell biology:The TORC1 pathway to protein destruction[J]. Nature, 2016, 536(7615): 155–156. DOI:10.1038/nature18919 |
| [36] | Sarbassov D D, Ali S M, Kim D H, et al. Rictor, a novel binding partner of mTOR, defines a rapamycin-insensitive and raptor-independent pathway that regulates the cytoskeleton[J]. Curr Biol, 2004, 14(14): 1296–1302. DOI:10.1016/j.cub.2004.06.054 |
| [37] | Sarbassov D D, Guertin D A, Ali S M, et al. Phosphorylation and regulation of Akt/PKB by the Rictor-mTOR complex[J]. Science, 2005, 307(5712): 1098–1101. DOI:10.1126/science.1106148 |
| [38] | Lamming D W, Ye L, Katajisto P, et al. Rapamycin-induced insulin resistance is mediated by mTORC2 loss and uncoupled from longevity[J]. Science, 2012, 335(6076): 1638–1643. DOI:10.1126/science.1215135 |
| [39] | Dobashi Y, Watanabe Y, Miwa C, et al. Mammalian target of rapamycin:A central node of complex signaling cascades[J]. Int J Clin Exp Pathol, 2011, 4(5): 476–495. |
| [40] | Li J, Kim S G, Blenis J. Rapamycin:one drug, many effects[J]. Cell Metab, 2014, 19(3): 373–379. DOI:10.1016/j.cmet.2014.01.001 |
| [41] | Foley J F. Why rapamycin is a good immunosuppressant[J]. Science, 2016, 352(6290): 1185–1187. |
| [42] | Cragg G M, Pezzuto J M. Natural products as a vital source for the discovery of cancer chemotherapeutic and chemopreventive agents[J]. Med Princ Pract, 2016, 25(Suppl 2): 41–59. |
| [43] | Liu Q, Thoreen C, Wang J, et al. mTOR mediated anti-cancer drug discovery[J]. Drug Discov Today Ther Strateg, 2009, 6(2): 47–55. DOI:10.1016/j.ddstr.2009.12.001 |
| [44] | Meng L, Zheng X F S. Toward rapamycin analog (rapalog)-based precision cancer therapy[J]. Acta Pharm Sin, 2015, 36(10): 1163–1169. DOI:10.1038/aps.2015.68 |
| [45] | Pópulo H, Lopes J M, Soares P. The mTOR signalling pathway in human cancer[J]. Int J Mol Sci, 2012, 13(2): 1886–1918. |
| [46] | Harrison D E, Strong R, Sharp Z D, et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice[J]. Nature, 2009, 460(7253): 392–395. |
| [47] | Wilkinson J E, Burmeister L, Brooks S V, et al. Rapamycin slows aging in mice[J]. Aging Cell, 2012, 11(4): 675–682. DOI:10.1111/acel.2012.11.issue-4 |
| [48] | Mannick J B, Giudice G D, Lattanzi M, et al. mTOR inhibition improves immune function in the elderly[J]. Sci Translat Med, 2014, 6(268): 268ra179. DOI:10.1126/scitranslmed.3009892 |
| [49] | Richardsona A, Galvanb V, Linc A L, et al. How longevity research can lead to therapies for Alzheimer's disease:The rapamycin story[J]. Experim Gerontol, 2015, 68: 51–58. DOI:10.1016/j.exger.2014.12.002 |
| [50] | 郭瑞霞, 李力更, 王于方, 等. 天然药物化学史话:天然产物化学研究的魅力[J]. 中草药, 2015, 46(14):2019–2033. |
| [51] | 史清文, 李力更, 霍长虹, 等. 天然药物研究与新药开发[J]. 中草药, 2010, 41(10):1583–1589. |
| [52] | 史清文, 李力更, 霍长虹, 等. 天然药物化学学科的发展以及与相关学科的关系[J]. 中草药, 2011, 42(8):1457–1463. |
| [53] | 付炎, 李力更, 王于方, 等. 天然药物化学史话:维生素B12[J]. 中草药, 2015, 46(9):1259–1264. |
| [54] | 郭瑞霞, 李力更, 王于方, 等. 天然药物化学史话:甾体化合物[J]. 中草药, 2016, 47(8):1251–1264. |
| [55] | 王思明, 王于方, 李勇, 等. 天然药物化学史话:来自海洋的药物[J]. 中草药, 2016, 47(10):1629–1642. |
 2017, Vol. 48
2017, Vol. 48


