潺槁树Litsea glutinosa (Lour.) C. B. Rob. 又名潺槁木姜子,主要分布于中国、越南、菲律宾、印度等热带和亚热带地区,在我国主要分布在广东、海南、云南等地区[1]。潺槁树为常绿阔叶乔木,常见于山地林缘、溪旁、疏林或灌木丛中。潺槁树在我国为重要的药用植物,收录于《中华本草》,具有清湿热、消肿毒的功效[2]。现代药理学研究发现,潺槁树具有治疗糖尿病、抗炎、抗菌等多种功效,如临床上用潺槁树水提液来治疗2型糖尿病,疗效显著;潺槁树叶提取物可降低大鼠的足肿胀度,抗炎作用显著;潺槁树皮提取物可抑制革兰阳性和阴性菌,抗菌作用显著。在化学成分研究方面,潺槁树主要含有黄酮类、生物碱类、木脂素类成分,其中生物碱类属于阿朴啡类,为其特征性成分。本文针对潺槁树的化学成分和药理作用研究进展进行综述,为其深入开发与研究奠定基础。
1 化学成分 1.1 黄酮类汪云松等[3]从潺槁树枝叶乙醇提取物的正丁醇部位分离出7个黄酮类成分,包括山柰酚- 3-O-β-D-半乳糖苷(1)、山柰酚-3-α-L-鼠李糖苷(2)、槲皮素-3-α-L-阿拉伯糖苷(3)、槲皮素-3-O-β-D-鼠李糖苷(4)、山柰酚-3-O-α-L-鼠李糖基 (1→6)-β-D-葡萄糖苷(5)、芦丁(6)、(+)-没食子儿茶素(7)。Wang等[4]对潺槁树枝叶的乙醇提取物的醋酸乙酯萃取物进行硅胶柱色谱分离,再经凝胶柱色谱和反相柱色谱进一步分离纯化,得到2′,5,7-trihydroxy-6-methoxyflavone 2′-O-β-D- glucopyranoside,命名为glutin(8)。黄酮类成分的结构见图 1。
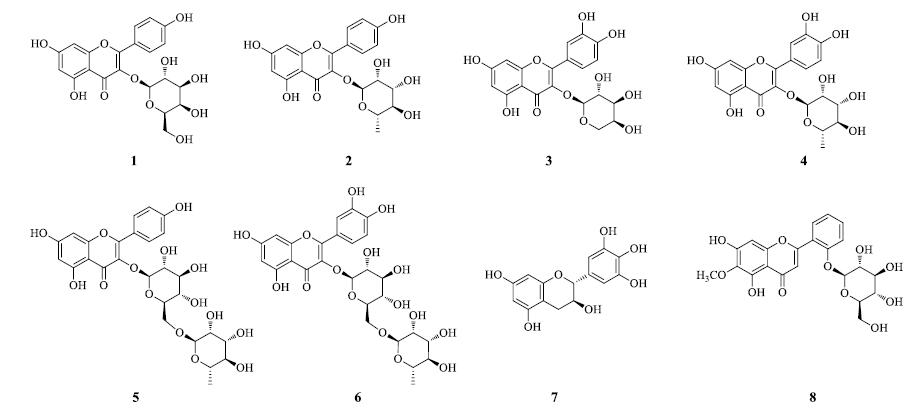
|
图 1 潺槁树黄酮类成分化学结构 Fig.1 Chemical structures of flavonoids in L. glutinosa |
1.2 生物碱类
早在1969年Hart等[5]从潺槁树叶的提取物中获得总生物碱,经中性氧化铝柱色谱进一步分离纯化得到系列生物碱,经波谱学方法鉴定结构为liriodenine(9)、isoboldine(10)、laurotetanine(11)、laurelliptine(12)。另外还从潺槁树皮的提取物中获得生物碱laurolitsine(13)。1971年,Tewari等[6]从潺槁树叶和茎的乙醇提取物的氯仿萃取物中分离并鉴定出5个新生物碱norboldine(14)、N-methyllaurotetanine(15)、boldine(16)、actinodaphnine(17)、N-methylactinodaphnine(18)。2005年,Yang等[7]从潺槁树叶的乙醇提取物的正丁醇萃取物中分离得到2个新的阿朴啡类生物碱litseglutine A(19)、litseglutine B(20)。生物碱类成分结构见图 2。
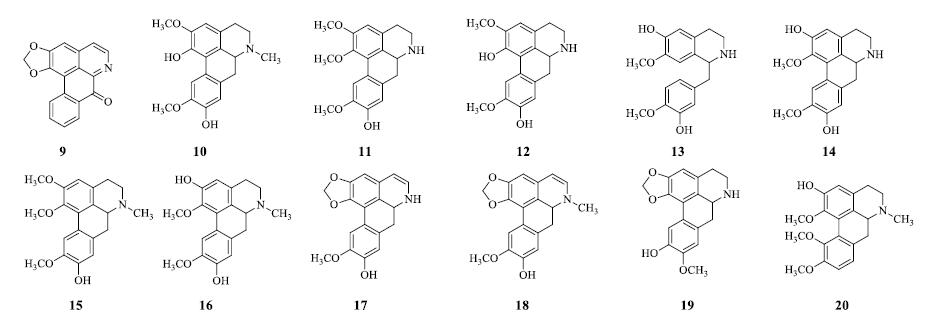
|
图 2 潺槁树生物碱类成分化学结构 Fig.2 Chemical structures of alkaloids in L.glutinosa |
1.3 木脂素类
Pan等[8]从潺槁树茎中得到10个木脂素类化合物 (7′S,8R,8′S)-3,3′,5-trimethoxy-4,4′,9-trihydroxy-9′-O-β-D-xylopyranosyl-2,7′-cyclolignan(21)、(-)-lyoniresinol(22)、(-)-isolariciresinol-9′-O-β-D-xylopyranoside(23)、(-)-isolariciresinol-5′-methoxy-9′-O-β-D-xylopyranoside(24)、(7′R,8S,8′R)-nudiposide(25)、(7′S,8R,8′S)- lyoniresinol(26)、(7′S,8R,8′R)-4,4′,9-trihydroxy-3′,5- dimethyl-9′-O-β-D-xylopyranosyl-2,7′-cyclolignan(27)、ssioriside(28)、glochidioboside(29)和 [(2R,3S)-2,3- dihydro-2-(4-hydroxy-3-methoxyphenyl)-5-(3-hydroxy-propyl)-7-methoxy-1-benzofuran-3-yl] methyl-β-D- glucopyranoside(30)。徐有伟等[9]从潺槁树枝叶中分离并鉴定出1个木脂素酰胺类化合物1,2- dihydro-6,8-dimethoxy-7-hydroxy-1-(3,5-dimethoxy-4- hydroxylphenyl)-N1,N2-bis-[2-(4-hydroxyphenyl) ethyl]- 2,3-naphthalene dicarboxamide(31)。Wang等[10]从潺槁树枝叶的乙醇提取物的正丁醇萃取物中得到3个木脂素类化合物 (7′R,8′R)-3,5′-dimethoxy-9,9′-dihydroxy- 4,7′-epoxylignan 4′-β-D-glucopyranoside(32)、(7′R,8′S)-dihydride-hydrodiconifenyl alcohol 9′-O-β-D- xylopyranoside(33)、pinoresinol 3-O-β-D- glucopyranoside(34)。木脂素类成分结构见图 3。
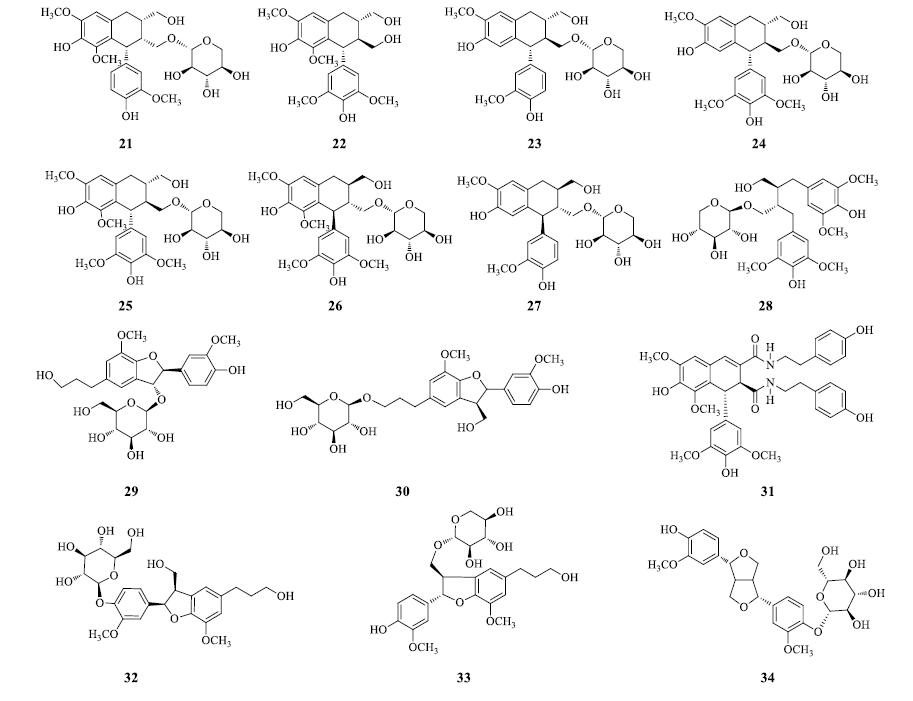
|
图 3 潺槁树木脂素类成分化学结构 Fig.3 Chemical structures of lignans in L.glutinosa |
1.4 酯类
Agrawal等[11]从潺槁树甲醇提取物中分离出4个丁烯羟酸内酯类和1个苯甲酸酯类化合物,经波谱学方法鉴定后确定为 (3R,4S,5S)-2-hexadecyl- 3-hydroxy-4-methylbutano-4-lactone(35)、litsealactone C(36)、litsealactone D(37)、litsealactone G(38)和eusmoside C(39)。酯类成分结构见图 4。
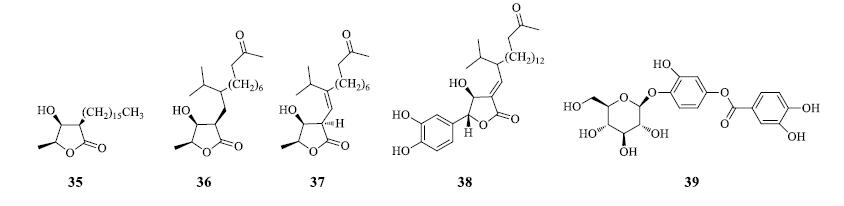
|
图 4 潺槁树酯类成分化学结构 Fig.4 Chemical structures of lipid in L.glutinosa |
1.5 酚酸类
汪云松等[3]从潺槁树枝叶的乙醇提取液的正丁醇部位分离得到2个酚酸类成分为丁香酸(40)和2,4-二甲氧基苯酚(41)。文洁等[12]从潺槁树枝叶的乙醇提取液中分离得到2个酚酸类化合物为α-苯基肉桂酸(42)和对羟基桂皮酸(43)。酚酸类成分结构见图 5。
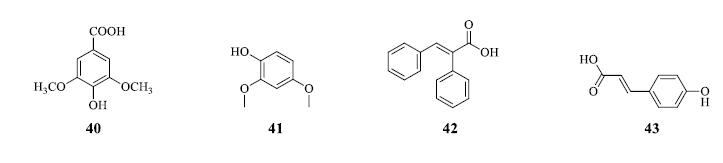
|
图 5 潺槁树酚酸类成分化学结构 Fig.5 Chemical structures of phenolic acids in L. glutinosa |
1.6 其他
徐有伟等[9]对潺槁树枝叶化学成分进行分离,得到3个化合物pubinernoid A(44)、吐叶醇(45)、滨藜叶分药花苷(46)。Pan等[8]从潺槁树枝的提取物中得到1个新的脱落酸衍生物litseaglutinan(47)。Wang等[10]从潺槁树枝叶得到2个紫罗兰酮双糖苷类化合物 (6S,7E,9R)- 6,9-dihydroxy-4,7-megastigmadien-3-one-9-O-[α-L- arabinofuranosyl-(l→6)]-β-D-glucopyranoside(48)和 (6S,7E,9R)-roseoside(49)。另外,还从潺槁树叶的提取物中分离得到2个水溶性多糖[13-14],其他成分的结构见图 6。

|
图 6 潺槁树其他类成分化学结构 Fig.6 Chemical structures of other constituents in L. glutinosa |
2 药理活性 2.1 糖尿病治疗作用
20世纪80年代,张闿珍等[15]研究潺槁树水煎液治疗糖尿病的作用,共开展86例临床试验,确定显效31例,有效30例,发现潺槁树水煎液可降低糖尿病患者的血糖及胆固醇水平,治疗糖尿病的临床效果显著。进一步通过家兔糖尿病动物模型确证在给药(100 g生药)8~10 h后,潺槁树水煎液发挥了显著的降血糖作用。
Palanuvej等[16]研究潺槁树等7种泰国药用植物提取物调控糖代谢作用,结果发现2%潺槁树叶的黏液混悬剂的葡萄糖释放百分比为80.6%,在相同浓度下其对照组葡甘露聚糖的葡萄糖释放百分比为65.4%。另外,还发现0.5%潺槁树叶提取物的混悬剂对α-葡萄糖苷酶的抑制率为41%,在相同浓度下对照组1-deoxynorjirimycin对α-葡萄糖苷酶的抑制率为47.6%,确定潺槁树叶对α-葡萄糖苷酶有显著抑制作用。
2.2 抗炎作用Bhowmick等[17]采用角叉菜胶致小鼠足肿胀的药理模型观察潺槁树叶提取物及不同部位的抗炎作用。通过给小鼠注射潺槁树叶的甲醇和三氯甲烷萃取物(剂量均为500 mg/kg)3 h,发现其降低小鼠的足肿胀度均优于阳性对照酮咯酸,具有显著的抗炎作用。Devi等[18]用角叉菜胶、组胺和葡聚糖致大鼠足肿胀的3个药理模型来研究潺槁树叶的甲醇提取物的抗炎作用,给成年大鼠右后肢的足底表面分别施用0.1 mL的1%角叉菜胶、组胺溶液和葡聚糖生理盐水溶液诱发其足肿胀。然后分别给大鼠ig潺槁叶的甲醇提取物250和500 mg/kg,并在1、2、3、4 h观察大鼠的足肿胀程度,3个药理模型的高剂量组(500 mg/kg)对足肿胀的抑制率分别为46.21%、35.08%和43.14%,证明其能显著抑制大鼠的足肿胀度,具有抗炎作用。
2.3 抗菌作用Mandal等[19]用琼脂扩散法研究潺槁树皮的甲醇提取物的抗菌活性。以氯霉素为对照组,考察潺槁树皮甲醇提取物在50、100、150、200 μg/mL时对16种细菌的抗菌作用。结果发现其在200 μg/mL时对16种细菌的抑制圈在9.00~13.50 mm内,可有效地抑制革兰阳性菌如金黄色葡萄球菌、肺炎链球菌、枯草芽孢杆菌等和革兰阴性菌如大肠杆菌、痢疾杆菌、肺炎杆菌等,对有些细菌的抗菌活性甚至优于阳性药物氯霉素。
2.4 解热镇痛作用Bhowmick等[17]通过给小鼠注射酵母悬浊液使小鼠直肠温度显著升高,观察潺槁叶提取物的解热作用。结果发现,甲醇粗提物的高剂量组(500 mg/kg)在给药1~3 h后能降低实验小鼠的直肠温度,与引起活动发热时的对照组相比解热作用显著。
同时,通过醋酸诱导扭体实验和热板法来观察潺槁叶提取物的不同萃取物的镇痛作用。用醋酸致小鼠扭体实验,发现甲醇粗提物的高剂量组(500 mg/kg)在给药1~3 h后小鼠扭体抑制率为56.32%,其阳性对照组酮咯酸的抑制率为64.36%,证明其具有显著镇痛作用。又采用热板法观察潺槁叶的提取物及不同部位的镇痛作用,结果发现甲醇粗提物的高剂量组(500 mg/kg)在给药1~3 h后对热刺激的最大响应时间 [(15.54±0.37)s] 可与酮咯酸[(16.38±0.27)s] 相媲美,因此潺槁叶提取物具有显著的镇痛作用。
2.5 溶栓作用Bhowmick等[17]通过比较潺槁叶的4种不同提取物对有效凝块溶解率的差异来观察潺槁叶提取物的溶栓作用。结果发现,甲醇粗提物活性最佳[(46.78±0.90)%],正己烷粗提物最低 [(32.23±0.26)%],但也远高于阴性对照组 [(7.06±0.95)%],说明潺槁叶提取物具有溶栓作用。
2.6 抗氧化作用Devi等[18]以DPPH自由基清除活性和过氧化氢清除活性来评价潺槁叶的抗氧化作用,2,6-二叔丁基-4-甲基苯酚(BHT)和抗坏血酸为对照,IC50值分别为30.24 μg/mL和216.53 μg/mL。结果发现其与抗坏血酸(123.84 μg/mL)相比具有显著的抗氧化作用。
3 结语大量药理学实验证实潺槁树在治疗糖尿病、抗炎、抗菌、解热镇痛、溶栓等方面具有显著的作用,但潺槁树发挥药效的物质基础及作用机制尚不明确。前期有研究人员从潺槁树中分离得到部分化合物,但尚未见依据传统功效开展对这些化合物的系统活性评价,该方面的研究亟待加强。
有关潺槁树提取物、化合物药效作用机制的研究也鲜有报道,也未见采用现代分子生物学技术探索其提取物、化合物作用靶点的研究。因此,有必要深入研究潺槁树各提取物及化学成分在其发挥治疗糖尿病、抗炎、抗菌、解热、溶栓等药效作用时的活性机制,为该药用植物的合理开发利用提供依据,并为开发具有自主知识产权的现代新型药物奠定基础。
| [1] | 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999. |
| [2] | 中国植物志编委会. 中国植物志(第32卷)[M]. 北京: 科学出版社, 1982. |
| [3] | 汪云松, 黄荣, 李良, 等. 潺槁木姜子中黄酮类成分研究[J]. 中草药, 2008, 39(10):1466–1468. |
| [4] | Wang Y S, Huang R, Lu H, et al. A new 2'-oxygenated flavone glycoside from Litsea glutinosa (Lour.) C. B. Rob[J]. Biosci Biotechnol Biochem, 2010, 74(3): 652–654. DOI:10.1271/bbb.90701 |
| [5] | Hart N K, Johns S R, Lamberton J A, et al. Alkaloids of several Litsea species from new guinea[J]. Aust J Chem, 1969, 22(10): 2259–2262. DOI:10.1071/CH9692259 |
| [6] | Tewari S, Bhakuni D S, Dhar M M. The aporphine alkaloids of Litsea glutenosa[J]. Phytochemitsry, 1972, 11(3): 1149–1152. DOI:10.1016/S0031-9422(00)88469-1 |
| [7] | Yang J H, Li L, Wang Y S, et al. Two new aporphine alkaloids from Litsea glutinosa[J]. Helv Chim Acta, 2005, 88(9): 2523–2526. DOI:10.1002/(ISSN)1522-2675 |
| [8] | Pan J Y, Zhang S, Wu J, et al. Litseaglutinan A and lignans from Litsea glutinosa[J]. Helv Chim Acta, 2010, 93(5): 951–957. DOI:10.1002/(ISSN)1522-2675 |
| [9] | 徐有伟, 周洪雷, 任冬梅, 等. 潺槁木姜子地上部位化学成分[J]. 山东大学学报, 2016, 54(3):45–50. |
| [10] | Wang Y S, Liao Z, Li Y, et al. A new megastigmane diglycoside from Litsea glutinosa (Lour.) C. B. Rob[J]. J Braz Chem Soc, 2011, 22(11): 2234–2238. DOI:10.1590/S0103-50532011001100030 |
| [11] | Agrawal N, Pareek D, Dobhal S, et al. Butanolides from methanolic extract of Litsea glutinosa[J]. Chem Biodivers, 2013, 10(3): 394–400. DOI:10.1002/cbdv.v10.3 |
| [12] | 文洁, 周法兴. 潺槁树的化学成分研究[J]. 中药材, 1997, 20(4):191–192. |
| [13] | Das D, Maiti S, Maiti T K, et al. A new arabinoxylan from green leaves of Litsea glutinosa (Lauraeae):Structural and biological studies[J]. Carbohydr Polym, 2013, 92(2): 1243–1248. DOI:10.1016/j.carbpol.2012.10.052 |
| [14] | Hearth H M, Kumar N S, Wimalasiri K M. Structural studies of an arabinoxylan isolated from Litsea glutinosa (Lauraceae)[J]. Carbohydr Res, 1990, 198(2): 343–351. DOI:10.1016/0008-6215(90)84304-D |
| [15] | 张闿珍, 王刃余, 谢振家, 等. 潺稿治疗糖尿病86例临床分析[J]. 福建中医药, 1985, 16(4):13–14. |
| [16] | Palanuvej C, Hokputsa S, Tunsaringkarn T, et al. In vitro glucose entrapment and alpha-glucosidase inhibition of mucilaginous substances from selected Thai medicinal plants[J]. Sci Pharm, 2009, 77(4): 837–849. |
| [17] | Bhowmick R, Shahid M S, Dewan S M, et al. In vivo analgesic, antipyretic, and anti-inflammatory potential in Swiss albino mice and in vitro thrombolytic activity of hydroalcoholic extract from Litsea glutinosa leaves[J]. Biol Res, 2014, 47(1): 56–64. DOI:10.1186/0717-6287-47-56 |
| [18] | Devi P, Meera R. Study of antioxdant, anti-inflammatory and woundhealing activity of extracts of Litsea glutinosa[J]. J Pharm Sci Res, 2010, 2(2): 155–163. |
| [19] | Mandal S C, Kumar C K, Majumder A, et al. Antibacterial activity of Litsea glutinosa bark[J]. Fitoterapia, 2000, 71(4): 439–441. DOI:10.1016/S0367-326X(00)00132-5 |
 2017, Vol. 48
2017, Vol. 48


