土壤微生物群落结构和组成的动态变化越来越多地被用来评估微生态系统的响应,并在一定程度上具有指示生态系统破坏与恢复程度的功能。相对于植物群落的变化来说,根际微生物群落与根内生微生物能够更迅速地反映环境条件的变化,特别是在形成作物连作障碍的初期对环境的变化最为敏感。
三七Notoginseng Radix et Rhizoma为五加科人参属植物三七Panax notoginseng (Burk.) F. H. Chen 的干燥根和根茎,是我国的道地中药材,具有活血、止血、散瘀消肿的功效,主要用于治疗心脑血管疾病,如冠心病、心绞痛[1-2]。三七主要种植于云南和广西海拔1 500~1 800 m的山区,该植物存在严重的连作障碍,一般种植后要经过8年以上的时间才能再次种植,导致三七产量与品质下降。三七连作障碍的产生是植株-土壤多种因素动态作用的结果,包括微生物群落的动态变化、土传致病微生物的增加、土壤的盐分累积和酸化、营养失衡和植物化感作用等,其中土壤微生物群落多样性、土壤真菌与致病菌的数量、土壤磷和钾元素的量是三七连作障碍形成的几个关键因素[3-6]。本文针对三七连作过程中根际土壤微生物与根内共生微生物的研究进展进行综述,系统分析了三七与其环境生态因子之间的关系,旨在为三七的规模化种植以及消减三七连作障碍提供理论依据。
1 三七连作过程中微生物群落研究进展 1.1 三七根际土壤微生物与根内共生微生物的群落研究生物和非生物环境要素的协同作用是决定动物和植物群落生长与分布的决定因素。与植物和动物相比,微生物表现出更高的遗传多样性,因此对环境因素的表现更为敏感。近年来,生态学家发现土壤pH值,土壤营养、化学元素等可以同时对微生物群落结构产生影响,并产生协同互动和反馈效应[7-10]。同时相对于动物和植物群落,微生物群落动态的研究对生态过程具有早期指示作用,也能较好地评估生态效果与状态[11]。由于大多数土壤微生物在可培养情况下不能被培养出来(目前可培养的不超过1%),因此目前根际土壤微生物与根内共生微生物群落的研究更多集中于宏基因组测序、宏转录组测序和扩增子测序等方法。
1904年首次定义根际土壤(根系周围受根系影响的土壤)以来,根际微生物群落的研究越来越受到科学家的重视[12]。而根内共生微生物则是指共生的细菌或真菌,在一定程度上它存在于植物体内,不会表现出明显的致病性,主要开展了在拮抗病原菌筛选与共生机制及根内微生物的来源方面的研究[13]。
1.1.1 植物根际土壤微生物群落特征Harris[14]认为土壤根际微生物群落在恢复生态学与群落动态演替过程中具有重要的作用,是研究生态恢复与群落演替的重要指标。Banning等[15]通过对受干扰的森林生态系统恢复过程中根际土壤微生物群落演替模式的研究表明,土壤微生物群落结构动态变化对生态过程具有早期指示的功能。Van der Wal等[16]研究沙地土壤微生物动态变化过程中发现随着土壤有机质的提高与土壤物理干扰减小,土壤微生物中真菌与细菌的多样性明显提高。Holtkamp等[17]对土壤演替过程中土壤食物网的动态变化进行研究发现,随着群落演替从灌木到森林的演变,真菌与细菌的生物量进一步增加,这与土壤资源与能量转变是一致的,同时与根到真菌“能量通道”的打开有着密切的关系。以上研究进一步探析了土壤微生物随着群落变化的响应规律,为进一步通过生物控制来提高药材的产量和品质提供了理论依据。
作物的连作过程也是土壤微生物动态演替的过程,表现出与以上研究相似的规律:土壤微生物的数量降低、细菌数量减少、真菌数量增加的趋势,表现出从“细菌型”土壤到“真菌型”土壤发展的趋势[18-19]。Ying等[20]通过对土壤微生物群落代谢功能的影响研究发现,人参Panax ginseng C. A. Mey.根际土壤微生物在连作过程呈现出较大的变化,导致对病原菌的拮抗减弱,并最终使病原菌在根际微生物中获得较大的优势。Li等[21]利用454高通量测序研究表明,大豆的连作过程较大地影响了根际土壤真菌多样性,特别是Thelebolus Tode属和被孢霉属Mortierella E. Coemans真菌显著增加。Manici等[22]通过对欧洲苹果连作过程中根内共生真菌的调查研究发现,内生真菌群落的增加导致了苹果的减产,柱孢属Cylindrocarpon Wollenw群落数量的增加对产量的影响尤为明显。以上研究在一定程度上揭示了作物栽培过程土壤微生物群落的动态变化趋势,特别是真菌群落的变化特征。
1.1.2 三七根际土壤微生物群落特征官会林等[23]对三七的田间种植研究表明,该植物根际土壤的微生物表现出随季节变化的特征,同时随着三七的种植期的延长,厌氧细菌、真菌及放线菌数量在土壤中表现出增加的趋势。寻路路[24]通过研究发现,三七连作的根际土壤(未种植三七,种植三七1年、3年、5年,间隔1年、3年和5年)中细菌、放线菌、亚硝化细菌、芳香族分解菌、固氮菌和钾细菌的数目均少于未种植三七的土壤。
Miao等[25]通过Illumina MiSeq测序对2年生健康三七的根际真菌微生物进行了研究,表明接合菌门(Zygomycota,46.2%)和子囊菌门(Ascomycota,37.8%)为优势类群,接合菌门中被孢霉属占较大比例(44.9%)。毁灭柱孢菌Cylindrocarpon destructans (Zinssm.) Scholten、黄腐柱孢菌C. didynum (Harting) Wollenw、腐皮镰刀菌Fusarium solani (Mart.) Sacc、尖孢镰刀菌F. oxysporum Schltdl、恶疫霉Phytophthora cactorum (Lebert & Cohn) J. Schrt、草茎点霉Phoma herbarum Westend和立枯丝核菌Rhizoctonia solani J. G. Kühn为三七根腐病的主要病原真菌,假单孢属Pseudomonas W. Migula为三七根腐病的主要病原细菌,其中柱孢属真菌分离得到的频率最高[26]。Fan等[27]在可培养的条件下从三七健康与根腐病植株根际土壤中共分离得到279株细菌,主要分布于厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetesi),其中芽孢杆菌属Bacillus Cohn最为常见。陆晓菊等[28]从健康三七根际土壤中分离出179株细菌,主要分布于伯克氏菌属Burkholderia Yabunchi、节杆菌属Arthrobacter Conn & Dimmick、链霉菌属Streptomyces Waksman & Henrici及芽孢杆菌属;还从根腐病三七根际土壤分离得到117株细菌,主要为罗尔斯顿菌属Ralstonia Yabuuchi、鞘氨醇单胞菌属Sphingomonas Yabuuchi、寡养单胞菌属Stenotrophomonas Palleroni & Bradbury。三七根际土壤微生物群落组成见表 1,假单胞属与镰刀属在可培养与免培养中均为常见属。
|
|
表 1 三七连作过程中根际微生物主要类群 Table 1 Microbiological groups in rhizospheric soil of P. notoginseng |
1.1.3 三七根内共生微生物的群落特征
对于三七根内共生微生物的分离,目前大多采用可培养的方法。Ma等[29]培养出104种对病原真菌拮抗作用的细菌,他们分别属于厚壁菌门、放线菌门、变形菌门和拟杆菌门。张玉洁等[30]从三七中分离出158株形态各异的内生真菌,同时对比研究发现茎和叶中的内生真菌的种类和数量多于根内。Wu等[31]通过高通量16 S rRNA与ITS(internal transcribed spacer)测序对比研究三七健康植物、根腐病植株根际与根内微生物发现,健康植株根内微生物主要为假单孢属和伯克氏菌属细菌,根腐病根内微生物主要为假单孢属和欧文氏菌属Erwinia Winslow et al. 细菌,同时研究发现土赤壳属Ilyonectria P. Chaverri & C. Salgado和葡萄孢属Botrytis E. M. Fries细菌主要存在于健康和根腐病植株根内。根内丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能够针对性提高三七的抗根腐病能力[32]。三七根内共生土壤微生物群落组成见表 2,其中镰刀属在可培养与免培养中均为常见属。
|
|
表 2 三七根内共生微生物主要类群 Table 2 Microbiological groups in endogenous of P. notoginseng root |
1.2 三七连作中根际与根内重要致病微生物种群
三七连作过程中,主要病害为根腐病,而根腐病是由多种病原菌侵染所致。诱发三七根腐病的病原菌类群主要真菌为柱孢属和镰刀属真菌,主要细菌为假单胞属细菌[35-36]。
1.2.1 假单胞属细菌三七长期连作过程导致其易于受到各种土壤病原菌或线虫的侵染。对于土壤致病细菌的研究表明,三七根腐病主要病原细菌为假单胞属细菌[37]。现有的研究表明,假单胞属细菌在三七连作障碍的形成过程中具有较强的致病性,同时其对三七根际致病真菌与线虫也表现出一定的生物拮抗性。对于三七根际与内生细菌的可培养与免培养研究存在较大的区别,由于可培养仅仅只能培养不到1%的微生物群落,因此免培养结果具有较高的可信度。Wu等[31]通过高通量16 S rRNA基因对比研究三七健康与根腐病植株根际与根内细菌发现,假单胞属细菌均具有较高丰度,但根腐病植株根际和根内的多样性均显著高于健康植株。
与此同时,假单胞属细菌在三七连作过程中还表现出一定拮抗致病真菌与线虫病的作用。Fan等[27]通过可培养法从健康与根腐病三七根际共分离得到279种细菌,发现假单孢属细菌 [Pseudomonas baetica López et al.、P. helmanticensis Ramírez et al.、P. hunanensis Gao et al.、P. koreensis Kwon et al.、P. libanensis Dabboussi et al.、P. moorei Cámara et al.、P. chlororaphis subsp. aurantiaca (Nakhimovskaya) Peix et al.、P. chlororaphis subsp. piscium Burr et al.] 表现出对真菌致病菌具有一定程度的拮抗性能。Ma等[29]对三七内生细菌进行可培养分析,从健康三七的叶片内生真菌中分离到1种变形假单胞菌P. plecoglossicida,研究表明该菌能够较好地拮抗致病根结线虫Meloidogyne hapla。
假单孢属细菌的生长具有较低的营养需求,一般生长在中性pH环境,其广泛分布于水体、动物、植物、云层、土壤以及极地与沙漠环境中。针对于植物和动物(包括人类)来说该属中具有较多的致病菌[38-40],同时假单孢属是变形菌门假单孢菌科(Pseudomonadaceae)的模式属,自2000年第1个铜绿假单胞菌Pseudomonas aeruginosa (Schroeter) Migula进行了全基因组测序以来,该属的研究更加深入,同时研究发现铜绿假单胞菌在植物宿主中很少致病,但是该菌则是人体急性和慢性感染疾病的重要的病原体[41-42]。
人参、西洋参Panax quniquefolius L. 与三七均为人参属药用植物。随着假单孢属细菌多样性的降低,连作6年的人参根际受真菌病菌侵染的概率明显提高,说明假单胞属细菌对人参根际病原真菌具有较好的拮抗作用[43]。同时研究也表明假单孢属细菌在西洋参内生细菌中明显优势分布,但目前其对病原菌的拮抗作用尚未有研究报道[44]。
1.2.2 柱孢属真菌和镰刀属真菌田间调查与侵染实验表明,镰刀属和柱孢属真菌是三七根腐病的主要致病真菌[36]。Wu等[31]通过高通量18 S rRNA比较三七健康与根腐病植株的微生物多样性,结果发现三七柱孢属和镰刀属真菌差异不明显,而土赤壳属真菌的差异则较为明显,与田间侵染实验结果有一定差异。Miao等[25]通过Illumina MiSeq和可培养对比研究2年生健康三七根际土壤微生物特点,镰刀属真菌是其分离最多的属,同时在免培养中未分离到柱孢属真菌,可培养中分离到黄腐柱孢菌和毁灭柱孢菌,这可能与其未针对根腐病对比取样有关。
镰刀属和柱孢属真菌同时是人参、西洋参根腐病主要的病原真菌[45-47]。与此同时,研究表明镰刀属真菌包括很多能够进行腐生和成为植物致病菌的物种,同时该属很多菌株能够产生霉菌毒素,部分菌株能对人体和动物产生较大的感染致病性[48-49]。柱孢属真菌分布非常广泛,从热带雨林到北极苔原土壤都有发现,往往表现出与其他几种真菌、卵菌和线虫一起共生,其表现为常见的作物根系致病菌[50]。
2 三七连作障碍的生态学研究 2.1 三七连作过程中种群生态学与化感作用三七连作过程中居群间与居群内分析表明,两者具有丰富的遗传多样性,其居群间的遗传差异低于居群内。这可能与400多年的三七栽培,使得其不同种植地区居群间基因进行广泛的交流相关[51-54]。
对三七连作过程中根系的化感作用研究表明,一方面三七鲜根提取液能够明显抑制小麦的生长,三七根际土壤提取液对三七幼苗的生长与硝酸还原酶活性均表现有一定的化感作用[55-56];另一方面三七根系化感物质能够促进部分病原菌的生长,使得连作障碍病害加重[57]。
2.2 三七的道地分布与生态因子的关系三七起源于2 500万年前,主要分布在低纬度高海拔地区,其日照时数长与气温相对较低2个生态因素有利于三七的生长和有效成分的积累[58-62]。同时年均温度14~18 ℃,年积温4 200~5 900 ℃,这些热量条件能够较好地适宜三七的生长和发育[63-64]。
目前传统中药材研究表明土壤条件为药材道地性分布的主要因素,如光果甘草Glycyrrhiza glabral L. 分布在新疆天山土壤湿润、肥沃、盐碱度轻的土壤中,而胀果甘草G. inflate Batalin分布在盐碱度较高的新疆南部地区[65]。土壤条件也是三七分布和生长的主要因素,道地三七与非道地三七在性状和微量元素的量方面两者均有显著差异。三七道地产区为低盐基饱和度的土壤,表现出高硅、低铜、低锌的土壤特点[66-67]。
2.3 三七的产量与生态因子的关系三七连作过程中其产量与气象因子也密切相关,田间试验与产量分析相结合的研究表明三七高产的关键气象要素是热量条件,三七的生长与气温有较好的相关性[68]。土壤化学元素N、K、Ca和Mg直接影响三七的生长,其元素比例往往最适宜道地药材的生长及有效成分的积累[69,70]。同时三七对K的需求大于N和P,适当的K能够有利于三七叶片的生长、使得光合作用增强,提高三七产量[71]。
2.4 三七的品质与生态因子的关系化学成分定性研究能够确定环境因子对三七连作过程中品质影响的变化趋势,其主要集中在对三七皂苷的研究。火山岩形成的土壤种植的三七总皂苷量最高,进一步研究发现K元素和稀土是影响三七品质的关键因素[72]。同时低纬度和高海拔的日照时数及光照强度也有利于三七皂苷的形成[73-74]。自然实验主要集中在气候与土壤的研究,通过相关分析和逐步回归分析研究了气候环境条件对三七品质的影响,表明降水量过大会抑制三七皂苷和三七素的累积,促进黄酮的累积,年温差11 ℃是三七高品质生产的气温条件[75-77]。年间温度差异不大,日平均气温多在21 ℃左右波动,但昼夜温差大的特点导致了三七含有较高的多糖[78-79]。受控实验主要包括受控田间(盆栽)与实验室实验,通过田间小气候变化研究发现三七皂苷的量随着光照强度的变化呈现出先增加后降低的趋势[74]。
2.5 三七连作障碍中病虫害发生与生态因子的关系根腐病、疫病、白粉病、立枯病和黑斑病的发生与生态因子、土壤微生物有着密切的关系。三七为典型的阴生C3植物(CO2同化的最初产物是光合碳循环中的3碳化合物3-磷酸甘油酸的植物),病害的发生表现出与光照呈正相关关系,研究表明30%的透光已超过三七对光的承受极限[80]。三七根腐病的发病率随海拔升高而减轻,温度决定根腐病害出现的早迟和扩展的速度,降雨量则决定根腐病病害发生的严重程度[81]。三七黑斑病具有靠气流、降雨传播的特征,而圆斑病与棚透光率、内部培养温度和湿度密切相关[82-83]。官会林等[84]研究认为三七根腐病的发生与种植土壤、种苗携带致病菌和降雨量相关。
3 展望 3.1 可培养与免培养相结合法对三七根际土壤、根内共生微生物群落动态进行对比研究三七微生物研究主要是针对根际微生物尤其是针对病原菌的分离开展研究。相对于可培养法,免培养法能够检测到大量的未知类群,而纯培养也可获得一些免培养难于检测的物种,二者各有特点,这些对于三七连作的研究都相当重要。因此,在注重免培养分析法时也不能忽视纯培养的重要性,两种方法结合互补,方能更客观地反映自然状况。
根据一系列环境梯度(如温度、降水量)分析影响三七产量与品质的因素,比如土壤微生物基因组学的调查有助于揭示环境因子乃至气候变化对三七土壤微生物的影响以及微生物对此作出的响应。三七土壤微生物目前主要集中于对三七病原微生物的研究[85-86],对于三七连作障碍形成过程的微生物群落动态变化以及连作障碍的机制仍不十分清楚。笔者课题组试图通过以三七连作过程中根际、根内、轮作土壤中微生物的总RNA和DNA为材料,研究菌群的演替规律,同时进一步明确三七连作中根系微生物群落中的优势菌及致病菌的演替规律。
3.2 定量研究根际微生物与根内共生微生物动态变化根际土壤微生物的多样性、生理活性及微生物间的相互作用影响着植物的健康状况。根际土壤直接参与植物与环境的交流,根际微生物-植物- 环境之间有着敏感的互作作用。从微生物角度联合植物根内共生与根际微生物的研究则有利于揭示这种相互作用关系。笔者课题组通过对三七连作过程中三七根际与根内微生物的动态变化进行对比研究表明,结合同一根际与根内生微生物进行分析,能够较好地揭示三七根际微生物的动态变化规律(图 1)。
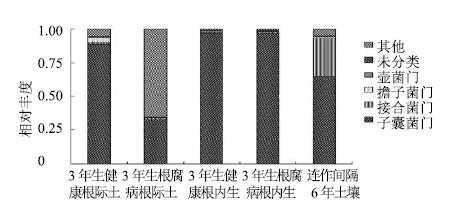
|
图 1 三七连作3年根际微生物、根内微生物与轮作6年土壤微生物多样性 Fig.1 Microorganism of rhizospheric soil and root endogenous during continuous cropping for three years of P. notoginseng and diversity of soil microorganism during rotation for six years of P. notoginseng |
3.3 建立与生态学相关的药材质量评价指标及技术体系
环境因素的影响结合植物本身的基因型形成了药材的道地性,可表示为表型=基因型+环境饰变。这里所指的表型指的是“道地药材”的药材性状、有效成分量及最终品质[87-88]。目前,对药材所表现的与环境的关系和响应研究仍然不够深入,应积极加强三七的植物生态学与中药资源生态学的研究。结合三七质量评价指标和技术体系,加强固定样地的调查,获得准确的三七动态生长信息,结合大数据分析,有助于阐明三七道地性与生态环境的互作关系。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 魏均娴, 杜元冲. 三七:现代科学研究及应用[M]. 昆明: 云南科技出版社, 1996. |
| [3] | 李卫建, 李先恩. 药用植物生态学研究进展[J]. 时珍国医国药, 2005, 16(6):551–552. |
| [4] | 刘莉, 刘大会, 金航, 等. 三七连作障碍的研究进展[J]. 山地农业生物学报, 2011, 30(1):70–77. |
| [5] | 胡展育, 游春梅, 张铁. 三七连作障碍的探讨[J]. 文山学院学报, 2011, 24(3):6–11. |
| [6] | 张子龙, 王文全, 缪作清, 等. 主成分分析在三七连作土壤质量综合评价中的应用[J]. 生态学杂志, 2013, 32(6):1636–1644. |
| [7] | Dunson W A, Travis J. The role of abiotic factors in community organization[J]. Am Nat, 1991, 138(5): 1067–1091. DOI:10.1086/285270 |
| [8] | Drenovsky R E, Vo D, Graham K M, et al. Soil water content and organic carbon availability are major determinants of soil microbial community composition[J]. Microb Ecol, 2004, 48(3): 424–430. DOI:10.1007/s00248-003-1063-2 |
| [9] | Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proc Natl Acad Sci USA, 2006, 103(3): 626–631. DOI:10.1073/pnas.0507535103 |
| [10] | Rousk J, Bååth E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. ISME J, 2010, 4: 1340–1351. DOI:10.1038/ismej.2010.58 |
| [11] | Youssef N H, Elshahed M S. Diversity rankings among bacterial lineages in soil[J]. ISME J, 2009, 3: 305–313. DOI:10.1038/ismej.2008.106 |
| [12] | Hiltner L. Uber neuer erfahrungen und probleme auf dem gebiet der bodenbakteriologie unter besondere berucksichtingung der gründungüng und brache[J]. Arb Dtsch Landw Ges Berl, 1904, 98: 59–78. |
| [13] | Bacon C W, White J F. Microbial Endophytes[M]. New York: Marcel Dekker Inc, 2000. |
| [14] | Harris J. Soil microbial communities and restoration ecology:facilitators or followers?[J]. Science, 2009, 325(5940): 573–574. DOI:10.1126/science.1172975 |
| [15] | Banning N C, Gleeson D B, Grigg A H, et al. Soil microbial community successional patterns during forest ecosystem restoration[J]. Appl Environ Microbiol, 2011, 77(17): 6158–6164. DOI:10.1128/AEM.00764-11 |
| [16] | Van der Wal A, Van Veen J A, Pijl A S, et al. Constraints on development of fungal biomass and decomposition processes during restoration of arable sandy soils[J]. Soil Biol Biochem, 2006, 38(9): 2890–2902. DOI:10.1016/j.soilbio.2006.04.046 |
| [17] | Holtkamp R, Kardol P, Wal A V D, et al. Soil food web structure during ecosystem development after land abandonment[J]. Appl Soil Ecol, 2008, 39(1): 23–34. DOI:10.1016/j.apsoil.2007.11.002 |
| [18] | Li X G, Ding C F, Zhang T L, et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biol Biochem, 2014, 72: 11–18. DOI:10.1016/j.soilbio.2014.01.019 |
| [19] | 刘永杰, 刘文耀, 陈林, 等. 哀牢山两类山地森林林冠及林下腐殖质微生物群落比较[J]. 应用生态学报, 2010, 21(9):2249–2256. |
| [20] | Ying Y X, Ding W L, Zhou Y Q, et al. Influence of Panax ginseng continuous cropping on metabolic function of soil microbial communities[J]. Chin Herb Med, 2012, 4(4): 329–334. |
| [21] | Li B, Cui J, Jie W, et al. Analysis of the community compositions of rhizosphere fungi in soybeans continuous cropping fields[J]. Microbiol Res, 2015, 180: 49–56. DOI:10.1016/j.micres.2015.07.007 |
| [22] | Manici L M, Kelderer M, Franke-Whittle I H, et al. Relationship between root-endophytic microbial communities and replant disease in specialized apple growing areas in Europe[J]. Appl Soil Ecol, 2013, 72(5): 207–214. |
| [23] | 官会林, 杨建忠, 陈煜君, 等. 三七设施栽培根际微生物菌群变化及其与三七根腐病的相关性研究[J]. 土壤, 2010, 42(3):378–384. |
| [24] | 寻路路. 三七种植不同土壤微生态研究[D]. 杨凌:西北农林科技大学, 2013. |
| [25] | Miao C P, Mi Q L, Qiao X G, et al. Rhizospheric fungi of Panax notoginseng:diversity and antagonism to host phytopathogens[J]. J Ginseng Res, 2015, 21(2): 127–134. |
| [26] | 缪作清, 李世东, 刘杏忠, 等. 三七根腐病病原研究[J]. 中国农业科学, 2016, 39(7):1371–1378. |
| [27] | Fan Z Y, Miao C P, Qiao X G, et al. Diversity, distribution, and antagonistic activities of rhizobacteria of Panax notoginseng[J]. J Ginseng Res, 2015, 36(2): 97–104. |
| [28] | 陆晓菊, 官会林, 张正芸, 等. 三七连作根际土壤微生物区系的16S rRNA系统遗传多样性[J]. 微生物学报, 2015, 55(2):205–213. |
| [29] | Ma L, Cao Y H, Cheng M H, et al. Phylogenetic diversity of bacterial endophytes of Panax notoginseng, with antagonistic characteristics towards pathogens of root-rot disease complex[J]. Antonie Van Leeuwenhoek, 2013, 103(2): 299–312. DOI:10.1007/s10482-012-9810-3 |
| [30] | 张玉洁, 李洪超. 三七内生菌分离及抗根腐病病原真菌筛选[J]. 北方园艺, 2011(23):130–132. |
| [31] | Wu Z, Hao Z, Zeng Y, et al. Molecular characterization of microbial communities in the rhizosphere soils and roots of diseased and healthy Panax notoginseng[J]. Antonie Leeuwenhoek, 2015, 108(5): 1059–1074. DOI:10.1007/s10482-015-0560-x |
| [32] | 张智慧, 陈迪, 赵丹丹, 等. 三七根中丛枝菌根真菌与深色有隔内生真菌侵染状况研究[J]. 中国中药杂志, 2011, 36(17):2311–2315. |
| [33] | 张玉洁, 和泽高, 唐龙山, 等. 三七内生真菌分离与分子鉴定(I)[J]. 文山学院学报, 2011, 24(6):1–3. |
| [34] | 张智慧, 张倩茹, 付晓萍, 等. 基于16S rDNA序列分析研究根腐病三七根内可培养细菌的多样性[J]. 中草药, 2014, 45(3):415–419. |
| [35] | 蒋妮, 覃柳燕, 叶云峰. 三七病害研究进展[J]. 南方农业学报, 2011, 42(9):1070–1074. |
| [36] | 罗文富, 贺承福. 三七根腐病病原及复合侵染的研究[J]. 植物病理学报, 1997, 27(1):85–91. |
| [37] | Aravindraja C, Viszwapriya D, Karutha P S. Ultradeep 16S rRNA sequencing analysis of geographically similar but diverse unexplored marine samples reveal varied bacterial community composition[J]. PLoS One, 2013. DOI:10.1371/journal.pone.0076724 |
| [38] | Widmer F, Seidler R J, Gillevet P M, et al. A highly selective PCR protocol for detecting 16S rRNA genes of the genus Pseudomonas (sensu stricto) in environmental samples[J]. Appl Environ Microbiol, 1998, 64(7): 2545–2553. |
| [39] | Peix A, Ramírez-Bahena M H, Velázquez E. Historical evolution and current status of the taxonomy of genus Pseudomonas[J]. Infect Genet Evol, 2009, 9(6): 1132–1147. DOI:10.1016/j.meegid.2009.08.001 |
| [40] | Brenner D J, Krieg N R, Staley J T, et al. Bergey's Manual of Systematic Bacteriology[M]. New York: Springer-Verlag, 2005. |
| [41] | Stover C K, Pham X Q, Erwin A L, et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunisticpathogen[J]. Nature, 2000, 406(6799): 959–964. DOI:10.1038/35023079 |
| [42] | Sadikot R T, Blackwell T S, Christman J W, et al. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia[J]. Am J Respir Crit Care Med, 2012, 171(11): 1209–1223. |
| [43] | Ying Y X, Li Y, Ding W L, et al. Dynamics of Panax ginseng rhizospheric soil microbial community and their metabolic function[J]. Evid Based Compl Alternat Med, 2014, 2014: 1–6. |
| [44] | 刘学周, 赵智灵, 李绍宾, 等. 西洋参内生菌群落结构与多样性[J]. 微生物学报, 2015, 55(3):330–340. |
| [45] | 毕武, 陈娟, 焦晓林, 等. 北京地区西洋参根腐病病原鉴定及其致病性[J]. 植物保护, 2011, 37(5):135–138. |
| [46] | 严雪瑞, 傅俊范. 柱孢属(Cylindrocarpon)真菌和参类锈腐病的研究历史与现状[J]. 沈阳农业大学学报, 2002, 33(1):71–75. |
| [47] | 白容霖, 刘学敏. 吉林省人参根腐病病原真菌种类的研究[J]. 植物病理学报, 1999, 29(3):77–78. |
| [48] | Leslie J F, Summerell B A. The Fusarium Laboratory Manual[M]. Oxford: Blackwell Publishing Ltd, 2006. |
| [49] | Diepeningen A D V, Al-Hatmi A M S, Brankovics B, et al. Taxonomy and clinical spectra of Fusarium species:where do we stand in 2014?[J]. Curr Clin Microbiol Rep, 2014, 1(1): 10–18. |
| [50] | Mantiri F R, Samuels G J, Rahe J E, et al. Phylogenetic relationships in Neonectria species having Cylindrocarpon anamorphs inferred from mitochondrial ribosomal DNA sequences[J]. Can J Bot, 2011, 79(3): 334–340. |
| [51] | 张金渝, 杨维泽, 崔秀明, 等. 三七栽培居群遗传多样性的EST-SSR分析[J]. 植物遗传资源学报, 2011, 12(2):249–254. |
| [52] | Zhang Y, Zhang J C, Huang M H, et al. Detection of genetic homogeneity of Panax notoginseng cultivars by sequencing nuclear 18S rRNA and plastid mat K genes[J]. Planta Med, 2006, 72(9): 860–862. DOI:10.1055/s-2006-946685 |
| [53] | 肖慧, 金航, 张金渝, 等. 三七表型多样性研究[J]. 西南农业学报, 2008, 21(1):147–151. |
| [54] | Hong D Y, Lau A, Yeo C, et al. Genetic diversity and variation of saponin contents in Panax notoginseng roots from a single farm[J]. J Agric Food Chem, 2005, 53(22): 8460–8467. DOI:10.1021/jf051248g |
| [55] | 孙玉琴, 杨莉, 韦美丽, 等. 三七化感作用机理的初步研究[J]. 中药材, 2010, 33(10):1536–1537. |
| [56] | 游佩进, 王文全, 张媛, 等. 三七根区土壤提取物对三七幼苗的化感作用[J]. 西南农业学报, 2009, 22(2):308–310. |
| [57] | 孙玉琴, 陈中坚, 李国才, 等. 化感物对三七病原菌生长影响的初步研究[J]. 现代中药研究与实践, 2009, 22(6):19–21. |
| [58] | 王淑琴, 于洪军, 官廷荆. 中国三七[M]. 昆明: 云南民族出版社, 1993. |
| [59] | 董弗兆, 刘祖武, 乐丽涛. 云南三七[M]. 昆明: 云南科技出版社, 1988. |
| [60] | Wen J, Zimmer E A. Phylogeny and biogeography of Panax L. (the ginseng genus, araliaceae):inferences from ITS sequences of nuclear ribosomal DNA[J]. Mol Phylogenet Evol, 1996, 6(2): 167–177. DOI:10.1006/mpev.1996.0069 |
| [61] | 冯旭芹. 云南道地药材三七生态适宜区评价[D]. 北京:北京师范大学, 2005. |
| [62] | 金航, 崔秀明, 朱艳, 等. 气象条件对三七药材道地性的影响[J]. 西南农业学报, 2005, 18(6):825–828. |
| [63] | 崔秀明, 雷绍武. 三七GAP栽培技术[M]. 昆明: 云南科技出版社, 2002. |
| [64] | Guo H B, Cui X M, An N, et al. Sanchi ginseng (Panax notoginseng (Burkill) F. H. Chen) in China:Distribution, cultivation and variations[J]. Genet Resour Crop Evol, 2010, 57(3): 453–460. DOI:10.1007/s10722-010-9531-2 |
| [65] | 王玉庆, 朱玫. 我国甘草资源调查与分析[J]. 山西农业大学学报, 2002, 22(4):366–369. |
| [66] | 崔秀明, 徐珞珊, 王强, 等. 云南三七道地产区地质背景及土壤理化状况分析[J]. 中国中药杂志, 2005, 30(5):332–335. |
| [67] | 金航, 崔秀明, 徐珞珊, 等. 三七道地与非道地产区药材及土壤微量元素分析[J]. 云南大学学报:自然科学版, 2006, 28(2):144–149. |
| [68] | 吴秋荣, 李红梅. "三七"高产栽培的农业气象诊断[J]. 中国农业气象, 1998, 19(5):13–16. |
| [69] | 冯光泉, 金航, 陈中坚, 等. 不同营养元素对三七生长的影响研究[J]. 现代中药研究与实践, 2003, 17(1):18–21. |
| [70] | 陈中坚, 杨莉, 王勇, 等. 三七栽培研究进展[J]. 文山学院报, 2012, 25(6):1–12. |
| [71] | 张良彪, 孙玉琴, 韦美丽, 等. 钾素供应水平对三七生长发育及产量的影响[J]. 特产研究, 2008, 30(4):46–48. |
| [72] | 高宏光, 杨双兰, 曾群望. 影响文山三七品质的土壤地质背景因素[J]. 云南地质, 2001, 20(2):195–202. |
| [73] | Szakiel A, Pączkowski C, Henry M. Influence of environmental abiotic factors on the content of saponins in plants[J]. Phytochem Rev, 2011, 10(4): 471–491. DOI:10.1007/s11101-010-9177-x |
| [74] | 崔秀明, 陈中坚, 王朝梁, 等. 生长环境与三七皂甙含量[J]. 中药材, 2001, 24(2):81–82. |
| [75] | 冯旭芹, 崔秀明, 陈中坚, 等. 三七有效成分与气候生态因子的相关性分析[J]. 中国农业气象, 2006, 27(1):16–18. |
| [76] | Dong T T, Cui X M, Song Z H, et al. Chemical assessment of roots of Panax notoginseng in China:regional and seasonal variations in its active constituents[J]. J Agric Food Chem, 2003, 51(16): 4617–4623. DOI:10.1021/jf034229k |
| [77] | 崔秀明. 中药三七的道地性研究[D]. 南京:中国药科大学, 2005. |
| [78] | 崔秀明, 董婷霞, 陈中坚, 等. 三七中多糖成分的含量测定及其变化[J]. 中国中药杂志, 1991, 11(6):334. |
| [79] | 崔秀明, 王朝梁. 三七生长及干物质积累动态的研究[J]. 中药材, 1991, 14(9):9–13. |
| [80] | 王朝梁, 崔秀明. 光照与三七病害的关系[J]. 云南农业科技, 2000(5):16–17. |
| [81] | 陈昱君, 王勇. 三七根腐病发生与生态因子的关系[J]. 云南农业科技, 2001(6):33–35. |
| [82] | 陈昱君, 王勇. 三七黑斑病发生与生态因子关系调查初报[J]. 云南农业科技, 2003(1):33–34. |
| [83] | 王勇, 陈昱君, 范昌, 等. 三七圆斑病发生与环境关系[J]. 中药材, 2003, 26(8):541–542. |
| [84] | 官会林, 陈昱君, 刘士清, 等. 三七种植土壤微生物类群动态与根腐病的关系[J]. 西南农业大学学报, 2006, 28(5):706–709. |
| [85] | 王朝梁, 崔秀明. 三七黑斑病侵染及发病条件研究[J]. 中药材, 1998, 21(7):328–330. |
| [86] | 陈文霞, 谈献和. 中药材栽培与土壤生态因子的关系[J]. 中国中医药信息杂志, 2006, 13(12):48–49. |
| [87] | 黄璐琦, 陈美兰, 肖培根. 中药材道地性研究的现代生物学基础及模式假说[J]. 中国中药杂志, 2004, 29(6):494–496. |
| [88] | 刘洋, 张佐双, 贺玉林, 等. 药材品质与生态因子关系的研究进展[J]. 世界科学技术——中医药现代化, 2007, 9(1):65–69. |
 2017, Vol. 48
2017, Vol. 48


