2. 华北理工大学生命科学学院, 河北 唐山 063000
2. College of Life Science, North China University of Science and Technology, Tangshan 063000, China
目前全球范围随着耐药菌株的不断出现,寻找新的菌株、新的抗菌活性物质迫在眉睫。如今人们所使用的抗生素绝大部分是放线菌和真菌产生的天然产物及其衍生物[1],由于从土壤环境中分离筛选产生新天然活性物质的放线菌日益困难,人们逐渐把目光投向之前较少研究的微生物特殊栖息环境如植物内部[2],以期寻找可产生新活性物质的放线菌资源。
植物内生放线菌(endophytic actinobacteria)是指那些其生活史的一定或全部阶段生活于健康植物组织内部,而不使宿主植物表现出明显感染症状的放线菌[3]。其广泛分布于植物的根、茎、叶、花、果实、种子中。按照“内共生理论”,内生菌可能产生与其宿主相同或相似的代谢产物[4]。因此,从药用植物中分离放线菌资源,并从中分离具有与药用植物相类似作用的天然活性物质,用其来代替药用植物,不仅可以减少药用植物资源的过度开发,而且为新药的研发提供了新的途径。研究表明,从药用植物内部筛选得到的放线菌产生的活性物质具有多种生物活性,据Hasegawa等[5]报道从龟背竹属植物分离得到的内生放线菌产生了新的抗生素,且具有良好的抗菌活性;李桂玲[6]从三尖杉等植物中分离到能产生抗肿瘤物质的内生真菌;蔡爱群等[7]分析了水稻内生放线菌具有的纤维素酶、木聚糖酶和果胶酶活性,植物内生菌在新药物筛选上显示出广阔的应用前景。
刺五加Acanthopanax senticosus (Rupr. et Maxim.) Harms (Goka) 来源于五加科(Araliaceae)五加属Acanthopanax (Decne. & Planch.) Miq.,是我国北方地道药材,具有抗菌、抗肿瘤等多种作用[8-9],按照“内共生理论”推测刺五加内生放线菌也可能产生具有类似活性的代谢产物。为此,本课题组深入挖掘了刺五加内生放线菌资源,在菌株抑菌活性初筛后,发现了具有较好抑菌活性的菌株13-85。
本实验对该菌株发酵液的抑菌活性及稳定性进行评价;检测活性物质合成相关功能基因并对菌株进行分类鉴定,旨在为该菌株的后续研究及开发奠定基础,进一步丰富放线菌次级代谢产物合成相关基因数据库,为刺五加内生放线菌资源的开发利用提供依据。
1 材料 1.1 菌株供试放线菌:内生放线菌13-85分离自野生刺五加植株根部。25%甘油管置于-80 ℃冰箱保藏。
供试检定菌:金黄色葡萄球菌Staphylococcusaureus Rosenbach 1884、枯草芽孢杆菌Bacillussubtilis (Ehrenberg) Cohn 1872、铜绿假单胞菌Pseudomonas aeruginosa (Schroeter) Migula 1920、大肠埃希菌Escherichiacoli (Migula) Castellani et Chalmers、草分枝杆菌Mycobacteriumphei Lehmann & Neumann、耻垢分枝杆菌Mycobacteriumsmegmatis Lehmann & Neumann、白色念珠菌Candidaalbicans (C. P. Robin) Berkhout、大肠埃希菌耐药菌株E. coli ATCC35218、金黄色葡萄球菌耐药菌株(MRSA12-1、MRSA ATCC43300)由中国医学科学院北京协和医学院医药生物技术研究所解云英副研究员、孙承航研究员提供。
1.2 培养基发酵培养基:可溶性淀粉20.0 g、葡萄糖5.0 g、蛋白胨5.0 g,酵母膏5.0 g,牛肉膏5.0 g,黄豆饼粉10.0 g,玉米浆4.0 g,CaCO3 4.0 g,CoCl2(0.02%)1.0 mL、去离子水1 000 mL(pH 7.2),121 ℃高压灭菌30 min。
2 方法 2.1 发酵液制备菌株13-85接种于ISP2培养基上28 ℃活化7 d后,转接至三角烧瓶中(发酵培养基装液量为三角烧瓶体积的1/5)28 ℃、180 r/min振荡培养4 d。发酵产物经12 000 r/min离心10 min,取上清备用。
2.2 抑菌谱测定 2.2.1 检定菌制备将检定菌接种于营养琼脂培养基斜面置于37 ℃恒温箱(白色念珠菌置于28 ℃、耻垢分枝杆菌置于35 ℃)培养1 d,待生长良好后用25%甘油吹打制成菌悬液备用。
2.2.2 抑菌活性测定采用平板纸片法[10],对供试放线菌进行抑菌谱测定。将检定菌菌悬液用生理盐水分别对各指示菌菌液进行梯度稀释,稀释至浓度约为1×108 cfu/mL,取上述各种菌悬液0.1 mL于无菌平皿中,然后倒入已冷却至55 ℃的高压灭菌后的培养基15 mL,充分混匀在适当位置贴上己灭菌的滤纸片(Φ=5 mm),然后分别吸取发酵液30 μL置于滤纸片上,同时以发酵纯培养基作阴性对照。将不同带菌平板置37 ℃恒温箱(白色念珠菌置于28 ℃、耻垢分枝杆菌置于35 ℃)培养18~24 h。平行试验重复3次,十字交叉法测量抑菌圈直径。
2.3 发酵液稳定性研究以抑菌谱测定结果为参照,以发酵液原液为对照,分别测定发酵液在不同光照、温度及酸碱条件下活性组分的稳定性。①将发酵液在室温光照条件下放置24、48、72、96 h;②将发酵液于40、60、80 ℃分别处理2 h,冷却至室温;③将发酵液分别调pH值至2、4、6、8、10,4 ℃放置8 h后再回调到原始pH值,分别测定抑菌圈。各处理重复3次。
2.4 菌株13-85总DNA提取采用Chelex-100法[11]提取基因组DNA,作为功能基因检测及16 S rRNA序列扩增模板,置于-20 ℃保存备用。
2.5 功能基因序列扩增及克隆 2.5.1 功能基因检测次级代谢产物合成的相关功能基因片段的扩增引物参照文献报道(PKSI[12]、PKS II[13]、NRPS[14]、Halo[15]、CYP[16]),扩增产物1.0%的琼脂糖凝胶电泳检测,电泳电压为110 V,时间30 min。
2.5.2 阳性功能基因克隆测序及分析将PCR产物电泳选择阳性功能基因片段切胶回收,与pGM-T载体连接,再进行质粒转化,将转化的感受态细菌涂布在含有相应氨苄抗生素的LB固体培养基上,37 ℃培养16 h后挑取单克隆,37 ℃摇菌3 h后进行菌液PCR鉴定,选择阳性克隆提取质粒后送至上海英潍捷基生物技术公司进行测序。
登录NCBI官网(http://www.ncbi.nlm.nih.gov/tools/vecscreen/),使用VecScreen程序去除测序中载体序列;使用DNAMAN8.0软件将目的核酸序列转换为氨基酸序列;最后利用BLASTp程序进行氨基酸序列同源性比对。
2.6 菌株鉴定 2.6.1 形态学观察采用ISP2培养基于28 ℃条件下进行埋片培养[16],培养7、14 d分别取出埋片,用光学显微镜观察基内菌丝、气生菌丝的形态特征,扫描电镜观察孢子丝及孢子形态特征。
2.6.2 培养特征参照国际链霉菌计划[17]选用培养基ISP2、ISP3、ISP4、ISP5、ISP7、察氏琼脂、马铃薯浸汁琼脂、营养琼脂接种,28 ℃培养7、14、21、28 d后分别观察记录基内菌丝、气生菌丝的生长情况及可溶性色素。
2.6.3 生理生化特征检测pH值、盐浓度和温度耐受性、唯一碳源、氮源利用、明胶液化、牛奶凝固与胨化、纤维素水解、硝酸盐还原、H2S的产生、淀粉水解、尿素的利用、氧化酶的产生等指标,利用北京陆桥微生物生化微量鉴定管获得唯一碳源及酶特性指标。实验方法参照《放线菌系统学—原理方法及实践》[18]和《链霉菌鉴定手册》[19]。
2.6.4 16 S rRNA序列测定及分析16 S rRNA序列扩增引物:PA为5’-AGAGTTTGATCCTGGCTC-AG-3’;PB为5’-AAGGAGGTGATCCAGCCGCA-3’。PCR反应总体积50 μL。PCR扩增条件:95 ℃预变性5 min,95 ℃变性1 min,54 ℃退火45 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸10 min。产物测序由上海英潍捷基生物技术公司完成。依据测序结果,在EzTaxon database核酸数据库中进行菌株16 S rRNA基因序列比对。选取相似性较高菌株序列,用ClustalX和MEGA 4.0软件包采用邻接法(Neighbor-Joining method)进行聚类分析系统进化树构建,拓扑结构分析采用1 000次重复取样。
3 结果与分析 3.1 菌株13-85抑菌活性菌株13-85发酵液对10种检定菌均有一定的抑菌活性,对耻垢分支杆菌的抑菌圈直径高达(25.3±0.6)mm,除对铜绿假单胞菌抑菌效果较差外,其余菌株抑菌圈直径均大于13 mm(表 1)。
|
|
表 1 菌株13-85发酵液抑菌活性 (x±s±s,n = 3) Table 1 Antibacterial activity of fermentation broth of strain 13-85 (x±s,n = 3) |
3.2 放线菌13-85菌株发酵液稳定性
检定菌中选择耐药菌株(E. coli ATCC35218、MRSA12-1、MRSA43300)、真菌白色念珠菌Candidaalbicans (C. P. Robin) Berkhout、分枝杆菌草分枝杆菌Mycobacteriumphei Lehmann & Neumann以及抑菌效果较弱的铜绿假单胞菌Pseudomonasaeruginosa (Schroeter) Migula作为稳定性测定的指示菌。
3.2.1 光照稳定性将菌株发酵液放置在室温条件下光照处理24~48 h,发酵液抑菌活性基本没有变化;处理48 h后发酵液对铜绿假单胞菌和草分枝杆菌抑制作用明显下降(图 1-A);72 h时对大肠杆菌耐药菌株(E. coli ATCC35218)抑菌活性略微降低;说明菌株发酵液在室温光照条件下较为稳定。
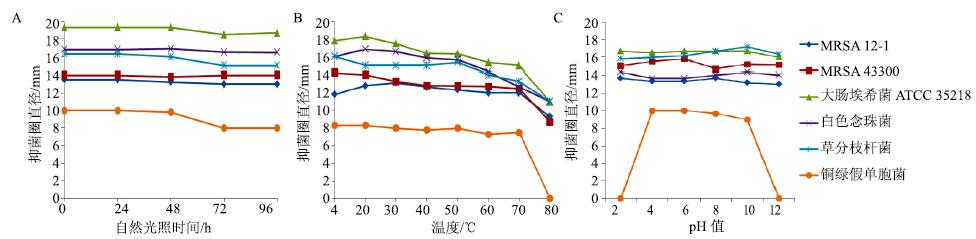
|
图 1 菌株13-85发酵液在不同条件下抑菌活性变化 Fig.1 Stability of fermentation broths of 13-85 under different conditions |
3.2.2 温度条件稳定性
发酵液在4~20 ℃抑菌活性稳定,30 ℃以后,随着温度的升高抑菌活性出现小幅降低,70 ℃后抑制活性明显下降,对耐药大肠杆菌E. coli ATCC35218抑菌圈从20 ℃的18.33 mm降至11.00 mm,对铜绿假单胞菌抑制作用消失(图 1-B)。因此,在分离提纯发酵液中活性物质时,温度控制在4~30 ℃效果最佳。
3.2.3 酸碱稳定性菌株13~85原始发酵液pH为7.5,当发酵液pH值为2~10时,对供试耐药菌株及草分枝杆菌抑制作用无显著变化,但当pH小于4和大于8时,对铜绿假单胞菌抑制活性明显下降至消失。因此,将pH值控制在4~8对于发酵液中活性物质分离纯化最有利(图 1-C)。
3.3 菌株13-85功能基因菌株13-85功能基因PCR扩增结果见图 2,分别得到PKSII基因及NRPS基因扩增产物。克隆测序得到PKS II基因长度为613 bp,编码203个氨基酸,经BLASTp比对与Genbank数据库中费氏链霉菌Streptomycesfradiae聚酮合酶(PKS)部分结构域同源性为89%;非核糖体肽合成酶(NRPS)基因序列长度为712 bp,编码236个氨基酸,经BLASTp比对与Genbank数据库中Streptomycesvirginiae的NRPS同源性高达95%,表明所克隆核苷酸序列是PKSII和NRPS结构域基因序列。
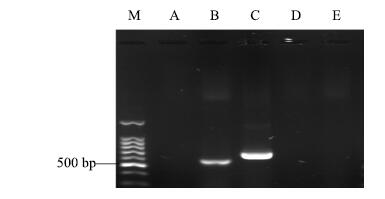
|
M-Marker A-PKS Ⅰ B-PKS Ⅱ C-NRPS D-CYP E-Halo 图 2 菌株13-85功能基因电泳图 Fig.2 Electrophoregram of strain 13-85 functional genes |
3.4 菌株13-85分类鉴定 3.4.1 菌株13-85形态特征
菌株13-85在ISP2培养基生长良好(图 3),菌落坚实致密,菌落表面干燥有褶皱,气生菌丝丰富呈灰白色。孢子链长,孢子成圆柱状,表面向内凹陷(图 4)。
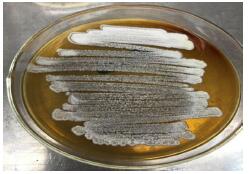
|
图 3 菌株13-85在ISP2培养基上的生长状况 Fig.3 Cultural of strain 13-85 on ISP2 media |
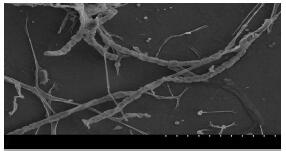
|
图 4 扫描电子显微镜观察菌株13-85孢子丝 Fig.4 Spore hyphae of strain 13-85 on ISP2 medium scanned by SEM |
3.4.2 菌株13-85培养特征
菌株13-85在ISP2、ISP3、ISP4、ISP7以及马铃薯浸汁琼脂中生长良好,基内菌丝丰富,通常呈乳白色至黄色或棕黄色。在多数培养基上出现大量白色或灰白色气生菌丝,如ISP2、ISP3和葡萄糖-天冬酰胺琼脂培养基,在部分供试培养基上可以产生可溶性色素。在不同培养基上的生长情况见表 2。
|
|
表 2 菌株13-85的培养特征 Table 2 Cultural characteristics of strain 13-85 on different media |
3.4.3 生理生化特征
菌株13-85在pH值6.0~8.5条件下均可生长,最适pH为7.5~8.0;生长温度范围为15~45 ℃,28 ℃生长状态最好;菌株13-85在NaCl为0~3%培养基上生长;菌株能够使牛奶凝固,过氧化氢酶阳性,不产生脲酶、氧化酶、H2S;能够以葡萄糖、果糖、肌醇、乳糖等为碳源生长;所测试氮源中能够利用酪蛋白、L-谷氨酸、L-甲硫氨酸、L-丙氨酸、DL-丙氨酸等(表 3)。
|
|
表 3 菌株13-85生理生化特征 Table 3 Physiological and biochemical characteristics of strain 13-85 |
3.4.4 16 S rRNA序列测定结果与进化树构建
测得菌株13-85 16 S rRNA序列全长1 440 bp,在EzTaxon database核酸数据库比对,发现菌株13-85与链霉菌属Streptomyces菌株高度相关,是链霉菌属的成员。选取比对后相似性较高的菌株,经MEGA4.0分析构建的统进化树(图 5),菌株13-85与该属的典型菌株Streptomyces amritsarensis 2AT以极高的基因序列相似性(99.65%)聚于一个系统进化分支上,结合形态特征、生理生化特征及系统发育树分类鉴定结果,初步将菌株13-85鉴定为链霉菌属有效发表种Streptomycesamritsarensis Sharma[20]的1个菌株。
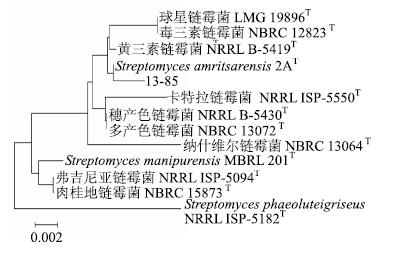
|
图 5 菌株13-85系统发育树 Fig.5 Phylogenetic tree of strain 13-85 based on 16 S rRNA complete sequences |
4 讨论
目前临床应用的抗生素主要来源于链霉菌属。链霉菌属代谢产物除抗生素外,还包括有肿瘤抑制剂、酶抑制剂、木聚糖酶和磷脂酶等[21]。由于链霉菌是重要的天然活性产物或药物先导化合物的产生菌,其研究开发倍受重视。本研究通过形态特征、培养特征、生理生化及16 S rRNA系统分析方法等对刺五加内生放线菌菌株13-85进行菌株鉴定,菌株13-85属于链霉菌属有效发表种Streptomycesamritsarensis的1个菌株,目前该菌种尚未有在刺五加药材中分离到的报道。菌株Streptomycesamritsarensis 2AT分离自土壤样本,发酵液中分离得到相对分子质量878.5的脂肽类抗菌活性物质,具有广谱抗菌活性且该物质在70 ℃(1 h)及pH 5.0~9.0条件下活性稳定[22]。本实验结果显示刺五加内生放线菌株13-85发酵液抗菌谱广,对大多检定菌均具有较好且稳定的抗菌活性。功能基因检测结果表明菌株13-85同时具有PKS II及NRPS基因,与其PKS基因序列同源性较高的菌株已有抗菌及多种活性化合物的报道,如同源性89%费氏链霉菌Streptomycesfradiae可产生新霉素(neomycin)。新霉素是糖苷类抗生素,临床上主要用于治疗胃肠及呼吸道感染。还有研究发现新霉素具有巨大的抗HIV潜力[23]。同源性为88%的利迪链霉菌Streptomyceslydicus产生的利迪链菌素(streptolydigin)具有良好的抗肿瘤、抗HIV蛋白酶活性,该化合物还是一个重要的RNA聚合酶抑制剂[24]。与NRPS基因序列同源性为95%的维吉尼亚链霉菌Streptomycesvirginiae[25]可产生寡霉素(oligomycin)[26],据报道寡霉素具有强烈的抗肿瘤、抗真菌、呼吸抑制作用及杀虫等生物学活性。由此可见,该菌株有产生新霉素、利迪霉素、寡霉素等活性物质或相似物质的巨大潜质。而且,该菌株有编码产生聚酮类和多肽类次级代谢产物的基因基础,还有可能通过不同杂合形式的NRPS-PKS介导合成更为复杂的次级代谢产物[27]。因此,菌株13-85是一株具有较高研究开发价值和应用潜力的刺五加内生放线菌株。另外,对菌株的基本生理生化特点及活性产物的稳定性进行了系统研究,该系列结果也将为菌株扩大发酵及多种次级代谢产物的分离纯化打下基础,为深入挖掘稳定性良好的活性成分提供优良菌源。
同时,野生刺五加属于我国濒危药用植物,本研究筛选得到的菌株,所产生的次级代谢产物与宿主植物部分药效相似,可为刺五加生长缓慢、资源紧缺等引起的药源匮乏和生态破坏问题提供新出路,对濒危植物资源的保护具有重要意义。
| [1] | 饶以群, 洪文荣. 从放线菌发现抗生素的振兴[J]. 国外医药:抗生素分册, 2010(6):261–265. |
| [2] | 郑有坤, 刘凯, 熊子君, 等. 药用植物内生放线菌多样性及天然活性物质研究进展[J]. 中草药, 2014, 45(14):2089–2099. |
| [3] | 罗红丽, 林显钊, 张利敏, 等. 百部内生放线菌的分离、分类及次级代谢潜力[J]. 微生物学报, 2012(3):389–395. |
| [4] | 陈萌. 药用植物川楝内生放线菌的分离及鉴定[D]. 雅安:四川农业大学, 2013. |
| [5] | Hasegawa S, Meguro A, Shimizu M, et al. Endophytic ac-tinomycetes and their interactions with host plants[J]. Actinomycetologica, 2006, 20: 72–81. DOI:10.3209/saj.20.72 |
| [6] | 李桂玲. 植物内生真菌抗真菌抗肿瘤活性的研究[D]. 厦门:厦门大学, 2001. |
| [7] | 蔡爱群, 田新莉, 周世宁. 水稻内生放线菌降解酶活性的分析[J]. 韶关学院学报, 2007(3):107–109. |
| [8] | 董梅, 李廷利. 刺五加化学成分及药理作用研究进展[J]. 中医药学报, 2011, 39(3):98–100. |
| [9] | 涂正伟, 周渭渭, 单淇, 等. 刺五加的研究进展[J]. 药物评价研究, 2011, 34(3):213–216. |
| [10] | 方羽生, 杨卫华, 张洪玲, 等. 放线菌对4种病原真菌的拮抗作用初探[J]. 广东农业科学, 2001(5):39–41. |
| [11] | Chun J, Goodfellow M. A phylogenetic analysis of the genus Nocardia with 16S rRNA gene sequence[J]. Int J Syst Bact, 1995, 45(2): 240–245. DOI:10.1099/00207713-45-2-240 |
| [12] | Ayuso-Sacido A, Genilloud O. New PCR primers for the screening of NRPS and systems in actinomycetes:detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J]. Microbial Ecol, 2005, 49(1): 10–24. DOI:10.1007/s00248-004-0249-6 |
| [13] | Ketela M M, Virpi S, Halo L, et al. An efficient approach for screening minimal PKS genes from streptomyces[J]. FEMS Microbiol Lett, 1999, 180(1): 1–6. DOI:10.1111/fml.1999.180.issue-1 |
| [14] | Hwang Y B, Lee M Y, Perk H J, et al. Isolation of putative polyene-productingactinomycetes strains via PCR-based genome screening for polyene-specific hydroxylase genes[J]. Proc Biochem, 2007, 42(1): 102–107. DOI:10.1016/j.procbio.2006.06.031 |
| [15] | 朱天骄. 南极放线菌药用资源的调查及次级代谢产物研究[D]. 青岛:中国海洋大学, 2009. |
| [16] | 张纪忠, 黄静娟. 微生物分类学[M]. 上海: 复旦大学出版社, 1990. |
| [17] | Shirling E B, Gottlieb D. Methods for characterization of Streptomyces species[J]. Int J SystBacteriol, 1966, 16(3): 313–340. DOI:10.1099/00207713-16-3-313 |
| [18] | 徐丽华, 李文均. 放线菌系统学——原理[M]. 北京: 科学出版社, 2007. |
| [19] | 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975. |
| [20] | Sharma D, Mayilraj S, Manhas R K. Streptomyces amritsarensis sp. nov., exhibiting broad-spectrum antimicrobial activity[J]. Antonie Van Leeuwenhoek, 2014, 105(5): 943–949. DOI:10.1007/s10482-014-0151-2 |
| [21] | Dharmaraj S. Marine Streptomyces as a novel source of bioactive substances[J]. World J Microbiol Biotechnol, 2010, 26(12): 2123–2139. DOI:10.1007/s11274-010-0415-6 |
| [22] | Sharma D, Mayilraj S, Manhas R K. Purification and characterization of a novel lipopeptide from Streptomyces amritsarensis sp. nov. active against methicillin-resistant Staphylococcus aureus[J]. AMB Express, 2014, 28(4): 50. |
| [23] | 滕慧, 张亚雄. 新霉素研究进展[J]. 三峡大学学报:自然科学版, 2008(2):95–98. |
| [24] | 周雍进. 利迪链霉菌初级代谢关键基因的克隆与功能分析[D]. 天津:天津大学, 2008. |
| [25] | Zhang Y, Han M Z, Zhu S L. Studies on the function and catalytic mechanism of O-methyl transferases SviOMT02, SviOMT03 and SviOMT06 from Streptomyces virginiae IBL14 IBL14[J]. Enzyme Microb Technol, 2015, 6: 73–74. |
| [26] | 林秀萍, 刘永宏, 李季伦. 寡霉素的研究进展[J]. 中国抗生素杂志, 2012(9):662–665. |
| [27] | 陈瑞勤, 廖丽, 张晓华, 等. 北极海洋链霉菌604F的卤化酶基因克隆及特征[J]. 微生物学报, 2014(6):703–712. |
 2017, Vol. 48
2017, Vol. 48


