2. 吉林农业大学生命科学学院, 吉林 长春 130118;
3. 吉林农业大学中药材学院, 吉林 长春 130118
2. College of Life Sciences, Jilin Agricultural University, Changchun 130118, China;
3. College of Traditional Chinese Medicine, Jilin Agricultural University, Changchun 130118, China
红花Carthamus tinctorius L. 是我国传统大宗中药材之一,为菊科(Compositae)红花属Carthamus L. 一年生或二年生草本植物,又名红兰花、刺红花、草红花等[1-2]。我国红花的主产区主要在新疆、四川、云南、河南等省区[3-4]。自古以来,红花以活血通经、散瘀止痛等功效而得到广泛使用,在心血管、神经系统及免疫系统等方面均具有一定的药理活性。红花籽粒中含有丰富的不饱和脂肪酸、蛋白质和氨基酸等活性物质,通常用来榨取红花油作为食用油,剩余的红花籽粕作为废料弃之,十分可惜。据文献报道,去壳去油后的红花籽粕中还含有丰富的蛋白质和痕量的氨基酸等物质,并已被认定为非常规饲料。但是由于赖氨酸、蛋氨酸等必需氨基酸的量极低,远远不能满足动物饲料的要求。因此,利用现代分子育种技术来提高红花籽粒中必需氨基酸的量,是将红花籽粕开发成具有科技含量和高经济附加值产品的可行途径,也将进一步扩其应用范围。
赖氨酸、苏氨酸、蛋氨酸和异亮氨酸这4种必需氨基酸的生物合成依赖于天冬氨酸代谢途径。赖氨酸合成有多个关键酶的参与,其中二氢吡啶二羧酸合酶(dihydrodipicolinate synthase,DHDPS)是催化赖氨酸合成的第1个关键酶[5-6]。该基因在20世纪90年代就已经在小麦、玉米、大豆、拟南芥、烟草等植物中克隆出来[7-11]。DHDPS包括2种亚型DHDPSI和DHDPSII,在进化上非常保守。DHDPSI基因最早从拟南芥中分离出来[12],其中DHDPSI中含有1个内含子,DHDPSII中含有2个内含子且内含子位置与DHDPSI中该内含子的位置相似,2种基因亚型的表达也相似,核苷酸序列同源性为84%[13-14]。通过在拟南芥中干扰DHDPS的表达,发现在控制赖氨酸合成过程中DHDPS起着关键的作用。目前有关DHDPS基因在红花种子赖氨酸合成途径中的作用机制研究,国内外尚未见相关研究报道。
本实验以红花不同发育时期籽粒转录组分析数据为基础,设计特异性引物,分离红花DHDPS(CtDHDPS)基因片段并研究其在红花不同发育时期籽粒中的表达量,旨在为研究该基因的生物学功能及其在红花赖氨酸生物合成途径中作用的分子机制提供理论依据。
1 材料与试剂 1.1 材料红花种子购自新疆红花缘科技有限公司,经吉林农业大学中药材学院杨世海教授鉴定为红花Carthamus tinctorius L.,在吉林农业大学生物反应器与药物开发教育部工程中心基地种植,5月初进行播种,于7月中旬红花头状花序抽出花丝开始挂牌标记,此时子房尚未开始发育,每隔1 d采集1次,液氮速冻,存于-80 ℃冰箱中,备用。
1.2 试剂反转录试剂盒(RP6601)购于北京百泰克生物技术有限公司;限制性内切酶、LA Tap、DNA聚合酶购于百奥生物有限公司;pEASY-T1 Cloning Kit购于北京全式金生物技术有限公司;胶回收试剂盒与质粒提取试剂盒购于Axygen生物技术有限公司;荧光定量试剂盒(RP420A)购于大连宝生物工程有限公司。
1.3 引物本实验所用引物由北京金唯智生物科技有限公司合成,见表 1。
|
|
表 1 引物序列 Table 1 Primers sequences |
2 方法 2.1 红花种子总RNA的提取及cDNA的合成
采集红花种子于液氮中速冻,存于-80 ℃冰箱中备用。根据RNAisoPlus试剂说明书提取红花种子总RNA,利用微量核酸蛋白检测仪检测总RNA的浓度及纯度,1%琼脂糖凝胶电泳检测总RNA的完整性。根据反转录试剂盒说明书进行cDNA的反转录,所得cDNA于-20 ℃冰箱中保存备用。
2.2 CtDHDPS基因片段的分离以反转录获得的cDNA为模板,利用核心片段引物(表 1),按照表 2所示的RT-PCR反应体系与反应条件进行CtDHDPS基因的克隆。PCR产物使用1%琼脂糖凝胶进行凝胶电泳,按照胶回收试剂盒说明书操作步骤进行切胶回收。
|
|
表 2 RT-PCR反应体系与条件 Table 2 RT-PCR reaction system and conditions |
2.3 阳性克隆的筛选与鉴定
取4 μL胶回收产物与1 μL pEASY-T1载体混合,于PCR仪中25 ℃反应10 min。将连接产物加到50 μL Trans-T1感受态中,冰浴30 min,42 ℃热激30 s,冰浴2 min,加入250 μL不含抗生素的液体LB培养基,37 ℃,200 r/min振荡培养1 h后均匀涂在含有卡那霉素的固体LB培养皿中,37 ℃培养过夜。次日挑取单菌落,将经过PCR验证为阳性的样品,提取质粒,双酶切鉴定正确后送到上海生工生物技术有限公司测序。
2.4 CtDHDPS基因片段的序列分析将测序正确的CtDHDPS基因在NCBI网站上进行BLAST分析,并与其他物种的DHDPS基因进行同源性比较。
2.5 红花不同发育时期种子中CtDHDPS基因的表达分析提取红花不同发育时期籽粒总RNA,反转录成cDNA。以EF1A和60 S作为内参基因,根据CtDHDPS基因片段设计荧光定量分析所需的引物,见表 1。采用2步法,分析CtDHDPS在不同发育时期红花籽粒中的表达量,内参与样品设置3个复孔,根据表 3所示的反应体系与反应条件进行RT-PCR。
|
|
表 3 RT-PCR反应体系与反应条件 Table 3 RT-PCR reaction systems and conditions |
3 结果与分析 3.1 红花种子总RNA的提取
按照RNAisoPLUS提取试剂盒说明书提取红花种子总RNA,经1%琼脂糖凝胶电泳检测结果(图 1),红花种子总RNA有28 S与18 S 2条带,且28 S带的亮度大概是18 S带的2倍,说明所提红花RNA无降解,完整性较好,可以用于后续实验。经微量核酸检测仪检测红花种子总RNA质量浓度均在1 μg/μL左右,可以满足后续实验的要求。

|
1~2-红花种子总RNA 1—2-Total RNA in safflower seed 图 1 红花种子总RNA电泳图 Fig.1 Eletrophoresis of total RNA in safflower seed |
3.2 目的片段的RT-PCR扩增
根据上述步骤提取的红花种子总RNA,反转录成cDNA,以cDNA为模板,利用核心片段引物进行RT-PCR扩增。经琼脂糖凝胶电泳检测扩增产物在396 bp处有1条特异性条带(图 2)。
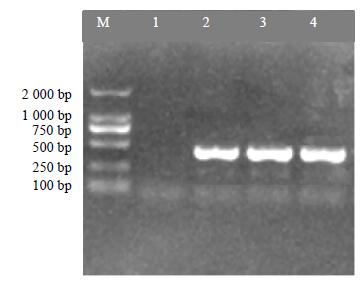
|
M-Marker 1-阴性对照 2~4-CtDHDPS核心片段 M-Marker 1-NC 2—4-core fragment of gene encoding CtDHDPS 图 2 CtDHDPS基因核心片段RT-PCR电泳图 Fig.2 Core fragment of gene encoding CtDHDPS in safflower amiplified by RT-PCR |
3.3 目的片段克隆载体构建及测序检测
通过胶回收纯化目的片段,并连接pEASY-T1克隆载体,将连接产物转化Trans-T1感受态细胞,随机挑取9个单克隆进行菌液PCR验证,全部为阳性克隆(图 3),提取质粒酶切验证(图 4),小片段与目的条带大小一致,送至苏州金唯智有限公司进行测序。
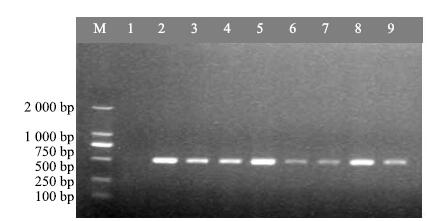
|
M-Marker 1-阴性对照 2~9-CtDHDPS核心片段 M-Marker 1-negative control 2—9-core fragment of gene encoding CtDHDPS 图 3 pEASY-T1-CtDHDPS重组质粒菌液PCR鉴定 Fig.3 PCR identification of recombinant plasmid of pEASY-T1-CtDHDPS |
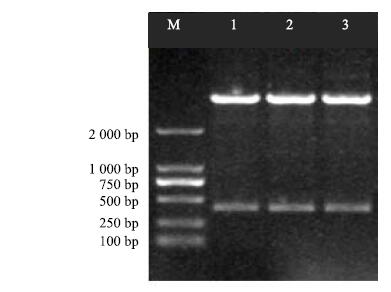
|
M-Marker 1—3-SpeI/XbaI double-enzyme digestion of pEASY-T1-CtDHDPS 图 4 pEASY-T1-CtDHDPS重组质粒酶切鉴定 Fig.4 Double-enzyme digestion identification of recombinant plasmid |
3.4 CtDHDPS基因片段的序列分析
利用DNAMAN5.0软件将CtDHDPS基因片段测序结果与红花转录物组中筛选得到的Unigene序列进行比对,无碱基突变,表明测序结果完全正确。将CtDHDPS片段进行Blastn分析表明,CtDHDPS基因片段长度为396 bp(图 5),与其他物种的DHDPS基因具有较高的相似性,说明CtDHDPS基因片段确实存在于红花种子中,利用Mega6.0软件将CtDHDPS基因与其他植物中DHDPS基因进行氨基酸序列同源性分析并构建系统发育树(图 5),结果表明CtDHDPS基因与葡萄亲缘性较近,与蓖麻等植物亲缘性较远。
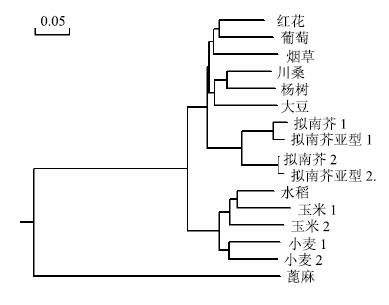
|
图 5 CtDHDPS氨基酸序列系统发育树分析 Fig.5 Phylogenetic tree analysis of gene encoding CtDHDPS in safflower |
3.5 红花不同发育时期种子中CtDHDPS基因的表达分析
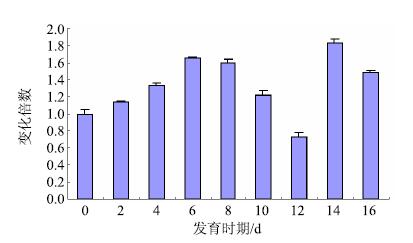
提取新疆裕民无刺红花不同发育时期种子总RNA,反转录成cDNA,以EF1A与60 S为内参,采用qRT-PCR技术检测CtDHDPS基因在红花不同发育时期种子中的表达量,结果见图 6。根据相对表达量分析所示,CtDHDPS基因在红花不同发育时期种子中表达量呈现先升高后降低,然后骤然上升又下降的趋势,且在开花后14 d种子中表达量最高,开花后12 d种子中表达量最低。
|
图 6 不同发育时期红花种子中CtDHDPS基因的相对表达量 Fig.6 Relative expression analysis of CtDHDPS in different development periods of safflower seeds |
4 讨论
DHDPS是控制高等植物赖氨酸生物合成最为关键的限速酶,目前对DHDPS基因的研究主要集中在如何调控该酶的活性以最大限度地减少终产物对其的负反馈调节作用,进而提高终产物的含量[15]。本实验在红花转录组测序分析结果的基础上,运用分子克隆技术分离得到CtDHDPS的基因片段,长度为396 bp,为进一步获得该基因的全长序列奠定基础。经红花转录组数据分析发现,DHDPS在红花中也存在2个亚型。同时在NCBI数据库中搜索出16条不同物种中DHDPS氨基酸序列并进行系统发育树的分析,发现红花CtDHDPS与葡萄DHDPS亲缘关系最近,红花与葡萄均属于双子叶植物纲,表明该基因在进化上具有一定的保守性。
随着科学的进步,荧光定量技术已成为用于基因定量分析的主要手段[16],本研究采用荧光定量技术进行了CtDHDPS基因在红花不同发育时期种子中的表达量分析,结果表明随着种子的逐渐发育,该基因的表达量呈先升高后降低,又骤然上升再下降的趋势,在开花后14 d表达量最高,说明该时期为CtDHDPS基因研究的最佳时期。本实验一方面为阐明CtDHDPS基因的生物学功能奠定基础,另一方面为解析CtDHDPS基因在红花赖氨酸生物合成途径中作用的分子机制提供科学依据,同时也为红花的分子育种工作提供重要候选基因。
| [1] | 杨玉霞, 吴卫, 郑有良. 红花研究进展[J]. 四川农业大学学报, 2004, 22(4):365–369. |
| [2] | 王兆木, 陈跃华. 红花及其开发利用[J]. 新疆农业科学, 1995(5):203–205. |
| [3] | Zhou X, Tang L, Xu Y, et al. Towards a better under-standing of medicinal uses of Carthamus tinctorius L. in traditional Chinese medicine:A phytochemical and pharmacological review[J]. Ethnopharmacol, 2014, 151(1): 27–43. DOI:10.1016/j.jep.2013.10.050 |
| [4] | 扈晓佳, 殷莎, 袁婷婷, 等. 红花的化学成分及其药理活性研究进展[J]. 药学实践杂志, 2013, 31(3):161–168. |
| [5] | Jander G, Joshi V. Recent progress in deciphering the biosynthesis of aspartate-derived amino acids in plants Molecular plant[J]. Molecular Plant, 2010, 3(1): 54–65. DOI:10.1093/mp/ssp104 |
| [6] | Azevedo R A, Arruda P, Turner W L, et al. The biosynthesis and metabolism of the aspartate derived amino acdis in high plants[J]. Phytochemistry, 1997, 46(3): 395–419. DOI:10.1016/S0031-9422(97)00319-1 |
| [7] | Kaneko Y, Hashimoto T, Kumpaisal R. Molecular cloning of wheat dihydropicolinate synthase[J]. Biol Chem, 1990, 265(29): 17451–17455. |
| [8] | Frisch D A, Tommey A M, Gengenbach B G, et al. Directgenetic selection of a maize cDNA for dihydropicolinate synthase in an Escherichia coli dapA-auxotroph[J]. Mol Gen Genet, 1991, 228(1): 287–293. |
| [9] | Silk G W, Matthews B F, Somers D A, et al. Cloning and expression of the soybean DapA gene encoding dihydrodipicolinate synthase[J]. Plant Mol Biol, 1994, 26(3): 989–993. DOI:10.1007/BF00028865 |
| [10] | Vauterin M, Jacobs M. Isolation of a poplar and an Arabidopsis thaliana dihydrodipicolinate synthase cDNA clone[J]. Plant Mol Biol, 1994, 25(3): 545–550. DOI:10.1007/BF00043882 |
| [11] | Ghislain M, Frankard V, Jacobs M. A dinucleotide mutation in dihydrodipicolinate synthase of Nicotiana sylvestris leads to lysine overproduction[J]. Plant J, 1995, 8(5): 733–743. DOI:10.1046/j.1365-313X.1995.08050733.x |
| [12] | Vauterin M, Frankard V, Jacobs M. The Arabidopsis thaliana dhdps gene encoding dihydrodipicolinate synthase, key enzyme of lysine biosynthesis, is expressed in a cell-specific manner[J]. Plant Mol Biol, 1999, 39(4): 695–708. DOI:10.1023/A:1006132428623 |
| [13] | Craciun A, Jacobs M, Vauterin M. Arabidopsis loss-of-function mutant in the lysine pathway points out complex regulation mechanisms[J]. Febs Lett, 2000, 487(2): 234–238. DOI:10.1016/S0014-5793(00)02303-6 |
| [14] | Sarrobert C, Thibaud M C, Contard-David P, et al. Identification of an Arabidopsis thaliana mutant accumulating threonine resulting from mutation in a new dihydrodipicolinate synthase gene[J]. Plant J, 2000, 24(3): 357–367. DOI:10.1046/j.1365-313x.2000.00884.x |
| [15] | Bochaute P V, Novoa A, Ballet S, et al. Regulatory mechanisms after short-and long-term perturbed lysine biosynthesis in the aspartate pathway:the need for isogenes in Arabidopsis thaliana[J]. Physiol Plant, 2013, 149: 449–460. DOI:10.1111/ppl.2013.149.issue-4 |
| [16] | Pucci M, D'Addario C. Assessing gene expression of the endocannabinoid system[J]. Methods Mol Biol, 2016, 1412: 237–246. DOI:10.1007/978-1-4939-3539-0 |
 2017, Vol. 48
2017, Vol. 48


