2. 苏州大学药学院, 江苏 苏州 215123;
3. 澳门大学, 中华医药研究所, 澳门 999078
2. College of Pharmaceutical Science, Soochow University, Suzhou 215123, China;
3. State Key Laboratory of Quality Research in Chinese Medicine, Institute of Chinese Medicine, Institute of Chinese Medical Sciences, University of Macau, Macao 999078, China
鹿茸草始载于《植物名实图考》,又名千年艾、千重塔、瓶儿蜈蚣草、山门穹、千层矮、龙须草、白路箕、毛茵陈、白丝草、土茵陈、栀子草、牙痛草、白头翁、六月霜、白山艾、白龙骨、白杉笠、千年春、千年霜、满山白、白头毛、白鸡毛、四季青、瓜子草、老鼠牙草等,为玄参科鹿茸草属植物绵毛鹿茸草Monochasma savatieri Franch. 的干燥全草,是中药保护品种炎宁颗粒[1]的主要成分之一。生于低山多沙山地及草丛中,分布于我国江苏、浙江、福建、江西等地[2]。其性平,微苦,具有凉血止血、清热解毒、祛湿止痛等功效,临床常用于治疗感冒、心中烦热、咳嗽、吐血、风湿骨痛等疾 病[3]。迄今国内外对鹿茸草的研究较少,Zheng等[4]从鹿茸草中分离出酚酸、黄酮、三萜、有机酸类化合物;师梦凡[5]和朱莹莹[6]研究了其中的苯乙醇苷类成分,并发现其具有心肌保护作用及抗菌活性。
本课题组已经从鹿茸草中分离出12种苯乙醇苷类化合物,均有一定的抗补体活性[7],对鹿茸草中的总苯乙醇苷部位的活性进行研究,显示出其具有较好的抗菌、抗炎、抗氧化的作用[8-11]。为了明确鹿茸草的抗炎作用物质基础,并为其进一步的生物活性研究提供足够样品,本实验首次利用大孔吸附树脂[12-13]和动态轴向系统对鹿茸草中3种苯乙醇苷类化合物麦角甾苷(acteoside)、异麦角甾苷(isoacteoside)、torenoside B的分离制备工艺进行了研究。
1 仪器与材料ELLEN旋转蒸发仪,东京理化器械独资工厂;恒温振荡箱,江苏太仓华利达实验设备有限公司;高效液相色谱仪,岛津LC-20AB,SPD-20A,日本岛津公司;C18分析色谱柱(250 mm×4.6 mm,5 μm),美国Kromasil公司;动态轴向压缩制备柱(DAC柱系统,150 cm×10 cm,HB-DAC-100;填充料为ODS,10 μm,1.8 kg),江苏汉邦科技有限公司;CPA225D Sartotius电子天平,上海中殷医疗设备有限公司;HY-318鼓风干燥箱,恒宇仪器公司。
鹿茸草原药材20 kg购于亳州药材市场,经苏州大学药学院李笑然教授鉴定为玄参科鹿茸草属植物绵毛鹿茸草Monochasma savatieri Franch. 的干燥全草;麦角甾苷、异麦角甾苷、torenoside B为本实验室分离得到,HPLC-ELSD显示质量分数≥98%;AB-8、LX-11、LX-17、LX-38、XDA-6大孔吸附树脂,均购自西安蓝晓科技有限公司;D101、HPD-100、LSA-10大孔吸附树脂,均购自沧州宝恩化工有限公司;色谱甲醇与工业酒精,国药集团化学试剂有限公司;水为去离子水;其他试剂均为分析纯。
2 方法与结果 2.1 麦角甾苷、异麦角甾苷、torenoside B 定量测定方法 2.1.1 色谱条件色谱柱为Kromasil C18柱(250 mm×4.6 mm,5 μm);检测波长330 nm;柱温30 ℃;体积流量1 mL/min;流动相为甲醇-水(含0.01%甲酸),梯度洗脱条件:0.01~5 min,0~35%甲醇;5.01~30 min,35%~41%甲醇;30.01~35 min,41%~100%甲醇;各对照品峰理论塔板数均不低于5 000,拖尾因子在0.95~1.05,相邻两峰的分离度(R)≥1.5,系统适用性良好。
2.1.2 线性关系考察分别精密称取麦角甾苷2.34 mg、异麦角甾苷2.43 mg、torenoside B 3.38 mg至10 mL量瓶中,加甲醇定容、摇匀,分别得到麦角甾苷0.234 mg/mL、异麦角甾苷0.243 mg/mL、torenoside B 0.338 mg/mL的对照品溶液。
分别精密吸取上述对照品溶液2.5、5.0、7.5、10.0、12.5、15.0 μL,按上述色谱条件进行测定,以测得的各成分峰面积为纵坐标(Y),进样量为横坐标(X),分别计算线性回归方程为麦角甾苷Y= 1×106 X-19 701,R2=0.999 9;异麦角甾苷Y= 1×106 X+120 045,R2=0.999 7;torenoside B Y=465 867 X-21 667,R2=0.999 8;其进样质量浓度分别在0.59~4.51 μg、0.61~4.65 μg、0.54~4.66 μg线性关系良好。
2.2 鹿茸草样品溶液的制备称取干燥粉碎后的鹿茸草粗粉(40目)1 kg,加10倍量70%乙醇回流提取3次,每次2 h,合并提取液,滤过,滤液减压浓缩至无醇味,加6倍量蒸馏水冰箱冷藏过夜,离心,上清液减压浓缩得质量浓度为1.0 g/mL的鹿茸草上样原液,备用。
2.3 大孔树脂预处理根据大孔树脂附带的说明书进行预处理,依次进行醇洗→水洗→酸性→水洗→碱洗→水洗等步骤洗去大孔树脂中的致孔剂等杂质[14-15],先用乙醇浸泡大孔树脂24 h,滤过,用去离子水洗至无醇味;随后对大孔树脂进行酸碱处理,先用5% HCl溶液浸泡3 h,滤过,用去离子水洗至pH为中性,接着用5% NaOH溶液浸泡3 h,滤过,用去离子水洗至pH为中性;最后将大孔树脂在80 ℃以下烘干至恒定质量,备用。实验所用各大孔吸附树脂的物理性能见表 1。
|
|
表 1 各型号大孔吸附树脂的物理性能 Table 1 Physical characteristics of eight macroporous resins |
2.4 大孔吸附树脂型号的筛选
取预处理过的大孔树脂干质量约1.0 g,置于具塞锥形瓶中,加入鹿茸草上样原液25 mL,盖紧瓶塞,置于恒温振荡箱于25 ℃下振荡6 h,振荡频率为180次/min,使大孔树脂充分吸附目标物质,待吸附平衡后,滤过,用HPLC测定不同大孔树脂吸附前和吸附后滤液中剩余的目标物质质量浓度,比较吸附量(Qe)[12-13, 16-17];加入适量去离子水清洗吸附饱和的大孔树脂,滤过,重复清洗2~3次至滤液澄清,加入95%乙醇20 mL,盖紧瓶塞,置于恒温振荡箱于25 ℃下振荡6 h,振荡频率为180次/min,使大孔树脂充分解除吸附,滤过,HPLC测定不同大孔树脂解吸附下的目标物质质量浓度,比较解吸附率(D)[12-13, 16-17]。试验重复3次。
Qe=(C0-Ce)Vi/W
D=CdVd/(C0-Ce)Vi
Qe为吸附平衡后树脂的吸附量(mg/g),C0为吸附前溶液中目标物质的质量浓度(mg/mL),Ce为吸附后溶液中剩余的目标物质的质量浓度(mg/mL),Vi为样品体积(mL),W为树脂质量(g),Cd为解吸附液中目标物质的质量浓度(mg/mL),Vd为洗脱液体积(mL)
8种大孔树脂对鹿茸草上样原液中麦角甾苷、异麦角甾苷、torenoside B的Qe、解吸附量和解吸附率见表 2、3,其中LX-17和LX-38对麦角甾苷、异麦角甾苷、torenoside B的Qe要高于其他树脂;LX-17、LX-38和AB-8的解吸附量和D较高,综合来看LX-17更好,故选择LX-17进行下一步分离实验。
|
|
表 2 8种大孔吸附树脂对目标物质的Qe (静态吸附试验)(x±s,n = 3) Table 2 Adsorption contents of target compounds (static adsorption) (x±s,n = 3) |
|
|
表 3 8种大孔吸附树脂对目标物质的解吸附量和解吸附率 (静态解吸附试验) (x±s,n = 3) Table 3 Desorption contents and D of target compounds (static desorption) (x±s,n = 3) |
2.5 LX-17 型大孔树脂对麦角甾苷、异麦角甾苷、torenoside B 吸附的影响因素考察 2.5.1 最短吸附时间考察
称取预处理过的大孔树脂干质量约0.2 g,置于具塞锥形瓶中,加入原材料质量浓度为1 g/mL的鹿茸草上样原液10 mL,盖紧瓶塞,置于恒温振荡箱中于25 ℃下振荡6 h,振荡频率为180 次/min,分别在特定间隔时间(0、30、60、90、150、210、270、330 min)取出微量试样溶液,用HPLC测定大孔树脂吸附前和各时间段试样溶液中剩余的目标物质质量浓度,得出各时间段大孔树脂的Qe,重复试验3次。麦角甾苷、异麦角甾苷、torenoside B在LX-17树脂上的动力吸附曲线见图 1。由图 1可知,LX-17对麦角甾苷、异麦角甾苷、torenoside B的Qe随着吸附时间的增加而增加,直到吸附平衡。Qe在前90 min快速增加,之后缓慢增长,最后在150 min后达到吸附平衡,LX-17属于慢吸附型树脂,故LX-17对于3种目标物质的吸附时间应不低于150 min。
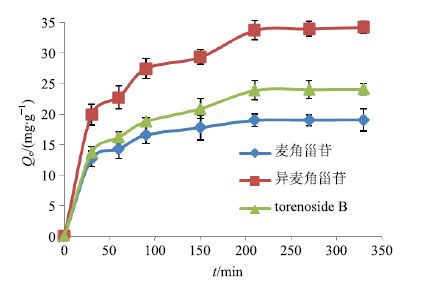
|
图 1 各目标物质在 LX-17 上的动力吸附曲线 Fig.1 Adsorption kinetic curves of target compounds on LX-17 |
2.5.2 最佳上样质量浓度考察
称取预处理过的大孔树脂干质量约1 g,置于具塞锥形瓶中,将鹿茸草上样原液配成相当于原药材质量浓度分别为0.2、0.6、1.0、1.4、1.8、2.0、2.4 g/mL的样品溶液,取10 mL样品溶液加入具塞锥形瓶中,盖紧瓶塞,置于恒温振荡箱中于25 ℃下振荡6 h,振荡频率为180次/min,使大孔树脂充分吸附目标物质,待吸附平衡后,滤过,用HPLC测定不同大孔树脂吸附前和吸附后滤液中剩余的目标物质质量浓度,得出各质量浓度下大孔树脂的Qe。试验重复3次。麦角甾苷、异麦角甾苷、torenoside B在LX-17树脂上的等温吸附曲线见图 2。
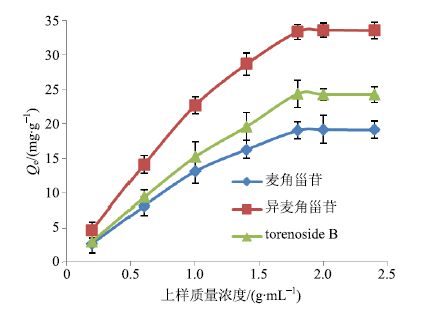
|
图 2 各目标物质在 LX-17 上的等温吸附曲线 Fig.2 Adsorption isotherms of target compounds on LX-17 |
由图 2可知,LX-17对麦角甾苷、异麦角甾苷、torenoside B的Qe随着样品质量浓度的增加而增加,并且在原药材质量浓度为1.8 g/mL时达到饱和,故最佳上样质量浓度是以原药材质量浓度为1.8 g/mL的鹿茸草上样原液上样。
2.5.3 洗脱溶液考察称取预处理过的大孔树脂干质量约14 g,装入玻璃柱(60 cm×3 cm)中,柱体积为50 mL,取原材料质量浓度为2 g/mL的鹿茸草上样原液30 mL上样,待吸附饱和后,先用去离子水冲洗柱子至洗脱液无色(用去离子水4~5 BV),之后用不同体积分数的乙醇(5%、15%、25%、35%、45%、60%、75%、100%)梯度洗脱,每个梯度洗脱6~7 BV,体积流量为2.5 mL/min用HPLC检测每个质量浓度洗脱出目标物质的量。试验重复3次。饱和吸附后的大孔树脂分别用不同体积分数的乙醇洗脱后的洗脱曲线见图 3。由图 3可知,目标物质集中在15%~75%,考虑到目的是精制总目标物质,所以选用水洗4~5 BV,再选用15%乙醇洗脱,以达到去除色素和杂质的目的,最后用60%乙醇洗脱5 BV得到总目标物质,90%乙醇2 BV去重生树脂。
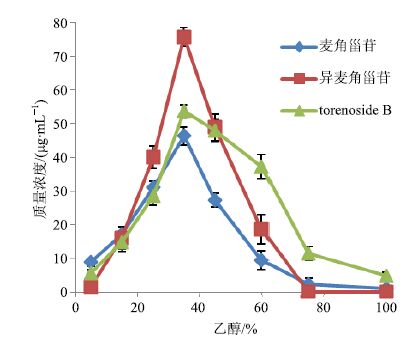
|
图 3 各目标物质在 LX-17 上的动态解吸附曲线 Fig.3 Dynamic desorption curves of target compounds on LX-17 |
2.6 最佳工艺条件确定及其验证(大孔吸附树脂色谱柱放大试验)[18-19]
根据前面对8种大孔树脂的筛选,LX-17的吸附及解吸附性能最佳。最佳上样质量浓度是以原药材质量浓度为1.8 g/mL的鹿茸草上样原液,至少吸附150 min,洗脱时先用去离子水洗脱4~5 BV,随后用15%乙醇洗脱4 BV,除去色素和杂质,最后用60%乙醇洗脱5 BV,得到总苯乙醇苷部位,得率为5.25%,其中麦角甾苷15.24%、异麦角甾苷32.14%、torenoside B 29.33%。HPLC色谱图见图 4。
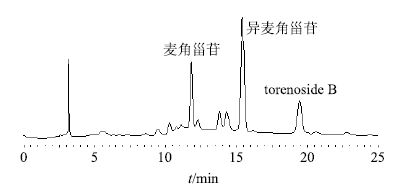
|
图 4 60% 乙醇洗脱部位的 HPLC 图 Fig.4 HPLC of 60% ethanol eluent |
2.7 动态轴向压缩制备柱分离目标物质
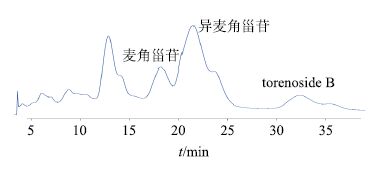
称取5 g总苯乙醇苷部位,用适量甲醇和水溶解成约100 mL的溶液,用42%甲醇水系统作为流动相经过动态轴向压缩制备柱分离,其色谱图见图 5,分离出的麦角甾苷0.127 g,得率2.54%,质量分数为92%;异麦角甾苷0.894 g,得率17.88%,质量分数为95%;torenoside B 0.962 g,得率19.24%,质量分数为98%。
|
图 5 总苯乙醇苷部位经动态轴向压缩制备柱分离 HPLC 图 Fig.5 Preparative HPLC of concentrated extract using a DAC column system |
3 讨论
LX-17被选为最佳的大孔树脂来考察这3种化合物的最佳参数,在生药材质量浓度为1 g/mL时,其最佳上样质量浓度为原药材1.8 g/mL,最佳吸附时间150 min;其洗脱条件:纯水(4 BV)、15%乙醇(4 BV)、60%乙醇(5 BV)以及90%乙醇(2 BV)。随后按比例放大10倍进行中试,选择上述理想参数作为实验条件,得到总苯乙醇苷部位。
近年来动态轴向技术在工业分离领域应用越来越广泛。白头翁皂苷B4、B5以及saikosaponins A、B、C等都是通过运用动态轴向技术进行了大量生产[20-22]。本实验也运用动态轴向技术一次性分离得到了单体的麦角甾苷、异麦角甾苷、torenoside B。由于动态轴向技术流速很快,要进行一次性少量接液多次制备的方法才能得到纯度很高的单体。
| [1] | 潘丽, 申琳. 肠炎宁颗粒治疗小儿消化不良的临床观察[J]. 中草药, 2016, 47(12):2147–2151. |
| [2] | 肖培根. 新编中药志(一)[M]. 北京: 化学工业出版社, 2001. |
| [3] | 国家中医药管理局《中华本草》编委会. 中华本草(上册)[M]. 上海: 上海科技出版社, 1998. |
| [4] | Zheng W, Tan X Q, Guo L J, et al. Chemical constituents from Monochasma savatieri[J]. Chin J Nat Med, 2012, 10(2): 102–104. DOI:10.3724/SP.J.1009.2012.00102 |
| [5] | 师梦凡. 鹿茸草中苯乙醇苷类化学成分的心肌保护作用研究[D]. 苏州:苏州大学, 2013. |
| [6] | 朱莹莹. 鹿茸草中苯乙醇苷的分离制备及抗菌活性研究[D]. 苏州:苏州大学, 2013. |
| [7] | Li M, Shi M F, Liu Y L, et al. Phenylethanoid glycosides from Monochasma savatieri and their anticomplement activity through the classical pathway[J]. Planta Med, 2012, 78(12): 1381–1386. DOI:10.1055/s-0032-1314982 |
| [8] | Jiménez C, Riguera R. Phenylethanoid glycosides in plants:Structure and biological activity[J]. Nat Prod Rep, 1995, 11(6): 591–606. |
| [9] | Pan J, Yuan C S, Lin C J, et al. Pharmacological activities and mechanisms of natural phenylpropanoid glycosides[J]. Pharmazie, 2003, 58(11): 767–775. |
| [10] | Noel J P, Austin M B, Bomat E K. Structure-function relationships in plant phenylpropanoid biosynthesis[J]. Curr Opin Plant Biol, 2005, 8(3): 249–253. DOI:10.1016/j.pbi.2005.03.013 |
| [11] | Li C Q, Li B G, Qi H Y, et al. Three cyclooctapeptides and one glycoside from Microtoena prainiana[J]. J Nat Prod, 2004, 67(6): 978–982. DOI:10.1021/np040021x |
| [12] | 曹馨元, 冯霞, 李茂星, 等. 甘肃马先蒿毛蕊花糖苷和异毛蕊花糖苷制备工艺研究[J]. 中草药, 2016, 47(10):1696–1701. |
| [13] | 崔翰明, 张秋燕, 林海, 等. 三七总皂苷的大孔吸附树脂纯化工艺和质量分析研究[J]. 中草药, 2012, 43(11):2177–2182. |
| [14] | 贾存勤, 李阳春, 屠鹏飞, 等. HPD系列大孔吸附树脂预处理方法研究[J]. 中国中药杂志, 2005, 30(18):1425–1427. |
| [15] | 孙宗喜, 徐桂花, 李艳芳, 等. 大孔树脂纯化绵茵陈中总有机酸和绿原酸的研究[J]. 中药材, 2012, 35(2):306–310. |
| [16] | Sun Y, Yuan H Y, Hao L L, et al. Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin[J]. Food Chem, 2013, 141(1): 533–541. DOI:10.1016/j.foodchem.2013.03.030 |
| [17] | Dong Y, Zhao M M, Sun-Waterhouse D X, et al. Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L. leaf on macroporous adsorption resins[J]. Food Chem, 2015, 168: 538–545. DOI:10.1016/j.foodchem.2014.07.109 |
| [18] | Liu B Y, Ouyang J, Yuan X F, et al. Adsorption properties and preparative separation of phenylethanoid glycosides from Cistanche deserticola by use of macroporous resins[J]. J Chromatogr B, 2013, 937: 84–90. DOI:10.1016/j.jchromb.2013.08.018 |
| [19] | Sun Y, Yuan H Y, Hao L L, et al. Enrichment and antioxidant properties of flavone C-glycosides from trollflowers using macroporous resin[J]. Food Chem, 2013, 141(1): 533–541. DOI:10.1016/j.foodchem.2013.03.030 |
| [20] | Wang L, Xu Q, Su S, et al. Simultaneous purification of pulchinenoside B-4 and B-5 from Pulsatilla chinensis using macroporous resin and preparative high performance liquid chromatography[J]. Ind Eng Chem Res, 2012, 51(45): 14859–14866. DOI:10.1021/ie302165v |
| [21] | Sakuma S, Motomura H. Purification of saikosaponin-a, saikosaponin-C and saikosaponin-D-application of large-scale reversed-phase high-performance liquid- chromatography[J]. J Chromatogr A, 1987, 400: 293–295. DOI:10.1016/S0021-9673(01)81624-1 |
| [22] | Medina I. Purification of zopiclone by preparative high performance liquid chromatography[J]. J Liq Chromatogr R T, 1998, 21(17): 2689–2698. DOI:10.1080/10826079808003416 |
 2017, Vol. 48
2017, Vol. 48


