中药最大的特点就是按照一定的组方规律配伍构成复方应用于临床,同样的药材由于组方配伍不同,其疗效和副作用都会有所差别,根本原因在于其药效活性成分或/和毒性成分的组成或/和量发生了变化[1-5]。大黄Rhei Radix et Rhizoma为蓼科大黄属植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum Maxim. ex Balf. 或药用大黄Rheum officinale Baill. 的干燥根和根茎,又称“将军、川军”,具有泻下攻积、清热泻火、解毒止血、活血化瘀、清利湿热的功能,其在临床上应用十分广泛[6-8]。现代药理研究表明,蒽醌是大黄及其方剂的主要活性成分[9],包括游离及结合型大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚等[10-11]。大黄起泻下作用的有效成分是结合蒽醌类和番泻苷类[12]。番泻苷类成分在大黄药材中的量是非常低的,因而其发挥泻下作用的主要成分为结合蒽醌,而结合蒽醌在体内发挥泻下作用是通过其在肠道降解成为游离蒽醌后产生的[13]。游离蒽醌为寒性成分且具多种药理作用。大黄酸具有抗肿瘤、抗菌、抗血管新生、抗肝纤维化等多种药理作用[14-15],大黄素具有保肝、护肝作用[16-17]。在复方中成药里,大黄是出现频率最高的药物之一[6]。大黄-栀子药对存在于不少复方中,如栀子大黄汤、茵陈蒿汤、栀子金花丸和牛黄至宝丸中均有大黄-栀子药对,且其配伍比例也不同,分别为1∶1.5、1∶1和1∶2,其药理药效作用也不一样[6, 18]。另一方面,中药复方的药效会受煎煮工艺的影响,大黄结合态蒽醌和游离蒽醌量与炮制、提取工艺有关[19-20]。然而,关于大黄-栀子药对配伍和煎煮工艺与蒽醌类活性成分的相关性研究却未见报道。本实验采用HPLC法,通过改变大黄-栀子药对配伍比例和煎煮工艺研究大黄蒽醌类活性成分的组成与量变化,以期揭示大黄-栀子药对在不同复方中药效物质基础与药效作用的相关关系。
1 仪器与材料TP-214万分之一天平,赛多利斯科学仪器(北京)有限公司;TDZ5-WS医用型离心机,长沙湘仪仪器有限公司;RE-85A旋转蒸发仪、SHZ-C循环水式多用真空泵,河南巩义市予华仪器有限责任公司;HH-1恒温水浴锅,江苏常州澳华公仪器有限公司;PHS-3C酸度计,上海雷磁仪器厂;岛津20A高效液相色谱仪,日本岛津公司。
大黄(产地青海,批号140501)与栀子(产地湖南,批号140703)药材饮片购自湖南长沙老百姓大药房,经湖南中医药大学刘塔斯教授鉴定,大黄为蓼科大黄属植物掌叶大黄Rheum palmatum L. 的干燥根和根茎,栀子为茜草科栀子属植物栀子Gardenia jasminoides Ellis的干燥成熟果实。
对照品芦荟大黄素(批号MUST-10112301,质量分数≥98%)、大黄素(批号MUST-11042601,质量分数≥98%)、大黄酚(批号MUST-10010201,质量分数≥98%)和大黄素甲醚(批号MUST- 10110402,质量分数≥98%)均购自北京恒元启天化工技术研究院;对照品大黄酸(批号110757- 200206,质量分数≥98%)购自中国食品药品检定研究院;三氯甲烷(分析纯)、甲醇(色谱纯)、盐酸(分析纯)、0.1%磷酸缓冲溶液(自配)。
2 方法与结果 2.1 溶液的制备 2.1.1 蒽醌类对照品溶液精密称取芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚对照品适量,加甲醇溶解分别制成质量浓度为72.4、64.6、82.6、78.2、40.2 μg/mL的储备液;分别精密量取上述储备液各2.00 mL,混匀,即得含芦荟大黄素14.48 μg/mL、大黄酸12.92 μg/mL、大黄素16.52 μg/mL、大黄酚15.64 μg/mL和大黄素甲醚8.04 μg/mL的混合对照品溶液。
2.1.2 大黄-栀子样品溶液(1) 水煎法:采取大黄栀子同时下、大黄先下和大黄后下3种实验方案,各进行3次平行实验,结果取平均值。以大黄先下为例,大黄、栀子药材粉碎成粗颗粒,按大黄-栀子质量比1∶0、1∶0.5、1∶1、1∶1.5、1∶2称取药材,各加入10倍量的水,分别浸泡30 min。大黄先煎30min,再加入栀子浸泡液(2种药材都预先浸泡过。为与干的栀子药材区分,就写成了“栀子浸泡液”)同时煎30 min;放冷,补足减失的质量,摇匀离心,取上层液,备用。大黄栀子同时下:大黄、栀子浸泡液混合后同时煎60 min;大黄后下:栀子先煎30 min,再加入大黄浸泡液同时煎30 min。
(2) 超声提取法:采取大黄、栀子合并提取与分开提取2种实验方案,进行3次平行实验,结果取平均值。合提液的制备:按大黄-栀子质量比1∶0、1∶0.5、1∶1、1∶1.5、1∶2称取药材,置于同一250 mL锥形瓶中,加入10倍量的70%乙醇溶剂,浸泡5 min,超声30 min,离心,取上层液,备用。分提液的制备:按大黄-栀子质量比1∶0、1∶0.5、1∶1、1∶1.5、1∶2称取药材,置于2个不同的250 mL锥形瓶中,加入10倍量的70%乙醇溶剂,浸泡5 min,分别超声30 min,离心,取上层液合并备用。
2.2 大黄中蒽醌类成分定量测定方法建立 2.2.1 色谱条件[6]色谱柱为月旭XB-C18柱(250 mm×4.6 mm,5.0 μm);流动相为甲醇-0.1%磷酸盐缓冲溶液(85∶15,pH 3.6);检测波长为254 nm;检测温度为室温;流动相体积流量为1.00 mL/min,进样量为10 μL;柱温30 ℃;理论板数按大黄素峰计算不少于3 000。
2.2.2 游离蒽醌溶液制备取“2.1.2”项所得上清液10.00 mL于锥形瓶中,加入2%盐酸溶液5 mL、三氯甲烷20 mL萃取,分取下层;上层再用三氯甲烷萃取3次,每次10 mL,合并三氯甲烷层,挥干溶剂,残渣加甲醇溶解,转移至10 mL量瓶中并用甲醇定容至刻度,用0.45 μm有机微孔滤膜滤过后备用。
2.2.3 总蒽醌溶液制备取“2.1.2”项所得上清液10.00 mL于锥形瓶中,加入8%盐酸溶液5 mL、三氯甲烷20 mL于62 ℃下水浴回流1 h,冷却后萃取,之后的处理方式同游离蒽醌溶液的制备方式。
2.2.4 大黄中蒽醌类成分的色谱分离依据“2.2.1”项所述的色谱条件,分别对大黄中游离蒽醌类混合对照品溶液和大黄-栀子药对提取液进行色谱分离,色谱图见图 1。5种蒽醌分离效果良好。
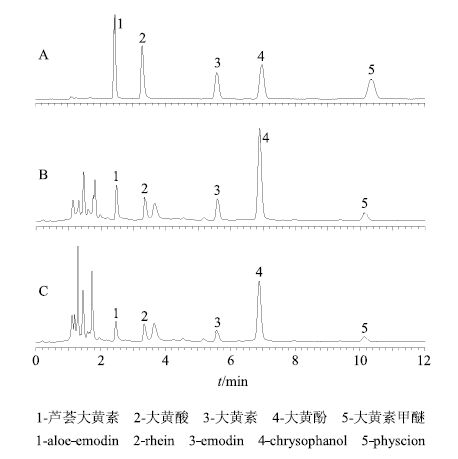
|
图 1 混合对照品 (A) 和大黄-栀子提取液 (B: 水煎法,C: 超声醇提法 的 HPLC 图 Fig.1 HPLCof standard solutions (A) and Rhei Radix et Rhizoma-Gardeniae Fructus extracting solution (B: water decoction method,C: ultrasonic extraction with alcohol) |
2.2.5 线性关系考察
精密量取混合对照品溶液0.25、0.50、1.00、2.00、5.00 mL分别置于10 mL量瓶中并用甲醇定容至刻度,0.45 μm有机微孔滤膜滤过,在上述色谱条件下,分别进样10 μL进行测定,以峰面积(Y)为因变量,对照品质量浓度为自变量(X),进行线性拟合,得到5种对照品的回归方程、线性范围及相关系数分别为芦荟大黄素Y=111 302.194 X-1 346.8,线性范围0.361~7.220 μg/mL,r=0.999 8;大黄酸Y=88 619 X+6 575.9,线性范围0.323~6.460 μg/mL,r=0.999 7;大黄素 Y=54 895 X-3 356.6,0.413~8.260 μg/mL,r= 0.999 8;大黄酚Y=71 489 X-2 639.1,线性范围0.391~7.820 μg/mL,r=0.999 9;大黄素甲醚Y= 35 887 X-0.907 13,线性范围0.201~4.020 μg/mL,r=0.999 9。可见5种蒽醌类成分均具有较宽的线性范围和高相关系数。
2.2.6 精密度试验精密量取混合对照品溶液,连续进样5次,记录峰面积。结果显示芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为0.26%、0.21%、0.73%、0.52%、0.22%,表明仪器精密度良好。
2.2.7 稳定性试验取“2.1.2”项所述水煎法“大黄-栀子同时下”,质量比1∶1的样品溶液,在室温下放置0、2、4、8、12、24 h,按“2.2.1”项所述方法测定,记录峰面积并计算RSD。结果显示游离蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为2.34%、2.12%、1.72%、2.33%、1.37%;总蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为1.59%、1.56%、2.01%、2.51%、2.68%。表明供试品溶液在室温条件下至少24 h内稳定。
2.2.8 重复性试验取大黄-栀子质量比1∶2的饮片粉末约5 g,共6份,按“2.1.2”项所述水煎法“大黄-栀子同时下”制备溶液,按“2.2.1”项所述方法进行色谱分析,记录峰面积并计算各指标成分质量分数的RSD。结果显示游离蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量分数的RSD分别为2.82%、3.03%、2.88%、2.84%、3.26%;总蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量分数的RSD分别为3.21%、3.12%、3.67%、2.83%、3.02%,表明本法重复性良好。
2.2.9 加样回收率试验精取大黄-栀子质量比1∶2的饮片粉末约5 g,共6份,分别准确加入混合对照品溶液5.00 mL,按“2.1.2”项所述水煎法“大黄先下”制备溶液,按“2.2.1”项所述方法进行色谱分析,计算各成分量和加样回收率。结果得游离蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均回收率分别为98.32%、97.36%、101.89%、104.01%、101.58%,RSD分别为3.02%、3.36%、3.82%、2.71%、3.14%;总蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均回收率分别102.69%、105.03%、99.12%、103.47%、98.56%,RSD分别为2.91%、3.56%、3.93%、2.98%、3.35%。
2.3 大黄-栀子不同配比和提取工艺对大黄中蒽醌类成分溶出的影响因结合蒽醌通过水解或代谢,可转化为对应的游离蒽醌和糖类。因此,可根据结合型蒽醌量为总蒽醌与游离蒽醌量之差计算得到[21]。按照“2.1”项方法制备游离蒽醌溶液和总蒽醌溶液样品溶液,按“2.2.1”项所述方法进行色谱分离与分析,依据“2.2.5”项所述线性回归方程计算各样品溶液芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的量,以这5种蒽醌类成分量之和表示总蒽醌的量。
2.3.1 水煎法中大黄-栀子不同配伍比例的影响以水煎法对5个不同配比的大黄-栀子药对进行提取,并采用所建立的HPLC法测定蒽醌量,结果见表 1。从表 1所示数据可以看出,在大黄中添加栀子,可以提高大黄中各类型蒽醌的溶出量,这说明两者配伍后,起到了增强药效的作用。而且随着栀子比例的增加,结合型蒽醌量成倍地增加,这说明大黄-栀子配伍对结合蒽醌溶出有促进作用,由于大黄发挥泻下作用的成分主要为结合蒽醌[13],因此,大黄、栀子配伍更能保持大黄泄下的药效成分。
|
|
表 1 大黄-栀子药对水煎提取工艺所得蒽醌量 (x±s,n = 3) Table 1 Contents of anthraquinone of Rhei Radix et Rhizoma-Gardeniae Fructus gardenia herbal pair extracted by water decoction method (x±s,n = 3) |
2.3.2 提取工艺的影响
分别考察了不同配伍比例大黄-栀子药对在水煎法中大黄“先下、后下、同时下”和超声醇提法中大黄、栀子“分提、合提”等不同提取工艺条件下,大黄蒽醌成分的溶出情况,HPLC法测定结果见表 1、2。由表 1可以看出,水煎法中,大黄-栀子配比为1∶0.5、1∶1时,“大黄后下”时,3种蒽醌量比“大黄先下”和“同时下”增加得要多;而大黄-栀子配比为1∶1.5、1∶2时,“大黄先下”中总蒽醌和游离蒽醌量比“大黄后下”和“同时下”中的量高。可见,栀子加入量和加入时间是影响游离蒽醌和结合蒽醌提取量的主要因素。超声法分开提取的5个比例中(表 2),游离蒽醌和总蒽醌量均高于大黄单独提取,结合型蒽醌量低于大黄单独提取。而合并提取的5个比例中,游离蒽醌和总蒽醌量均低于大黄单独提取,结合蒽醌量都高于大黄单独提取,也高于分开提取。结合蒽醌是主要的泻下成分,说明在复方提取过程中有可能发生化学反应,栀子和大黄产生协同效应,有助于产生更多的结合型蒽醌,从而提高泻下的药性。
|
|
表 2 大黄-栀子药对超声醇提工艺所得蒽醌量 (x±s,n = 3) Table 2 Contents of anthraquinone of Rhei Radix et Rhizoma-Gardeniae Fructus gardenia herbal pair extracted by ultrasonic extraction with alcohol (x±s,n = 3) |
对比超声醇提法和水煎法的数据可知,超声醇提法比水煎法提取效率显著提高,大大增加了蒽醌类成分的溶出,各种形态的蒽醌量均高出数倍。但在各种不同配伍比例下蒽醌成分量差异不大,说明超声醇提法能使大黄蒽醌类成分较完全地溶出,与栀子量关系不大。可能是因为超声提取过程温度较低,有效地避免了活性成分被氧化。
3 讨论本实验采用HPLC法,研究了大黄、栀子不同配伍比例、提取方式对蒽醌类成分溶出的影响。实验数据表明,超声醇提法比水煎法提取效率显著提高。栀子加入量和加入时间是影响游离蒽醌和结合蒽醌提取量的主要因素。这进一步说明了中药学“先煎”“后下”的合理性。
水煎液中大黄与栀子配伍后,各类型蒽醌量均提高,结合型蒽醌量增加明显。结合型蒽醌是大黄泻下的药效成分,游离蒽醌为寒性物质,对多种细菌均有不同程度的抑制作用,调节配伍比例可以起到不同的作用。栀子金花丸(大黄-栀子1∶1)和牛黄上清丸(大黄-栀子≈1∶0.5)主治清热泻火、牙龈肿痛、咽喉肿痛;牛黄至宝丸(大黄-栀子1∶2)有清热解毒、泻火通便之功效。比例为1∶2的试验样品中,游离蒽醌量和结合蒽醌量有不同程度的增加,说明在配伍后游离蒽醌量和结合蒽醌量的增加分别增强了方剂中对病菌的抑制作用和泻下的功效。以茵陈蒿汤为参考做的比例为1∶1.5的样品中,结合蒽醌有大量增加,则泻下效果更佳明显。此结果与其主治功效“阳黄身热,大便不畅,发作有时,但热不寒”相符。可见不同方剂药效不同是基于其复方配伍的不同,其中药效物质组成及其量也是不一样的,说明了中药复方配伍的科学性。在此基础上,开展含有大黄-栀子药对的不同复方针对游离蒽醌和结合蒽醌中5种成分进行药效实验,将是下一步要继续研究的课题。
| [1] | 董欣, 王淑敏, 祝恩智, 等. 乌头属中药及其炮制品与浙贝母、川贝母配伍的化学研究[J]. 中草药, 2012, 43(2):265–269. |
| [2] | 马莹慧. 中药复方和药对配伍中皂苷类成分吸收转运和药效学的研究[D]. 长春:吉林大学, 2016. |
| [3] | 田先地, 朱盛山, 吴思平, 等. 改良桃胶的不同配伍对复杂成分均衡释放的影响[J]. 中草药, 2015, 46(8):1140–1144. |
| [4] | 王英豪. 毒性中药钩吻配伍玉叶金花减毒机制研究[D]. 福州:福建中医药大学, 2016. |
| [5] | 李景松, 张贵君, 朱广伟, 等. 炙甘草及其配伍载体中4种药效组分变化规律分析[J]. 中草药, 2014, 45(13):1863–1866. |
| [6] | 中国药典[S]. 一部. 2015. |
| [7] | Zheng Q X, Wu H F, Guo J, et al. Review of rhubarbs:Chemistry and pharmacology[J]. Chin Herb Med, 2013, 5(1): 9–32. |
| [8] | 傅兴圣, 陈菲, 刘训红, 等. 大黄化学成分与药理作用研究新进展[J]. 中国新药杂志, 2011, 20(16):1534–1538. |
| [9] | 刘喜纲, 刘沛, 陈大为, 等. 优选大黄总蒽醌结肠定位壳聚糖微球的制备工艺[J]. 中草药, 2015, 46(1):38–42. |
| [10] | Zhang A H, Sun H, Yuan Y, et al. An in vivo analysis of the therapeutic and synergistic properties of Chinese medicinal formula Yin-Chen-Hao-Tang based on its active constituents[J]. Fitoterapia, 2011, 82(8): 1160–1168. DOI:10.1016/j.fitote.2011.07.014 |
| [11] | 吕慧英, 赵晨曦, 吴海, 等. 大黄提取物抗氧化活性与游离蒽醌含量相关性的研究[J]. 中草药, 2010, 41(3):37–40. |
| [12] | 吴晓青. 生、熟大黄"生泻熟缓、生熟异治"炮制机理研究[D]. 成都:成都中医药大学, 2015. |
| [13] | 武新安. 大黄泻下的大肠靶向给药之我见[J]. 中国中药杂志, 2002, 27(1):72–74. |
| [14] | 李晓红, 李蒙, 陶艳蓉. 大黄酸及其衍生物药理作用研究新进展[J]. 现代药物与临床, 2010, 29(6):417–425. |
| [15] | He Z H, Zhou R, He M F, et al. Anti-angiogenic effect and mechanism of rhein from Rhizoma Rhei[J]. Phytomedicine, 2011, 18(6): 470–478. DOI:10.1016/j.phymed.2010.10.006 |
| [16] | Bhadauria M. Dose-dependent hepatoprotective effect of emodin against acetaminophen-induced acute damage in rats[J]. Exp Toxicol Pathol, 2010, 62(6): 627–635. DOI:10.1016/j.etp.2009.08.006 |
| [17] | Ding Y, Zhao L, Mei H, et al. Exploration of emodin to treat alpha-naphthylisothiocyanate-induced cholestatic hepatitis via anti-inflammatory pathway[J]. Eur J Pharmarcol, 2008, 590(1/3): 377–386. |
| [18] | 唐峥, 尹然, 毕开顺, 等. 栀子大黄汤血清药物化学的初步研究[J]. 中草药, 2014, 45(23):3377–3382. |
| [19] | 孟兆青, 杨中林. 生大黄与酒炙大黄不同溶剂提取液中游离蒽醌、结合蒽醌的含量比较[J]. 中成药, 2005, 27(1):49–51. |
| [20] | 武新安, 王惠霞, 魏玉辉, 等. 大黄粉末煎煮过程中游离蒽醌和结合蒽醌含量变化的考察[J]. 中国医院药学杂志, 2007, 27(10):1387–1390. |
| [21] | 叶强, 郭力, 刘刚彦, 等. 大黄附子配伍对蒽醌类成分影响的研究[J]. 现代中医药, 2011, 31(4):72–74. |
 2017, Vol. 48
2017, Vol. 48


