2. 浙江中医药大学生命科学学院, 浙江 杭州 310053
2. College of Life science, Zhejiang Chinese Medical University, Hangzhou 310053, China
心脑血管疾病是发病率、死亡率、致残率极高的疾病,银杏酮酯(Ginkgo biloba extract,GBE)在治疗脑血管疾病方面疗效明确[1-3],具有保护血管内皮功能及改善微循环等作用,对治疗心脑血管疾病,如冠状动脉粥样硬化性心脏病及缺血性脑病——脑缺血、脑老化、老年痴呆症等有一定的疗效,为临床上常用的中成药之一[4]。文献报道GBE中治疗脑血管疾病的主要药理活性成分是银杏萜内酯类化合物[5],包括白果内酯和银杏内酯A、B、C[6],这些成分脂溶性较大,相对容易透过血脑屏障。但是究竟有多少吸收进入血液的成分能同步透过血脑屏障?理论上,血液吸收是药物作用的前提,但血液通常不是药物的直接作用部位,药物作用的直接靶标应该是效应部位。因此研究多成分中药体内过程时应该结合血液和效应部位同步进行才能更好地阐述药效物质基础,但目前尚未见针对GBE口服后内酯类成分在血液和效应部位脑部同步进行检测和分析的报道。
微透析(micro dialysis,MD)技术是一种在体内或者离体脑化学采样的技术[7-8]。与传统取样技术相比具有显著优势,包括连续取样、组织损伤轻,时间和空间分辨性好,可同时测定多个部位的药物浓度,能全面反映药物在体内的分布,这为药物代谢动力学的研究提供了一种新的实验方法[9]。MD技术能够监测血浆及脑细胞外液中的游离药物浓度随时间的动态变化,为评价药物跨越血脑屏障,进行脑分布、脑靶向及脑转运体研究等提供重要的科学数据。MD技术可直接获得选定部位的游离药物浓度,而游离药物浓度与药效呈正比,更具有临床意义[10]。虽然MD技术具有诸多的优势,但也存在着一些缺点,如:脂溶性药物易吸附在探针上导致探针回收率较低[11],对分析方法要求高[12]等。取样量很小,加上GBE中某些成分量本来就少,因此需要灵敏度高的检测方法。且MD与高灵敏度分析系统联用可以更直观地分析结果,能克服体内环境等多种因素的干扰。HPLC-MS/MS检测技术充分结合了HPLC的高分离能力和MS的强定性能力,极大提高了分析的准确度、灵敏度和专属性,与微透析样品的高通量分析非常契合[13]。因此,本实验采用效应部位脑和血液的多位点MD技术,结合HPLC-MS /MS检测技术,开展了同时研究血液及效应部位脑部的药物浓度变化,并计算各成分在脑部和血液中的药物质量浓度及药物分布系数,为GBE的效应机制及制剂研究提供一定的参考。
1 仪器与材料 1.1 仪器JA 203 H电子分析天平,常州市幸运电子设备有限公司;6460 Triple Quad质谱仪、1290 Infinity液相色谱仪,美国Agilent公司;飞鸽TGL-20 bR高速离心机,上海安亭科学仪器厂;CMA 402微透析仪泵,CMA 12微透析探针,90-102颅钻,CMA 12引导管,北京瑞思浩翔科技有限公司;脑立体定位仪,美国Stoeling公司。
1.2 试药与试剂银杏内酯A(批号MUST-12120501)、银杏内酯C(批号MUST-12032214),成都曼斯特生物科技有限公司,质量分数均≥98%;银杏内酯B(批号110863-201209,质量分数99.9%)、白果内酯(批号110865-200605,质量分数100.0%)、格列苯脲(批号100135-200404,质量分数>99%),中国食品药品检定研究院;GBE(含总黄酮≥24.0%,银杏内酯≥6.0%,HPLC),上海得恩德医药科技有限公司,批号20130228;肝素,盐城市云峰化工有限公司,批号20153270;生理盐水,浙江省中医院;蒸馏水;甲醇、乙腈,色谱纯,美国Fisher科技公司;羧甲基淀粉钠,烟台金昱变性淀粉有限公司;微晶纤维素,美国FMC公司;醋酸乙酯,分析纯,衢州巨化试剂有限公司;乌来糖,国药集团化学试剂有限公司,批号20150303;牙托粉,哈尔滨齿科器材厂;人工脑脊液(aCSF):NaCl 147 mmol/L、MgCl2 1.2 mmol/L、KCl 4.0 mmol/L、CaCl2 1.2 mmol/L,含1%羟丙基-β-环糊精(HP-β-CD)的溶液。
1.3 动物SD两周龄大鼠,5只,雄性,体质量(200±30)g,许可证号:SCXK(沪)2013-0016,上海西普尔-必凯实验动物有限公司。
2 方法和结果 2.1 色谱和质谱条件 2.1.1 色谱条件色谱柱为Aglilent Eclipse XDB- C18柱(50 mm×2.1 mm,1.85 μm);流动相为0.1%甲酸水溶液-乙腈,梯度洗脱程序:0~2 min,15%~30%乙腈;2~4 min,30%~50%乙腈;4~6 min,50%~90%乙腈;6~6.1 min,90% ~85%乙腈;6.1~8.0 min,85%乙腈;自动进样器;柱温30 ℃;样品架温度6 ℃;体积流量0.4 mL/min;进样量10 µL;理论塔板数按白果内酯计不低于2 500。
2.1.2 质谱条件离子源:电喷雾离子源ESI(Turbo Spray);碰撞气:N2;去溶剂气流:N2,10 L/min;多反应监测(MRM)。监测参数见表 1。
|
|
表 1 监测参数 Table 1 Monitoring parameters |
2.2 样品处理 2.2.1 混合对照品溶液的配制
分别精密称取白果内酯及银杏内酯A、B、C对照品适量,加甲醇配制成银杏内酯A 21.3 μg/mL、银杏内酯B 15.1 μg/mL、银杏内酯C 16.2 μg/mL、白果内酯18.1 μg/mL的混合对照品溶液贮备液[14]。
2.2.2 内标溶液的配制精密称取适量格列苯脲对照品,加甲醇配制成167.0 μg/mL的溶液作为贮备液。精密吸取50 μL,加蒸馏水定容至50 mL,得到167 ng/mL的溶液。
2.2.3 微透析样品的制备精密吸取50 μL微透析样品,N2吹干,加入167.0 ng/mL内标(格列本脲)甲醇溶液50 μL复溶,涡旋5 min,18 000 r/min,取上清液10 μL进样。
2.3 方法学考察 2.3.1 专属性试验精密吸取微透析灌流液50 μL,N2吹干,加入甲醇溶液50 μL复溶,涡旋5 min,18 000 r/min,取上清液10 μL进样,获得阴性对照品色谱图(图 1-A);精密吸取一定质量浓度的混合对照品甲醇溶液,加入微透析灌流液50 μL,然后同“2.2.3”项中自“N2吹干”的方法操作,获得GBE对照品色谱图(图 1-B);另取大鼠给药后的微透析液,然后同“2.2.3”项中自“N2吹干”的方法操作,获得大鼠体内微透析样品色谱图(图 1-C)。比较三者的色谱图,判断该色谱条件对于GBE中指标成分和格列苯脲的专属性。结果表明,本方法专属性良好,微透析灌流液对GBE中指标成分和格列苯脲检测无干扰。见图 1。
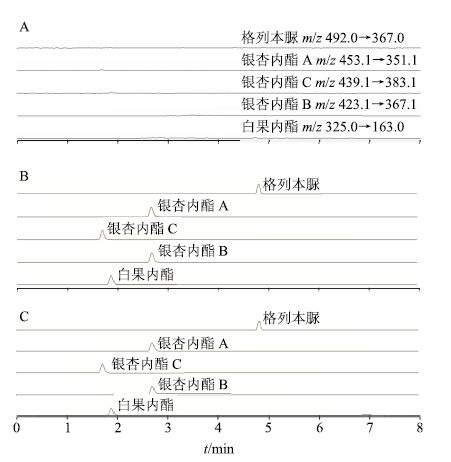
|
图 1 阴性对照品 (A)、GBE 对照品 (B) 和体内微透析样品 (C) 的HPLC-MS/MS图谱 Fig.1 HPLC-MS/MS chromatograms of negative control (A),GBE reference sample (B),and in vivo MD sample (C) |
2.3.2 线性范围考察
采用甲醇将各成分的混合对照品溶液稀释成系列质量浓度,进样10 μL,以峰面积(Y)对质量浓度(X)进行线性回归,得各成分线性回归方程,分别为白果内酯Y=3.032×10−3X+2.147×10−3,r=0.999 0,线性范围1.81~181 ng/mL;银杏内酯A Y=5.354×10−3 X+4.474×10−3,r=0.996 2,线性范围2.13~213 ng/mL;银杏内酯B Y=9.738×10−3 X+5×10−5,r=0.996 5,线性范围1.51~151 ng/mL;银杏内酯C Y=6.298×10−3 X+0.062 65,r=0.998 1,线性范围1.62~162 ng/mL;结果表明各成分在相应线性范围内线性关系良好。
2.3.3 精密度试验精密吸取混合对照品储备液,稀释1 000倍,按“2.1”项下色谱和质谱条件,分别进样10 μL,连续进样6次,测定峰面积,白果内酯及银杏内酯A、B、C的RSD值分别为2.13%、1.89%、1.07%、1.48%。
2.3.4 稳定性试验精密吸取已加入内标处理的微透析样品溶液,按“2.1”项下色谱和质谱条件,分别在0、4、8、12 h后进样,进样量为10 μL,测定峰面积,并计算RSD值。结果白果内酯及银杏内酯A、B、C的RSD值分别为1.67%、1.42%、1.34%、1.18%,说明样品溶液在12 h内稳定。
2.3.5 重复性试验精密吸取等量微透析样品6份各50 μL,N2吹干,加入167.0 ng/mL内标(格列本脲)甲醇溶液50 μL复溶,涡旋5 min,18 000 r/min,取上清液10 μL,按“2.1”项下色谱和质谱条件,测定各成分的量并计算RSD。结果白果内酯及银杏内酯A、B、C的RSD值分别为2.67%、1.42%、1.34%、2.06%。
2.3.6 加样回收率试验精密量取已测定的微透析样品液6份各25 μL,分别精密加入混合对照品溶液25 μL,N2吹干,加入167 ng/mL的内标(格列本脲)甲醇溶液50 μL复溶,混匀离心,移取上清液进行各成分测定并计算加样回收率。结果白果内酯及银杏内酯A、B、C的加样回收率分别为(92.12±4.39)%、(97.28±3.58)%、(93.25±4.52)%、(92.39±5.14)%。其RSD分别为4.9%、2.8%、4.6%、3.7%。
2.4 血脑同步微透析方法 2.4.1 动物麻醉称取20 g乌来糖,加生理盐水配制20%乌来糖麻醉液。并以1.2 g/kg的剂量给大鼠ip进行麻醉。
2.4.2 血管探针导管植入将麻醉后的大鼠仰卧固定在鼠板上,露出大鼠的颈部用剃毛刀将颈部筋脉处的毛剔除,颈部偏右侧位置用剪刀进行开口,分离肌肉露出颈静脉。使用消毒后的棉线系住血管远心端,将血管探针引导管放入肝素液中浸润,使用手术刀在血管中间位置做斜切口,将引导管插入切口中。
2.4.3 脑部探针导管植入在血管探针埋入成功之后,将大鼠俯卧固定在脑立体定位仪上,剔除头颅颅顶的毛发,消毒。使用手术剪刀剪掉颅顶的皮肤,露出颅骨,清理骨膜,用沾有生理盐水的棉签擦拭头骨面,按照大鼠脑立体定位图谱,在左侧海马区(前囟门向后5.3 mm,向右5.0 mm,向下6.0 mm)用骨锥打孔,将导管通过使用螺钉和牙托粉定位在颅骨上。大鼠埋置完探针导管后,术后恢复3~5 d不予实验,直至恢复正常的行动与饮食,外形无萎靡不振等不良手术反应。
2.4.4 血管探针植入术后3~5 d后,用20%乌拉坦麻醉液麻醉已埋置导管的实验大鼠,将血管探针由引导管缓慢推送进颈静脉,拔出引导管[15],并收集透析液。
2.4.5 脑部探针植入术后3~5 d后,用20%乌拉坦麻醉液麻醉已埋置导管的实验大鼠,小心地将微透析探针插入位于海马区的导管(插之前在灌流系统用纯水冲洗1 h),并用备用丝线固定。透析探针的一端与人工脑脊液灌流系统以2.0 μL/min体积流量灌洗,另一端插入0.5 mL的小离心管中,以用来收集透析液[16-19]。
2.4.6 口服给药方法用绳子将大鼠四肢固定在鼠板上,使大鼠的头部、颈部和身体在同一直线上,并拆除注射器的针头,换用灌胃针,再将大鼠的大牙用绳绑住挂在头部正上方位置,使得大鼠呈抬头姿势的情况下将针头从大鼠的嘴角插入,抵住舌头将针管向大鼠胃部推进,当感受到出现些许阻力时便可以将针管中的GBE混悬液(600 mg/kg)推送到大鼠胃部。
2.4.7 微透析探针在体回收率测定采用反透析法进行体内GBE回收率实验,取术后恢复大鼠,先灌流空白PBS液,平衡2 h后,以含不同质量浓度的GBE微透析灌流液灌流,体积流量为2 μL/min,收集1 h,间隔20 min,测定透析液样品中药物质量浓度,按照以下公式分别计算GBE中各主要成分在血液和脑部探针的在体相对回收率(RR)。
RR=Coutlet/Cinlet
Coutlet为微透析流出液中各成分的质量浓度,Cintlet为微透析灌流液中各成分的质量浓度
结果发现,GBE中各主要成分在血液探针的在体RR分别为银杏内酯A(17.82±1.52)%、银杏内酯B(19.93±2.39)%、银杏内酯C(20.21±1.57)%、白果内酯(12.63±2.01)%。
GBE中各主要成分在脑部探针的在体RR分别为银杏内酯A(18.53±1.69)%、银杏内酯B (18.53±1.69)%、银杏内酯C(19.21±2.25)%、白果内酯(14.38±2.12)%。
2.4.8 微透析样品收集探针植入成功后,用灌流液以2.0 μL/min灌流平衡1 h,然后对大鼠进行口服GBE给药处理,同时开始收集样品。开始前2 h每隔0.5 h收集样品液,2~8 h时每隔1 h收集样品液;8~16 h时每隔2 h收集样品液。收集得到的样品液置于−20 ℃冰箱保存。
2.4.9 微透析样品测定结果以取样时间点为横坐标,药物质量浓度为纵坐标绘图,得到各成分在血液中和脑部的药物质量浓度曲线,分别见图 2和图 3,采用梯形法分别计算各成分在脑部和血液中的AUC,计算各成分在脑部和血液中的药物分布系数(以AUC脑/AUC血表示),结果见表 2。在本实验剂量下,白果内酯在脑中的药物质量浓度仅能检测到个别时间点。
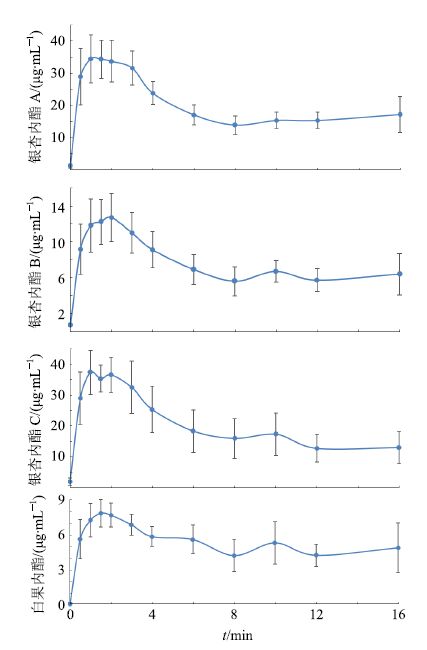
|
图 2 GBE 中银杏内酯类成分在血液中药物质量浓度曲线 Fig.2 Blood drug concentration curves of lactones in GBE |

|
图 3 GBE 中银杏内酯类成分在脑中的药物浓度曲线 Fig.3 Brain drug concentration curves of lactones in GBE |
|
|
表 2 银杏内酯类成分的 AUC 以及药物分布系数 (AUC 脑 / AUC 血) Table 2 AUC and drug distribution coefficient (AUCbrain/ AUCblood) of ginkgo lactones components |
3 讨论
银杏内酯是GBE中的主要成分,是一类具有独特分子结构的萜内酯类,具有保护脑缺血、再灌注损伤等作用,对多种脑缺血性疾病有一定的防治作用。有研究表明[20],银杏内酯能够快速吸收进入体循环并进入脑组织,银杏内酯A、B和白果内酯是主要的体内成分,银杏内酯C只在部分脑中微量检出,其他样品中未检出。银杏内酯在不同时间点的脑组织浓度均较同时间点的血浆中药物成分低,且各成分在脑组织中浓度随时间下降较快。本实验中血液微透析液中能检测到银杏内酯A、B、C及白果内酯,而脑部微透析液中只能检测到银杏内酯A、B、C,无法检测到白果内酯,可能是由于白果内酯的微透析回收率比较低。在不同环境下生长或者不同给药剂量对白果内酯量的检测会有很大的影响。本实验中的给药剂量较小,因此检测到的白果内酯成分较少,这也可能是脑部未检测到其量的原因。从血液吸收情况看,白果内酯吸收的量也比较少,这可能与本实验中用到的提取物中白果内酯本身含量比较低有关。MD与现代分析技术联用对体内药物实时检测与其他取样检测技术相比具有明显的优势,主要包括能明显减少取样操作对实验动物正常状态的影响,使得测得的结果最接近所测物质在体内的真实状态;能实现连续实时取样和检测,更能明确所测物质在同一个体体内的变化过程;免除了样本前处理过程,从而减少外界操作对样本的影响和浪费。但MD技术本身操作的要求较高、探针成本高且回收率低。另外,由于探针透析膜的限制,该技术在大分子物质、脂溶性物质应用方面还存在一定局限性[21]。
而微透析探针的相对回收率受到很多因素的影响,如温度、pH值、待测物质的相对分子质量、探针的半径和长度、灌流液的组成和灌流体积流量、微透析膜的性质以及生物体本身一些因素的影响等。所以还需要对探针的相对回收率进行校正,以得到较为准确的实验结果[22]。有研究[23]通过微透析探针体外实验,发现灌流液体积流量越低则回收率越高。当灌流体积流量很小时,组织中回收的物质少,探针内外的溶液有相对更多的时间达到一个平衡,其相对回收率就高。本实验中由于探针外部组织液的药物浓度未知,所以采用反透析法测定药物经过半透膜的流失量,间接计算探针的体内回收率。
微透析液中含大量的无机盐离子,由于无机盐不具有挥发性,直接进样容易产生离子抑制效应而损坏质谱仪器。因此,需要在进样前对微透析液进行处理,如稀释、脱盐处理、梯度洗脱等。如为减少或避免非挥发性盐离子或小分子物质对质谱的影响,在分析前约2 min样品不进入质谱仪中,只经过色谱柱,无机盐随流动相流出,约2 min之后样品进入质谱仪中进行分析[24-25],由于盐离子在色谱柱上不会有保留,一个柱体积已能将盐离子全部除去,从而保护质谱并可提高灵敏度。本实验根据前期的方法[26],采取微透析液氮气吹干然后加入甲醇沉淀盐类物质并离心去除的方法避免无机盐离子的干扰和影响,避免离子抑制效应。从本实验结果来看,大鼠口服GBE后,能达到效应部位的主要为银杏内酯A、B、C 3种成分,但是药物在脑部和血液中的药物分布系数均不是很高,不足5%,因此,若能采取制剂的方法提高此类成分在脑中的分布系数,可能会取得更好的治疗效果。
| [1] | 李霞, 张弦, 贡联兵. 银杏酮酯分散片的临床应用评价[J]. 中国医院用药评价与分析, 2014, 14(2):116–118. |
| [2] | 许刚. 银杏酮酯分散片治疗缺血性脑卒中临床随机对照试验[D]. 苏州:苏州大学, 2014. |
| [3] | 周兴盛. 银杏酮酯滴丸联合阿托伐他汀钙治疗缺血性脑梗死的临床研究[J]. 现代药物与临床, 2015, 30(11):1337–1340. |
| [4] | 李春艳. 浅析银杏叶的药理作用和功效[J]. 医学信息, 2011, 24(9):4529. |
| [5] | Mohanta T K, Tamboli Y, Zubaidha P K. Phytochemical and medicinal importance of Ginkgo biloba L[J]. Nat Prod Res, 2014, 28(10): 746–752. DOI:10.1080/14786419.2013.879303 |
| [6] | Mahadevan S, Park Y. Multifaceted therapeutic benefits of Ginkgo biloba L.:Chemistry, efficacy, safety, and uses[J]. J Food Sci, 2008, 73(1): R14–R19. |
| [7] | 许静. 基于微透析技术探讨针刺不同配穴对急性心肌缺血大鼠下丘脑多巴胺递质含量影响的研究[D]. 合肥:安徽中医药大学, 2016. |
| [8] | 李周, 王利胜, 巴文强, 等. 青藤碱、雷公藤甲素皮肤和血液在体微透析方法的建立[J]. 中草药, 2015, 46(14):2076–2081. |
| [9] | 张岩. 基于微透析取样技术的氧化苦参碱大鼠体内药代动力学研究[D]. 杭州:浙江工业大学, 2015. |
| [10] | 刘胜敏. 基于微透析-液质联用新技术研究丹参脑及血浆药代动力学特性[D]. 张家口:河北北方学院, 2014. |
| [11] | 董冉冉, 王萌, 刘志东, 等. 微透析技术在中药成分体内分析研究中的应用[J]. 中草药, 2015, 46(20):3117–3124. |
| [12] | 柳琳, 张相宜, 肖瑶, 等. 脑微透析技术在胶质瘤研究中的应用进展[J]. 药学学报, 2014, 49(4):450–456. |
| [13] | 朱黎霞, 张英丰. 基于微透析技术结合液质联用的丹酚酸B正常和高脂血症大鼠药动学比较研究[J]. 中草药, 2015, 46(1):90–95. |
| [14] | 刘会. 银杏酮酯缓释微丸的研制及其体内外相关性研究[D]. 杭州:浙江中医药大学, 2014. |
| [15] | 张琪, 张群林. 基于血和脑同步微透析研究冰片对神经保护作用的山柰酚透过血脑屏障的促进作用[D]. 合肥:安徽医科大学, 2014. |
| [16] | Paxinos G, Watson C. The Rat Brain in Stereotaxic Coordinates[M]. 3rd ed. San Diego: Academic Press, 1997. |
| [17] | 张英丰, 吴阳, 汪小根, 等. 关于微透析法与血药浓度法的异同及其药动学数据特殊处理的探索与思考[J]. 中国实验方剂学杂志, 2011, 17(12):276–278. |
| [18] | 黄翔. 基于脑微透析技术的丹红注射液抗脑缺血药效学研究[D]. 杭州:浙江中医药大学, 2013. |
| [19] | 卢芳, 范振群, 张颖, 等. 基于UPLC-TOF/MS和脑内微透析技术的异嗪皮在帕金森病模型大鼠脑内药动学研究[J]. 世界科学技术-中医药现代化, 2013, 15(1):79–84. |
| [20] | 张颖, 林力, 任常英, 等. 中药复方塞络通中银杏内酯类成分的药代动力学及脑分布研究[J]. 世界科学技术-中医药现代化, 2014, 16(7):1458–1464. |
| [21] | 聂颖兰, 范斌, 闫寒, 等. 微透析与现代分析技术在线联用的研究进展[J]. 中国实验方剂学杂志, 2012, 18(5):252–255. |
| [22] | 方浩. 微透析取样技术在药动学方面的应用[J]. 科技信息, 2012(26):165–167. |
| [23] | 徐月红, 叶卉, 郭秀彩, 等. 微透析联用反相高效液相色谱研究白芥子涂方皮肤药动学[J]. 中草药, 2012, 43(2):336–340. |
| [24] | 邵继征, 周莉玲, 黄浩然, 等. 液-质联用测定家兔血液及关节微透析液中青藤碱[J]. 中国医院药学杂志, 2009, 29(7):519–522. |
| [25] | 彭珑, 王丹, 吴诚, 等. 建立液相色谱-质谱串联法测定大鼠微透析样品中美罗培南的浓度[J]. 解放军医药杂志, 2015, 27(12):99–108. |
| [26] | 祝丽欣, 陈芝, 郭莹, 等. f2相似因子法评价银杏酮酯缓释微丸大类成分总黄酮和各类成分的体外释放相关性研究[J]. 中草药, 2015, 46(23):3482–3488. |
 2017, Vol. 48
2017, Vol. 48


