葛花Puerariae Flos为豆科葛属植物野葛Pueraria lobata (Willd.) Ohwi或甘葛藤Pueraria thomsonii Benth. 的花,主要用于伤酒发热烦渴、解酒醒脾,是传统的解酒保肝中药[1-3]。鸢尾苷元为葛花的主要生物活性成分,为三羟基异黄酮。因其多酚羟基结构,而具有强抗氧化活性,4′,7-羟基结构与乙烯雌酚相似,拥有雌激素样活性。现代药学研究发现,鸢尾苷元具有抗氧化损伤、降血糖、调血脂、抗炎、抗过敏、抗动脉粥样硬化、抗肿瘤、心肌保护作用和防治糖尿病并发症等多种生物活性,有重要的保健和药用价值[4-11]。
黄酮类化合物因水溶性差,生物利用度低[12-13],限制了其临床应用。胃内滞留漂浮缓释制剂被称为“生物有效性制剂”,是依据流体动力学平衡原理设计制备,口服后可漂浮在胃液之上,延长胃内滞留时间,逐渐溶蚀,缓慢释药,继而增加吸收,提高生物利用度[14-16]。
笔者利用鸢尾苷元呈弱酸性,主要在胃内吸收的特性,制备鸢尾苷元胃内漂浮缓释片(tectorigenin floating sustained-release tablets,TFSRT),延长药物在胃内的滞留时间,以提高其生物利用度。本实验以鸢尾苷元悬浮液作为参比制剂,并以鸢尾苷元为检测指标,采用HPLC法测定体外累积释放度和兔体内血药浓度,从而评价该制剂体外释放与体内吸收的相关性,为利用体外释放度控制该制剂质量提供依据。
1 仪器与材料LC-10AVT高效液相色谱仪、SPD-10AV检测器,日本岛津公司;N-2000色谱数据工作站,浙江大学智能信息工程有限公司;CPA2P-F百万分之一电子分析天平,德国赛多利斯股份有限公司;ZRS-4G智能溶出试验仪,天津大学无线电厂;TDP型单冲压片机,上海轻工机械公司;78-X型片剂四用测定仪,上海黄海药检仪器厂。ZK-82B型真空干燥箱,上海市实验仪器厂。
鸢尾苷元对照品,自制,经质谱、氢谱和碳谱进行结构鉴定,质量分数>99.0%,批号20130906;鸢尾苷元,自制,批号20131017,质量分数>96.75%;β-葡萄糖醛酸酶,Sigma公司;醋酸泼尼松龙注射液,浙江仙琚制药股份有限公司,批号150307,规格:125 mg/5 mL;羟丙甲基纤维素(HPMCK15M),上海卡乐康包衣技术有限公司惠赠;预胶化淀粉、十八醇、交联聚乙烯吡咯烷酮(PVPP),上海化学试剂公司;碳酸氢钠,北京化工厂;水为重蒸水;甲醇、乙腈为色谱纯,Tedia公司;其他试剂均为分析纯,北京化工厂。
日本大耳白兔,体质量2.0~2.5 kg,雌雄各半,吉林大学实验动物中心提供,合格证号:SCXK-(吉)2011-007。
2 方法与结果 2.1 TFSRT 的制备[15]取鸢尾苷元干粉和十八醇过80目筛,按处方量称取主药及辅料,过60目筛,混合均匀。加润湿剂制软材,过18目筛制粒,60 ℃干燥20 min,14目筛整粒,加入1%硬脂酸镁混匀,用直径10 mm的冲头压片,压力控制在4.0~5.0 kg,所得成品为外观光洁的浅黄色片剂,300 mg/片,含主药100 mg。
2.2 体外释放度实验 2.2.1 色谱条件[17]色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-乙腈-水(2∶1∶2);体积流量1.0 mL/min;检测波长264 nm;柱温25 ℃;进样量20 μL。
2.2.2 系统适用性试验取TFSRT持续漂浮6 h的人工胃液,0.45 μm滤膜滤过,取续滤液作为供试品溶液,按“2.2.1”项下色谱条件进样20 μL,见图 1。理论塔板数不低于3 000,分离度大于1.5,拖尾因子在0.95~1.05,保留时间为7.565 min。

|
图 1 TFSRT 体外释放 HPLC 图 Fig.1 HPLC of TFSRT in vitro |
2.2.3 线性关系考察
精密称取干燥至恒定质量的鸢尾苷元对照品12 mg置100 mL量瓶中,加人工胃液适量,超声助溶10 min,用人工胃液定容至刻度,摇匀,即得质量浓度为120 μg/mL的鸢尾苷元对照品溶液。精密吸取对照品溶液0.1、0.2、0.5、1.0、2.0、4.0、6.0、8.0 mL,以人工胃液定容于10 mL量瓶中,摇匀,取20 μL,HPLC法测定峰面积。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得回归方程为Y=63 725 X- 33 233,r=0.999 8,表明鸢尾苷元在1.2~120.0 μg/mL线性关系良好。
2.2.4 精密度试验取12.0 μg/mL的鸢尾苷元对照品溶液连续进样6次,测得其峰面积的RSD为1.09%,结果表明仪器精密度良好。
2.2.5 重复性试验精密吸取同一供试品溶液,重复进样6次,测得峰面积的RSD为1.48%,结果表明本方法重复性良好。
2.2.6 稳定性试验精密吸取同一供试品溶液,室温放置0、1、2、4、6、12 h后取样测定,RSD为1.29%,结果表明供试品溶液在12 h内稳定。
2.2.7 加样回收率试验精密称取缓释片细粉3份(8.00、10.00、12.00 mg)分别置100 mL量瓶中,精密加入质量浓度为120 μg/mL的鸢尾苷元对照品溶液20、25、30 mL,加释放介质溶解,超声处理10 min,并定容至刻度。经0.45 μm微孔滤膜滤过,取续滤液,按“2.2.1”项下色谱条件,分别进样20 μL,测定峰面积,计算加样回收率。平均回收率分别为99.34%、97.58%、98.06%,其RSD分别为3.23%、1.56%、1.75%。
2.2.8 体外释放度的测定取本品照《中国药典》2015年版二部释放度测定法,采用浆法,以人工胃液[18-19](十二烷基硫酸钠5 g,用适量水分散,加热溶解,放冷,加入16.4 mL稀盐酸,加水稀释成1 000 mL,模拟胃肠道的pH值变化,配制成满足漏槽条件的人工胃液)900 mL为释放介质,转速100 r/min,温度(37.0±0.5)℃,依法测定。分别于2、4、6、8、10、12 h取样2 mL,并即时补加等量等温介质。经0.45 μm微孔滤膜滤过,取续滤液20 μL进样,按“2.2.1”项下色谱条件测定峰面积,代入回归方程,计算药物累积释放度,见表 1。结果表明,TFSRT在人工胃液中10 s内起漂,体外持续漂浮时间>12 h;10 h累积释放度在70%以上;具有良好的漂浮性能和释药特征。
|
|
表 1 3 批样品累积释放度 (x±s,n = 6) Table 1 Cumulative release percentage of three batches of samples (x±s,n = 6) |
2.3 兔体内药动学研究 2.3.1 给药方法
采用交叉试验设计,自身对照进行实验。将6只日本大耳白兔,分为2组,分别ig给予TFSRT 2片和鸢尾苷元混悬液200 mg[20-21]。实验前禁食12 h,自由饮水。ig后给水约100 mL。实验共分2个周期,洗净期7 d。
2.3.2 血样采集给药前用桡动脉穿刺套针行耳中央动脉穿刺,穿刺成功后,拔出针芯,充分固定针套,用肝素帽封针并取血。给药后5 min及0.25、0.5、1、2、3、4、6、10、12 h于耳中央动脉取血,置肝素化离心管中,3 000 r/min离心10 min,分离血浆,−20 ℃保存待测。
2.3.3 血浆预处理家兔禁食12 h,自由饮水。耳中央动脉取血20 mL,置肝素化离心管中,3 000 r/min离心10 min,分离血浆,备用。
2.3.4 线性关系考察精密称取干燥至恒定质量的鸢尾苷元对照品8 mg,加无水乙醇溶解并定容于100 mL量瓶中,充分混匀。等比稀释得到0、0.625、1.25、2.5、5.0、10.0、20.0、40.0、80.0 μg/mL不同质量浓度的对照品溶液。各取200 μL,每管加入空白兔血浆0.8 mL和含有内标(醋酸泼尼松龙12.5 μg/mL)的无水甲醇溶液200 μL,混匀。加入醋酸乙酯1.2 mL,涡旋震荡3 min,10 000 r/min离心5 min,分离上层有机相1.0 mL转入另一试管中。再加入醋酸乙酯1.0 mL,涡旋震荡,离心取上层有机相1.2 mL。合并有机相,于通风橱中水浴挥干,残渣加100 μL流动相溶解,取20 μL进样HPLC分析,色谱条件同“2.2.1”项。测定鸢尾苷元与内标峰面积之比。以对照品质量浓度为横坐标(X),对照品与内标峰面积之比为纵坐标(Y)进行回归,得回归方程为Y=0.417 2 X+0.424 1,r=0.999 6,结果表明鸢尾苷元在0.16~20.00 μg/mL线性关系良好。
2.3.5 精密度试验取0.8 mL空白血浆,分别加入2.5、5.0、10.0 μg/mL鸢尾苷元对照品溶液200 μL,制成低、中、高3个质量浓度,加入12.5 μg/mL醋酸泼尼松龙甲醇溶液200 μL,涡旋混匀,按标准曲线方法处理并测定,重复进样6次,分别记录鸢尾苷元与内标峰面积比,计算精密度,结果低、中、高3个质量浓度的RSD分别为2.66%、1.62%、1.22%,表明所用分析方法符合要求。
2.3.6 稳定性试验取0.8 mL血浆样品,加入6.25 μg/mL醋酸泼尼松龙甲醇溶液400 μL,涡旋混匀。按标准曲线方法处理。室温放置,分别在0、2、4、6、8 h取样,按上述色谱条件检测。结果RSD为2.30%,表明室温放置8 h稳定性良好。
2.3.7 提取回收率试验取0.8 mL空白血浆共9份,分别加入质量浓度为2.5、5.0、10.0 μg/mL鸢尾苷元对照品溶液200 μL,制成低、中、高3个质量浓度的血浆样品,加12.5 μg/mL醋酸泼尼松龙甲醇溶液200 μL,涡旋混匀。按标准曲线方法处理并测定,记录样品与内标的峰面积之比,代入标准曲线,计算提取回收率。结果表明低、中、高3个质量浓度的平均提取回收率均在96.44%~103.36%,RSD为0.85%~1.95%,说明该方法准确可靠。
2.3.8 专属性试验按“2.2.1”项色谱条件下测得空白血浆、空白血浆加鸢尾苷元对照品和内标及血浆样品的HPLC图谱。可见多次进样,含药血浆及内标的峰形及保留时间重现性好,保留时间分别为7.865、11.932 min,空白血浆中内源性物质不干扰测定。结果见图 2。
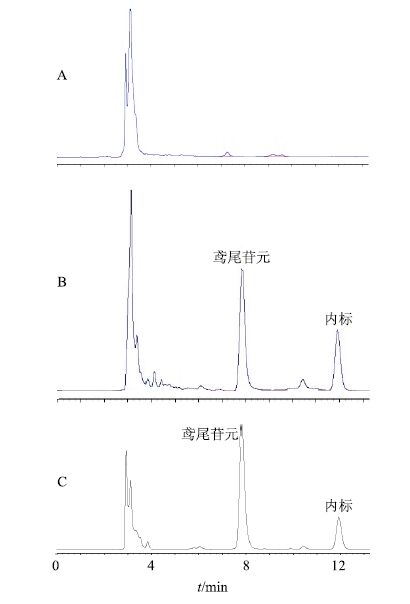
|
图 2 兔空白血浆 (A)、空白血浆加鸢尾苷元对照品和内标 (B) 和0.5 h 血浆样品加内标 (C) 的 HPLC图 Fig.2 HPLCof rabbits blank plasma (A),blank plasma added with tectorigenin reference and internal standard (B),and 0.5 h plasma sample added with internal standard (C) |
2.3.9 血药浓度测定
取血浆样品0.8 mL,加200 μL β-葡萄糖醛酸酶(4 000 U/mL),充分混匀后,37 ℃水浴24 h。加入6.25 μg/mL醋酸泼尼松龙甲醇溶液400 μL混匀,按血浆中标准曲线法处理并测定,记录鸢尾苷元与内标峰面积比,计算血浆中不同时间点的药物质量浓度,结果药物质量浓度-时间曲线见图 3。
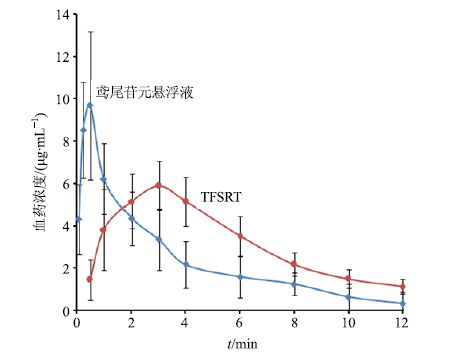
|
图 3 鸢尾苷元在家兔体血浆中的平均血药浓度-时间曲线 (x±s,n = 6) Fig.3 Average concentration-time curve of tectorigenin in rabbits (x±s,n = 6) |
2.3.10 药动学参数
所得兔血药浓度数据采用PK solver2.0药动学程序软件进行拟合分析,主要药动学参数见表 2。结果TFSRT的达峰时间(tmax)滞后于悬浮液2 h以上,峰浓度仅为悬浮液的65.38%。TFSRT的吸收速率常数(Ka)显著小于悬浮液(P<0.01),体内平均滞留时间(MRT)显著延长(P<0.01),具有明显的缓释特征。以鸢尾苷元悬浮液为参比制剂,TFSRT的相对生物利用度为(134.63±27.94)%,相对于鸢尾苷元悬浮液具有较大程度的提高(P<0.05)。
|
|
表 2 鸢尾苷元悬浮液及 TFSRT 在兔体内的主要药动学参数 (x±s,n = 6) Table 2 Main pharmacokinetic parameters of tectorigenin suspension liquid and sustained-releasetabletsin rabbits (x±s,n = 6) |
2.4 TFSRT 体内外相关性研究
采用Wagner-Nelson法[22]计算TFSRT体内吸收分数(吸收百分数),同批号的TFSRT的体外累积释放百分率(Y)对体内吸收分数(X)回归,回归方程为Y=1.062 2 X+8.791 9,r=0.987 9。
3 讨论胃内滞留漂浮制剂可延长药物胃内滞留时间,减少给药次数,增加患者依从性[23]。鸢尾苷元为葛花异黄酮有效成分,呈弱酸性,主要在胃内吸收,吸收速度快,半衰期短,适宜制备胃内滞留漂浮缓释制剂。
本实验建立了兔体内TFSRT血药浓度的分析方法,并进行了兔体内药动学的初步评价。采用甲醇沉淀蛋白,醋酸乙酯萃取法提取药物,可减少内源性物质对药物测定的干扰,该法操作简便,能明显提高回收率。鸢尾苷元吸收后主要以葡萄糖醛酸结合形式存在[24],通过β-葡萄糖醛酸酶酶解将结合型鸢尾苷元转化为游离型,增加血浆中总鸢尾苷元血药浓度,提高检测的敏感性和准确性。HPLC法测定兔体内鸢尾苷元血药浓度,操作简便,分析方法的准确度和精密度较高,方便快捷。
经兔口服TFSRT和鸢尾苷元悬浮液后,检测不同时间点的血浆中鸢尾苷元质量浓度,计算药动学参数如下:TFSRT的tmax、Cmax和AUC分别为 (2.809±0.371)h、(6.317±1.337)μg/mL和 (74.156±10.420)μg∙h/mL。鸢尾苷元悬浮液的tmax、Cmax和AUC分别为(0.442±0.138)h、(9.662±2.759)μg/mL和(57.059±13.309)μg∙h/mL。t检验结果表明,2种制剂的tmax、Cmax和AUC均有显著差异(P<0.05)。TFSRT的tmax滞后于悬浮液2 h以上,峰浓度仅为悬浮液的65.38%。TFSRT的吸收Ka 显著小于悬浮液(P<0.01),体内MRT显著延长(P<0.01),具有明显的缓释特征。
tmax、Cmax和AUC数据经对数转换后进行双单侧t检验,以鸢尾苷元悬浮液为参比制剂,TFSRT的相对生物利用度为(134.63±27.94)%,相对于鸢尾苷元悬浮液具有较大程度的提高(P<0.05)。分析其原因可能是由于鸢尾苷元主要在胃内吸收,悬浮液胃内停留时间短,部分药物未被吸收即排入肠道,肠道吸收能力差,而以原型随粪便排出体外有关。TFSRT达到了延长药物胃内滞留时间、提高生物利用度的剂型设计要求。其体内吸收与体外释放具有良好的相关性(r=0.987 9),提示可用体外释放度来控制其制剂质量。
| [1] | 国家中医药管理局《中华本草》编委会. 中华本草(4)[M]. 上海: 上海科技出版社, 1999. |
| [2] | 卢叶枫. 葛花对酒精性肝损伤的影响及其毒性研究[D]. 福州:福建中医药大学, 2016. |
| [3] | 田代华. 实用中药辞典(下卷)[M]. 北京: 人民卫生出版社, 2002. |
| [4] | 王胜鹏, 陈美婉, 王一涛. 葛花化学成分和药理活性研究进展[J]. 中药药理与临床, 2012, 28(2):193–196. |
| [5] | Mosihuzzman M, Naheed S, Hareem S. Studies on α-glucosidase inhibition and anti-glycation potential of Iris loczyi and Iris unguicularis[J]. Life Sci, 2013, 92(3): 187–192. DOI:10.1016/j.lfs.2012.11.022 |
| [6] | 林金德. 鸢尾苷元对大鼠肝脏缺血再灌注损伤的保护作用[D]. 杭州:浙江大学, 2013. |
| [7] | Amin A, Wani S H, Mokhdomi T A. Investigating the pharmacological potential of Iris kashmiriana in limitinggrowth of epithelial tumors[J]. Pharm J, 2013, 5(4): 170–175. |
| [8] | 王金凤, 杨翠燕, 张艳萍, 等. 鸢尾苷元抗血管平滑肌细胞增殖及抗动脉粥样硬化机制的研究[J]. 解放军药学学报, 2010, 26(3):203–205. |
| [9] | Tamura S, Yoshihira K, Tokumaru M. Inhibitors for expression of IgE receptor on human mast cell from Puerariae Flos[J]. Bioorg Med Chem Lett, 2010, 20(13): 3872–3875. DOI:10.1016/j.bmcl.2010.05.038 |
| [10] | 王金凤, 薄华本, 孟祥颖, 等. 鸢尾苷元对急性心肌梗死小鼠心肌的保护作用[J]. 中国新药与临床杂志, 2010, 29(2):99–103. |
| [11] | 王金凤, 杨翠燕, 张艳萍, 等. 鸢尾苷对高脂血症大鼠血清脂质的影响[J]. 基础医学与临床, 2010, 30(9):925–929. |
| [12] | 王维, 徐小平, 卿钦, 等. 鸢尾苷元在小鼠体内的组织分布[J]. 华西药学杂志, 2013, 28(6):601–603. |
| [13] | Thilakarathna S H, Rupasinghe H P. Flavonoid bioavailability and attempts for bioavailability enhancement[J]. Nutrents, 2013, 5(9): 3367–3387. DOI:10.3390/nu5093367 |
| [14] | 王焱, 宋小玲, 陈银芳, 等. 龙胆总苷胃漂浮微丸制备及其体外释药特性研究[J]. 中草药, 2012, 43(9):1751–1755. |
| [15] | 杜倩, 印晓星, 汤道权, 等. 银杏叶提取物胃漂浮滞留缓释片的制备及其体外释放度评价[J]. 中国实验方剂学杂志, 2012, 18(22):25–29. |
| [16] | 张晓琳. 戊己丸胃漂浮微丸制备工艺及血清图谱研究[D]. 青岛:青岛科技大学, 2016. |
| [17] | 王金凤, 魏颖, 王芳, 等. HPLC法快速测定葛花提取物中4种异黄酮类化合物的含量[J]. 中国药师, 2014, 17(9):1496–1498. |
| [18] | 杨立平, 邓桂明, 欧阳荣. 乌药胃内漂浮片的制备及体外释放研究[J]. 中南药学, 2010, 8(7):493–496. |
| [19] | 中国药典[S]. 一部. 2015. |
| [20] | 郑彩美, 卢毅, 张彤, 等. 葛根总黄酮经鼻和口服给药的药代动力学研究[J]. 中成药, 2009, 31(8):1194–1198. |
| [21] | 向大雄, 张杰, 李焕德, 等. HPLC法测定犬血浆中葛根素含量[J]. 药物分析杂志, 2004, 24(6):599–601. |
| [22] | 张继稳, 李川. 正确使用Wagner-Nelson法评价缓释、控释制剂吸收度[J]. 中国药学杂志, 2007, 42(3):236–238. |
| [23] | 赵强, 陈建明. 胃滞留缓释片的研究进展[J]. 华西药学杂志, 2012, 27(6):718–721. |
| [24] | 裴利宽, 郭宝林. 黄酮类化合物吸收和代谢研究进展[J]. 中国药学杂志, 2006, 41(8):568–572. |
 2017, Vol. 48
2017, Vol. 48

