2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
热毒宁注射液处方由青蒿Artemisiae Annuae Herba、金银花Lonicerae Flos、栀子Gardeniae Fructus 3味药材组成,临床主要用于外感风热所致感冒、咳嗽,症见高热、微恶风寒、头痛身痛、咳嗽、痰黄;上呼吸道感染、急性支气管炎见上述证候者[1-2]。自2005年上市以来,由于其在治疗上呼吸道感染、急性支气管炎所致的高热方面有确切的疗效,得到广大患者和临床使用单位的认可[3-7]。青蒿金银花醇沉浓缩是热毒宁注射液生产过程中关键控制工序[8],浓缩液质量的稳定是影响后续纯化效果的关键,如果浓缩液质量出现较大波动,纯化后得到的中间体的均一性将无法保证,继而影响到热毒宁注射液最终成品的安全性、质量可控性[9]。因此,严格控制青蒿金银花醇沉浓缩过程关键指标波动范围对于提升热毒宁注射液生产过程质量控制水平有着重要的科学意义[8]。近红外光谱(NIRS)技术作为一种快速的过程分析技术已被广泛应用于石油、食品等领域[10-12]。近年来在中药制药过程在线监测和控制[13-14]中也得到广泛的应用。本研究引入NIRS技术,采用偏最小二乘回归(PLSR)法建立热毒宁注射液醇沉浓缩过程关键指标的定量校正模型,在线监控醇沉浓缩过程关键指标的变化情况,为热毒宁注射液生产过程自动化控制奠定基础。
1 仪器与材料Matrix-F近红外光谱仪,德国布鲁克光谱仪器公司,配备InGaAs检测器,化学计量学软件OPUS7.5;Agilent 1260高效液相色谱仪,美国安捷伦科技有限公司;ME104E型电子天平,梅特勒-托利多仪器有限公司;HWS26型电热恒温水浴锅,上海一恒科技有限公司;DHG-9070A型电热鼓风干燥箱,上海一恒科技有限公司。
对照品新绿原酸(批号MUST-14043010,质量分数≥98%)、隐绿原酸(批号MUST-14041410,质量分数≥98%),成都曼斯特生物科技有限公司;对照品绿原酸,批号110753-201314,质量分数≥96.6%,中国食品药品检定研究院;甲醇,分析纯,批号021240102,上海星可高纯溶剂有限公司;磷酸,分析纯,批号20120703,国药集团化学试剂有限公司;热毒宁注射液醇沉浓缩过程样本均来源于江苏康缘药业股份有限公司数字化车间。
2 方法与结果 2.1 醇沉浓缩样本取样方法热毒宁注射液醇沉上清液浓缩过程为减压浓缩过程,为了实现近红外探头在线获取光谱及建模时自动采集样本,对减压浓缩设备进行改造,增加了2个外部回路(A回路、B回路),其中A回路为全回路,实现回路中的药液与浓缩罐中的药液物质基础基本一致,浓缩过程中近红外探头获得的光谱基本能够反映浓缩罐中药液的信息;B回路为半回路,在近红外探头下方管道上安装B回路,与减压取样机相连,实现负压取样,B回路基本能够实现在光谱扫描后及时获得扫描样本,NIRS采集及样本采集示意图见图 1。
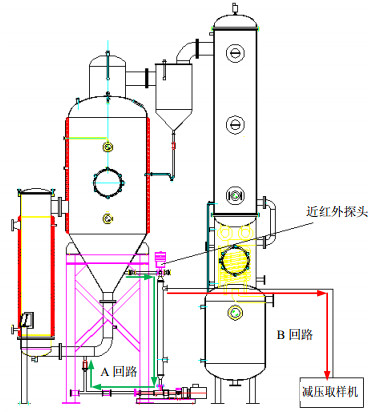
|
图 1 浓缩过程近红外在线取样示意图 Fig.1 Diagram of near-infrared on-line detection system |
取样方式为自浓缩开始至浓缩结束前1 h每隔10 min取样1次,浓缩结束前1 h内每隔5 min取样1次。本实验共取样9个批次,批号分别为Z150505、Z150817、Z150828、Z150829、Z150902、Z150908、Z150916、Z150925、Z150930,在线扫描NIRS,同时获得扫描样本,采用HPLC获得样本关键指标定量数据,其中8批用于建立定量校正模型,1批用于模型在线验证。
2.2 NIRS采集方式青蒿金银花醇沉浓缩液NIRS采集方式为透射法,光谱范围4 000~12 800 cm−1,分辨率2 cm−1,采用空气为背景对照。热毒宁注射液醇沉浓缩过程样本NIRS原始图谱见图 2。
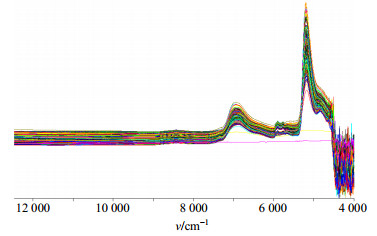
|
图 2 青蒿金银花醇沉浓缩原始NIRS Fig.2 Raw NIRS of concentration of AAH and LF alcohol precipitation |
2.3 新绿原酸、绿原酸及隐绿原酸定量测定[15] 2.3.1 色谱条件
色谱柱为Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);流动相为0.1%磷酸水溶液-甲醇,梯度洗脱:0~10 min,15%~25%甲醇;10~30 min,25%~35%甲醇;30~60 min,35%~50%甲醇;体积流量0.8 mL/min;柱温30 ℃;检测波长为324 nm;进样量为10 μL。理论板数按绿原酸峰计算,应不低于3000,色谱图见图 3。
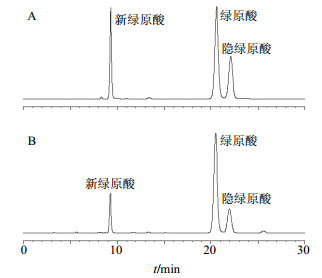
|
图 3 混合对照品(A)及样品(B)的HPLC图 Fig.3 HPLC of mixed reference substances (A) and sample (B) |
2.3.2 对照品溶液的制备
取新绿原酸、绿原酸、隐绿原酸对照品适量,精密称定,加50%甲醇制备成含新绿原酸13.36 μg/mL、绿原酸36.41 μg/mL、隐绿原酸15.10 μg/mL的混合对照品溶液。
2.3.3 供试品溶液的制备取青蒿金银花醇沉浓缩液约0.5 g,精密称定,置于50 mL量瓶中,50%甲醇定容,摇匀,20 000 r/min离心10 min,取上清液,即得。
2.3.4 线性关系考察分别精密称取新绿原酸3.45 mg、绿原酸18.57 mg、隐绿原酸8.74 mg置25 mL量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,即得混合对照品溶液。对混合对照品进行0、2.5、5、10、20、40倍稀释,分别精密吸取上述系列对照品溶液各10 μL,注入高效液相色谱仪,测定,以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归,得新绿原酸回归方程Y=0.578 0 X-0.469 7,r=0.999 9,线性范围3.45~138.00 μg/mL,绿原酸回归方程Y=0.742 1 X-0.857 7,r=0.999 8,线性范围18.57~742.80 μg/mL,隐绿原酸回归方程Y=0.615 8 X-0.609 4,r=0.999 9,线性范围8.74~349.60 μg/mL。
2.3.5 新绿原酸、绿原酸及隐绿原酸定量检测结果建模样品中新绿原酸、绿原酸、隐绿原酸的实际检测结果见图 4。从检测结果可以看出,由于生产批量大,1个批次浓缩方式是边浓缩边补液的方法,整个浓缩过程中存在多次补液情况,致使检测数据出现锯齿回调趋势,但总体看来随着浓缩时间的增加3个指标数值均呈上升趋势,用于模型验证的样品3种指标成分量范围包含在建模样品范围内。由表 1数据可以看出外部预测样品中各指标成分范围均包含于建模样本指标范围内。
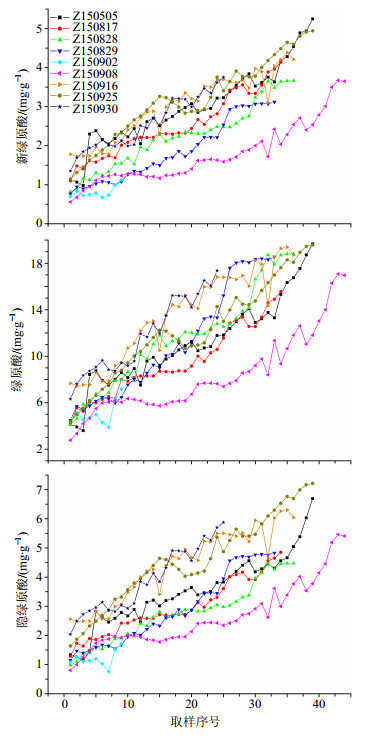
|
图 4 不同批次样品中新绿原酸、绿原酸、隐绿原酸的变化曲线 Fig.4 Change curves of neochlorogenic acid, chlorogenic acid, and 4-O-caffeoylquinic acid for different batch samples |
|
|
表 1 样品中各指标成分量范围 Table 1 Ranges of indexes in sample |
2.4 模型评价参数及建模方法
利用PLSR法[16-18]建立定量校正模型,潜变量的数目由留一交叉验证法和预测误差平方和获得。模型性能评价采用决定系数(R2)、校正误差均方根(root mean square error of calibration,RMSEC),交叉验证误差均方根(root mean square error of cross validation,RMSECV),预测相对偏差(relative standard error of prediction,RSEP)和用于评价模型预测能力的预测相对误差偏差(relative prediction deviation,RPD)来评价[19-20]。
2.4.1 PLSR法潜变量数(n)确定PLSR法是目前NIRS分析中使用最多、效果最好的一种方法,其n的选择[20-21]直接关系到所建立模型的预测准确度,建模过程使用的n如果太少,则可能不能充分利用NIRS的信息;如果使用的n过多,在建立模型过程中又可能会引入噪音,降低模型的预测能力,合理地确定参加建模的n是建模型优劣的关键因素之一[22]。化学计量学软件通过RMSECV与n的比值(RMSECV/n)曲线图来确定最佳建模因子数,最理想的曲线是RMSECV随着因子的增大快速下降,出现一个最小值后随着因子的增加逐渐增大,通常选择比值最小的维数作为建模维数。实验发现,绿原酸建模时,n在1~10,RMSECV/n分别为2.00、1.34、1.16、0.92、0.71、0.67、0.68、0.68、0.69、0.69。可以看出,当n为6时比值为最小,此时建立的模型效果较佳。
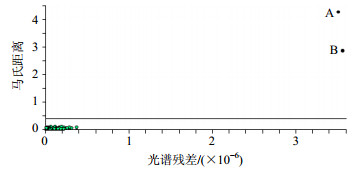
2.4.2 建模异常样本剔除本实验以马氏距离[20]与光谱残差的比值对异常样本进行判断,如图 5所示,图中的水平线为马氏距离阈值,马氏距离超出阈值的样本即被判断为异常样本,如图中样本A和样本B即被判断为异常点进行剔除。
|
图 5 定量校正模型异常点剔除 Fig.5 Elimination of outliter of rapid quantitative analysis model |
2.4.3 光谱建模波段的选择
NIRS在波长4 000~12 000 cm−1所有光谱信息均可参与PLSR建模,但是光谱噪音或者样品中某一已知成分的超强吸收会造成所建立模型的变坏,因此建模时将对建模波段进行选择。NIRS区的吸收主要包括C-H、N-H、O-H、S-H、C=O、C=C等基团的振动,热毒宁注射液青蒿金银花醇沉浓缩过程药液体系基本为醇-水体系,含有大量的O-H基,极性很强,在NIRS中1 440 nm(6 944 cm−1)和1 940 nm(5 155 cm−1)处有很强的合频和倍频吸收谱带,从图 2青蒿金银花醇沉浓缩原始NIRS中可以看出4 500~5 400 cm−1、6 500~7 500 cm−1光谱区间为“水峰”吸收谱段。此外,通常认为吸收度大于1.5的波长区间属于饱和吸收,建模时不宜采用这一波段的光谱。结合上面2点,建模前首先去掉4 000~5 400 cm−1波段的光谱。由于9 000~1 200 cm−1波段的光谱基本无吸收,为了节约计算时间,该波段也不参与建模波,最终选择5 400~9 000 cm−1光谱波段为青蒿金银花醇沉浓缩定量校正模型优化波段。
2.4.4 光谱预处理方法选择NIRS不仅能反应物质的化学组成与浓度,背景噪音、物质的粒度、黏度等理化性质对光谱也有很大影响。因此,在建立定量校正模型时,希望从光谱中提取与考察指标有关的信息,消除与考察指标无关的因素,对建立稳定可靠的模型,提高模型的预测精度非常关键,不同光谱预处理方法模型优化结果见表 2。
|
|
表 2 模型优化结果 Table 2 Optimization results of model |
2.5 模型建立
化学计量学软件在建模优化过程采用多种预处理方法和不同建模波段同时优化方法,给出优化结果,优化结果按照RMSECV值升序排列,通常认为RMSECV越小,模型的性能越好,本实验对前10个优化结果进行未知样本预测,以RSEP的大小结合R2、RPD选出各个指标的最佳模型,判断标准为RSEP越小越好,R2、RPD[22-23]越大越好。
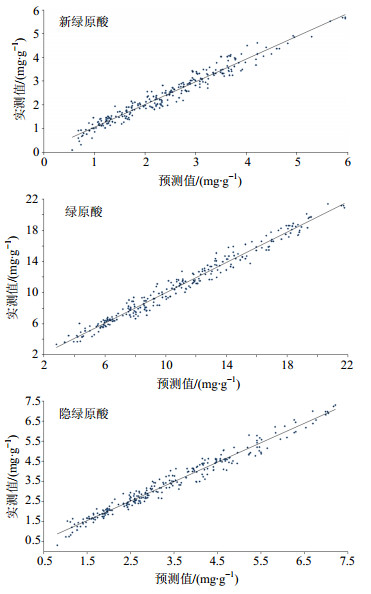
由表 2模型优化结果可以得到,以新绿原酸、绿原酸为指控指标建立的校正模型的最佳光谱预处理方法是一阶导数结合17点平滑,最佳建模波段为5 446.2~7 502 cm−1;以隐绿原酸为指控指标建立的校正模型,的最佳光谱预处理方法是减去1条直线,最佳建模波段为5 446.2~9 403.6 cm−1;3个指标得到的最佳校正模型校正集及交互验证集的RPD均大约3,RSEP均低于4%,表明模型可以用于定量分析,且分析结果准确、可靠与HPLC法无显著性差异。交互验证集样品的新绿原酸、绿原酸、隐绿原酸的预测值和实测值的线性回归图见图 6。
|
图 6 模型线性回归图 Fig.6 Correlation of model |
2.6 定量模型验证
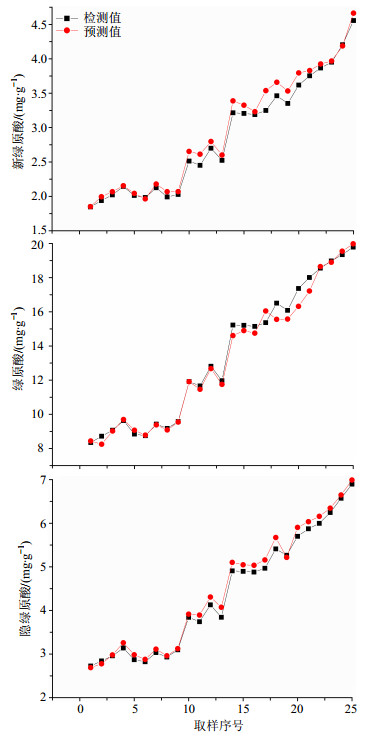
利用所建立的新绿原酸、绿原酸及隐绿原酸3个定量校正模型对150930批次热毒宁注射液青金醇沉浓缩样品进行在线预测,共采集25个样品。模型对25个样品中新绿原酸、绿原酸、隐绿原酸3个指标的预测值与实测值的R2分别为0.984、0.983、0.987,RSEP分别为3.519%、3.778%、3.895%,均小于4%,结果表明建立的定量校正模型能够用于中药生产过程的在线监控。模型对25个样品中新绿原酸、绿原酸、隐绿原酸的预测值与实测值的趋势图见图 7。
|
图 7 预测值与检测值趋势图 Fig.7 Trend graphs of predicted and estimated values |
3 讨论
本研究采用NIRS法建立了热毒宁注射液青蒿金银花醇沉浓缩过程样品的定量快速检测方法,建立的定量校正模型在线预测精度较高,能够满足在线定量检测的目的,为热毒宁注射液生产过程质量自动化控制奠定基础。
文献报道[24-27]绿原酸、新绿原酸、隐绿原酸、异绿原酸A、B、C,咖啡酸、断氧化马钱子苷等具有抗菌、抗炎、抗病毒作用,是热毒宁注射液的主要药效成分。根据上述指标成分在青蒿金银花醇沉浓缩中的含量高低,本实验开始预计建立新绿原酸、绿原酸、隐绿原酸、异绿原酸A、B、C,断氧化马钱子苷7个指标的定量校正模型,但在模型建立过程中异绿原酸A、B、C及断氧化马钱子苷建立的模型R2较小,RPD小于3,采用建立的模型对未知样品进行预测,RSEP均大于为5%,建立的模型不能用于定量测定,故舍弃。初步分析造成建模效果不理想的原因可能是由于异绿原酸A、B、C 3种成分在浓缩过程不稳定、存在相互转化造成的;以断氧化马钱子苷为指标建模效果不理想的原因目前仍没有找到,待后续深入研究。
| [1] | 孙科.基于信号通路的热毒宁注射液抗炎机制研究及疾病治疗策略探讨[D].西安:西北大学, 2015. |
| [2] | 方媛.热毒宁注射液治疗MODS呼吸衰竭的临床研究[D].南京:南京中医药大学, 2014. |
| [3] | 许东升, 蒋平丽, 王晓冬. 热毒宁注射液治疗儿童急性上呼吸道感染的疗效观察[J]. 中国处方药, 2015, 13(6):63–64. |
| [4] | 万亚娟, 孙建强. 热毒宁注射液治疗毛细支气管炎的疗效及对炎症因子水平的影响[J]. 现代中西医结合杂志, 2015, 24(14):1535–1537. |
| [5] | Tang L P, Xiao W, Li Y F, et al. Anti-inflammatory effects of Reduning Injection on lipopolysaccharide-induced acute lung injury of rats[J]. Chin J Integr Med, 2014, 20(8): 591–599. DOI:10.1007/s11655-014-1758-x |
| [6] | Zhang X, Gu J, Cao L, et al. Network pharmacology study on the mechanism of traditional Chinese medicine for upper respiratory tract infection[J]. Mol Biosyst, 2014, 10(10): 2517–2525. DOI:10.1039/C4MB00164H |
| [7] | 张新庄.基于网络药理学研究思路探索热毒宁注射液治疗URTI的作用机制[D].南京:南京中医药大学, 2013. |
| [8] | 王永香, 李淼, 米慧娟, 等. 应用统计过程控制技术研究建立青蒿金银花醇沉过程中实时放行标准[J]. 中草药, 2016, 47(9):1501–1507. |
| [9] | 李林颖.热毒宁注射液指纹谱质量控制方法研究[D].大连:大连工业大学, 2013. |
| [10] | 陆婉珍. 现代近红外光谱分析技术[M]. 第二版. 北京: 中国石化出版社, 2006. |
| [11] | 芮玉奎, 黄昆仑, 王为民, 等. 近红外光谱技术在检测转基因油菜籽中芥酸和硫甙上的应用研究[J]. 光谱学与光谱分析, 2006, 26(12):2190–2192. |
| [12] | 钱平, 孙国琴, 张存洲. 基于近红外光谱技术的石油组分定量分析新方法[J]. 光谱学与光谱分析, 2008, 28(12):2851–2854. |
| [13] | 杜文俊, 刘雪松, 陶玲艳, 等. 热毒宁注射液金银花和青蒿(金青)醇沉过程中多指标的近红外快速检测[J]. 中草药, 2015, 46(1):61–66. |
| [14] | 魏惠珍, 张五萍, 毛红梅, 等. 近红外光谱法在白芍提取物纯化过程中快速质量控制研究[J]. 中草药, 2013, 44(9):1128–1133. |
| [15] | 王永香, 米慧娟, 张传力, 等. Box-Behnken响应面法优化热毒宁注射液金银花和青蒿(金青)的醇沉工艺研究[J]. 中草药, 2015, 46(5):671–678. |
| [16] | 李文龙, 瞿海斌. 黄芪提取过程总皂苷质量浓度的在线监测[J]. 中草药, 2012, 43(8):1531–1535. |
| [17] | 白新涛, 霍宝军, 张博, 等. 近红外光谱法快速检测黄芪注射液中黄芪甲苷和总固体量[J]. 中草药, 2012, 43(11):2189–2193. |
| [18] | Shi J Y, Zou X B, Huang X W, et al. Rapid detecting total acid content and classifying different types of vinegar based on near infrared spectroscopy and least-squares support vector machine[J]. Food Chem, 2013, 138(1): 192–199. DOI:10.1016/j.foodchem.2012.10.060 |
| [19] | Boiret M, Meunier L, Ginot Y M. Tablet potency of Tianeptine in coated tablets by near infrared spectroscopy:model optimization, calibration transfer and confidence intervals[J]. J Pharm Biomed, 2011, 54(3): 510–516. DOI:10.1016/j.jpba.2010.09.029 |
| [20] | De B C, Chavez P F, Mantanus J, et al. Critical review of near-infrared spectroscopic methods validations in pharmaceutical applications[J]. J Pharm Biomed, 2012, 69(8): 125–132. |
| [21] | 刘燕德, 彭彦颖, 孙旭东. 鸡蛋蛋白pH可见/近红外光谱在线检测信息变量提取研究[J]. 江西农业大学学报, 2010, 32(5):1075–1080. |
| [22] | 金叶, 丁海樱, 吴永江, 等. 近红外光谱技术用于血必净注射液提取过程的在线检测研究[J]. 药物分析杂志, 2012, 32(7):1214–1221. |
| [23] | 闫珂巍, 王福, 梅国荣, 等. 基于近红外光谱技术快速定性鉴别广陈皮模型的建立[J]. 中草药, 2015, 46(20):3096–3099. |
| [24] | 李海波.热毒宁注射液药效物质基础研究[D].南京:南京中医药大学, 2013. |
| [25] | 张秋红, 朱子薇, 李晋, 等. 中药青蒿化学成分与种植研究现状[J]. 中国医药导报, 2011, 8(19):10–12. |
| [26] | 陈秋竹, 林瑞超, 王钢力, 等. 金银花提取物化学成分研究[J]. 中药材, 2010, 33(6):920–922. |
| [27] | 黄丽瑛, 吕植桢, 李继彪, 等. 中药金银花化学成分的研究[J]. 中草药, 1996, 27(11):645–647. |
 2017, Vol. 48
2017, Vol. 48


