2. 澳门理工学院高等卫生学校, 澳门 00853
2. School of Health Sciences, Macao Polytechnic Institute, Macau 00853, China
Pickering乳液是一种通过固体微粒吸附于油水界面形成膜状结构而起稳定作用的乳液。与传统乳液相比,Pickering乳液不需要使用表面活性剂,安全性更高,且热力学稳定性更好[1],是一种潜在的优良给药系统,已在皮肤局部给药[2-3]、口服给药[4]中有所研究应用。但目前用作给药系统的Pickering乳液大多使用二氧化硅纳米粒作为固体微粒稳定剂,这可能带来药用安全性问题[5-6]。另外,目前Pickering乳液主要是将水难溶性药物溶解于油相中,油相的溶解能力直接限制了乳液的载药能力。
针对以上问题,课题组前期研究采用难溶性药物自身的纳米晶作为固体微粒稳定剂制备Pickering乳液即纳米晶自稳定Pickering乳液(nanocrystalline self-stabilized Pickering emulsion,NSSPE)。以水飞蓟宾为模型药物,制备了平均粒径为(27.30±3.10)μm,可稳定40 d以上的NSSPE[7]。大鼠ig给药后,NSSPE的峰浓度较纳米晶混悬液和原料药分别提高了2.5倍和2.3倍,AUC分别提高了1.4倍和3.8倍[7]。
葛根素(puerarin,Pu)是从豆科葛属植物野葛Pueraria lobata (Willd.) Ohwi中提取的一种水难溶性黄酮类化合物,已被广泛用于心脑血管疾病的治疗[8]。但葛根素溶解性和渗透性差,口服生物利用度低[9]。临床主要应用的是其注射剂,但注射液使用了大量的丙二醇,增加了溶血风险[10-11]。有研究采用新型给药系统,诸如自微乳化给药系统[12-13]、脂质体[14]、固体脂质纳米粒冻干粉[15]、泡腾性渗透泵控释片[16]以及聚乙二醇衍生化[17]等方法提高葛根素的口服生物利用度,但制备方法复杂,需使用大量表面活性剂,具有潜在的安全性问题[18]。
本研究以葛根素为模型药物,研究制备葛根素纳米晶自稳定Pickering乳液(puerarin NSSPE,Pu-NSSPE)。在预试验基础上,主要研究药物加入顺序、油相组成、药物加入量、油水体积比、匀质压力和水相pH值等对NSSPE成型与稳定的影响,探寻制备的关键影响因素,为后期体内外性质研究提供优化制剂。
1 仪器与材料FA2004A电子天平,上海精天电子仪器有限公司;FA25高速剪切机,上海弗鲁克流体机械制造公司;AH100D高压均质机,加拿大ATS工业系统有限公司;BK5000光学生物显微镜,集成Cool SNAP Photomerics光学采集系统,OPTEC奥特光学公司;佳能IXUS1100HS数码相机,佳能中国有限公司;TDP-6压片机,长沙中亚制药设备有限公司;DFC310 FX Leica荧光倒置显微镜(Fluorescence Inversion Microscope System,FIMS),德国Leica公司;Zetasizer Nano ZS纳米粒度及Zeta电位分析仪,英国马尔文仪器公司;LC-20AD高效液相色谱系统,岛津公司;G16-WS高速离心机,长沙湘仪离心机仪器有限公司;BT-9100粒度分析仪,丹东百特仪器有限公司;SB-5200D超声波清洗机、JY98-3D超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
葛根素原料药,质量分数98%,批号140602,四川玉鑫药业有限公司;单油酸甘油酯(PECEOL),法国嘉法狮公司;辛酸/葵酸甘油三酯(Captex 355)、辛酸/葵酸甘油一酯二酯(Capmul MCM),美国阿比泰克公司;油酸聚乙二醇甘油酯(Labrafil M 1944 CS)、肉豆蔻酸异丙酯、油酸乙酯,阿拉丁生化科技有限公司;川芎油、大豆油、蓖麻油、茶油、橄榄油,江西雪松天然药用油有限公司;其余试剂均为分析纯。
2 方法与结果 2.1 Pu-NSSPE的成型和初步稳定性评价 2.1.1 外观考察将制得的样品装于玻璃瓶中,室温静置,观察分层、絮凝、沉淀等现象,用数码相机拍摄外观照片,测定乳液层的高度,按公式计算分层指数:分层指数=1-Ht/H0(Ht、H0分别为t、0时刻乳液层的高度)[19]。
2.1.2 乳滴形态观察与粒径测定取乳液1滴,均匀涂于载玻片上,光学显微镜观察乳滴形态,集成Cool SNAP Photomerics光学采集系统拍摄照片,并用USB2.0 Gamer软件计数200个乳滴的粒径,按下式计算平均体积径(d43)[20-21],以d43表达乳滴粒径。每份样品重复3次。
d43=∑di4/∑di3,i=1、2、3、…、200
2.2 药物加入顺序的影响 2.2.1 制备方法分别按以下3种方法制备Pu-NSSPE,在0 d和30 d时对乳液进行评价。
(1)水相一步法:称取350 mg葛根素,先加入63 mL水,再加入7 mL油(川芎油),19 000 r/min高剪切2 min,混合均匀,最后100 MPa高压乳匀3 min,即得。
(2)水相两步法:称取350 mg葛根素,先加入63 mL水,探头超声(800 W,工作5 s,间歇5 s,共3 min)制得葛根素纳米晶混悬液;再加入7 mL油(川芎油),19 000 r/min高剪切2 min,混合均匀,最后100 MPa高压乳匀3 min,即得。
(3)油相一步法:称取350 mg葛根素,先加入7 mL油(川芎油),水浴超声(300 W,室温)5 min分散均匀,再加入63 mL水,19 000 r/min高剪切2 min,混合均匀,最后100 MPa高压乳匀3 min,即得。
2.2.2 药物加入顺序对Pu-NSSPE成型和初步稳定性的影响依不同药物加入顺序制备的Pu-NSSPE室温放置30 d前后的外观变化见图 1。由图 1可知,放置30 d后,水相一步法制备的Pu-NSSPE样品中葛根素吸附于油相,絮凝成团,水油分层明显;水相两步法制备的Pu-NSSPE样品分层现象较水相一步法弱,分层指数为20.0%,乳滴粒径无显著性变化,分别为(48.53±15.71)μm和(54.38±3.01)μm;油相一步法制备的样品外观无明显改变,分层指数为6.0%,乳滴粒径从(12.72±1.94)μm增至(40.30±1.94)μm(P < 0.01)。可见,药物先分散于水相难以形成稳定的乳液,油相一步法更有利于Pu-NSSPE的成型和稳定,其乳滴粒径也显著小于水相两步法(P < 0.01)。

|
A-水相一步法B-水相两步法C-油相一步法 A-one-step method in water phase B-two-step method in water phase C-one-step method in oil phase 图 1 依不同药物加入顺序制备的Pu-NSSPE室温放置30 d前后的外观 Fig.1 Appearance of Pu-NSSPE prepared by different methods after a storage of 30 d at room temperature |
2.3 油相的影响 2.3.1 测定葛根素/油/水的三相接触角
取葛根素粉末,在压片机上压为直径1.3 cm、厚度约1 mm的薄片,将薄片置于25 mL透明小烧杯中,注入油相,液面高度以浸没压片2 cm左右为宜,再用注射器向薄片表面滴1滴水,待液滴穿过石蜡液层并在压制薄片上稳定后用数码相机拍照,测定液滴的接触角[22],即为葛根素/油/水的三相接触角。
2.3.2 制备不同油相的Pu-NSSPE分别称取350 mg的葛根素原料药,加入7 mL不同油相,依前述“油相一步法”制得不同油相的Pu-NSSPE,室温静置,分别在0 d和30 d时对其进行成型和初步稳定性评价。
2.3.3 川芎油与Labrafil M 1944 CS混合油相配比的影响分别称取350 mg的葛根素原料药,加入7 mL不同配比的混合油相(川芎油-Labrafil M 1944 CS配比分别为1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1),依前述油相一步法制得Pu-NSSPE,室温静置,分别在0 d和90 d时对其进行成型和初步稳定性评价。
2.3.4 油相种类对Pu-NSSPE成型和初步稳定性的影响葛根素在各油相中的接触角测定结果见表 1。不同油相制备的Pu-NSSPE室温放置30 d前后的外观变化见图 2。可见,以Captex 355(图 2-B)为油相,不能制得均匀的乳液;以Capmul MCM(图 2-C)、Peceol(图 2-D)、油酸乙酯(图 2-E)和肉豆蔻酸异丙酯(图 2-F)为油相制备的乳液,30 d后已出现明显分层,一层为葛根素的白色絮状物,另一层为澄清的水层;橄榄油(图 2-H)、茶油(图 2-I)、大豆油(图 2-J)和蓖麻油(图 2-K)制备的样品30 d后虽然没有澄清的水层出现,但都有明显的葛根素絮状聚集物;只有Labrafil M 1944 CS(图 2-A)和川芎油(图 2-G)制备的样品30 d后仍保持了较好的乳液性状,分层指数均为6.0%;但川芎油制备的样品粒径增大明显,从(13.85±8.32)μm增至(53.73±3.27)μm(P < 0.01),Labrafil M 1944 CS制备的样品粒径变化不大,放置前后的粒径分别为(16.85±1.20)μm和(21.73±6.00)μm。故后续考虑将其配伍使用。
|
|
表 1 葛根素在各油相中的接触角(x±s, n=3) Table 1 Contant angles of puerarin in different oils (x±s, n=3) |

|
A-Labrafil M 1944 CS B-Captex 355 C-Capmul MCM D-Peceol E-油酸乙酯F-肉豆蔻酸异丙酯G-川芎油H-橄榄油I-茶油J-大豆油K-蓖麻油 A-Labrafil M 1944 CS B-Captex 355 C-Capmul MCM D-Peceol E-ethyl oleate F-isopropyl myristate G-Szechwan Lovage Rhizome oil H-olive oil I-tea-seed oil J-soybean oil K-castor oil 图 2 不同油相制备的Pu-NSSPE室温放置30 d前后的外观 Fig.2 Appearance of Pu-NSSPE prepared with different oils after a storage of 30 d at room temperature |
2.3.5 川芎油与Labrafil M 1944 CS不同体积比配伍对Pu-NSSPE成型和初步稳定性的影响
采用不同体积比的川芎油与Labrafil M 1944 CS混合油相制备的Pu-NSSPE室温放置90 d前后的外观变化见图 3。可见,随着川芎油配比增多,制得的Pu-NSSPE中油相析出愈加明显;放置90 d后,川芎油-Labrafil M 1944 CS配比为8:2、7:3和6:4的样品均出现明显的葛根素絮状聚集物,混合油相配比为5:5的样品明显分层,上层呈半流体的牛奶状,下层变清亮;混合油相配比为4:6、3:7和2:8的样品底部出现大量葛根素沉淀物;仅混合油相配比为9:1和1:9的Pu-NSSPE外观变化较小,分层指数分别为11.0%和20.0%,乳滴形态也都较好,但9:1样品的粒径为(10.45±1.35)μm,显著小于1:9样品的(32.01±1.66)μm(P < 0.01);放置90 d后,乳滴粒径均有所增大,但9:1样品的粒径仍小于1:9样品的粒径,分别为(32.46±4.59)μm和(50.91±1.56)μm(P < 0.05)。

|
图 3 川芎油与Labrafil M 1944 CS不同配比制备的Pu-NSSPE室温放置90 d前后的外观 Fig.3 Appearance of Pu-NSSPE prepared at different ratios of Szechwan Lovage Rhizome oil to Labrafil M 1944 CS after a storage of 90 d at room temperature |
2.4 药物加入量的影响 2.4.1 制备不同葛根素载药量的Pu-NSSPE
分别称取70、140、210、280、350、525 mg葛根素(乳液中葛根素的理论载药量分别为1.0、2.0、3.0、4.0、5.0、7.5 mg/mL),加入7 mL油相(川芎油-Labrafil M 1944 CS体积比为9:1),依前述油相一步法制得Pu-NSSPE,室温静置,分别在0 d和30 d时对其进行成型和初步稳定性评价。
2.4.2 药物加入量对Pu-NSSPE成型和初步稳定性的影响不同药物加入量制备的Pu-NSSPE室温放置30 d前后的外观变化见图 4,分层指数和乳滴粒径变化见表 2。由图 4和表 2可知,葛根素加入量在1.0~5.0 mg/mL范围内制备的Pu-NSSPE,放置30 d后仍保持了较好的乳液外观,分层指数均在11.0%~18.0%,0 d时的乳滴粒径在10~20 μm,30 d后仅药物加入量4.0、5.0 mg/mL制备的Pu-NSSPE粒径显著增大。葛根素加入量为7.5 mg/mL的Pu-NSSPE放置30 d后发生了明显的絮凝。

|
图 4 不同葛根素加入量制备的Pu-NSSPE室温放置30 d前后的外观 Fig.4 Appearance of Pu-NSSPE prepared at different puerarin amounts after a storage of 30 d at room temperature |
|
|
表 2 不同药物加入量制备的Pu-NSSPE室温放置30 d后的分层指数和乳滴粒径 Table 2 Cream index and droplet size of Pu-NSSPE prepared at puerarin amounts after a storage of 30 d at room temperature |
2.5 油水体积比的影响 2.5.1 制备不同油水体积比的Pu-NSSPE
分别称取350 mg葛根素,分别加入3.25、7、14、21 mL油相(川芎油-Labrafil M 1944 CS体积比为9:1),水浴超声分散(300 W,室温)5 min,再加入不同体积的纯水使油水体积比分别为5:95、10:90、20:80、30:70,依前述油相一步法制得Pu-NSSPE,室温静置,分别在0 d和30 d时对其进行成型和初步稳定性评价。
2.5.2 油水体积比对Pu-NSSPE成型和初步稳定性的影响不同油水体积比制备的Pu-NSSPE室温放置30 d前后的外观变化见图 5,分层指数和乳滴粒径变化见表 3。随着油相体积的增加,乳液析出的油相增多,分层指数增大,乳液稳定性降低。油水体积比为20:80和30:70时,放置30 d后的乳液底部出现清亮的水层,乳滴粒径为0 d时的1.74和1.09倍;油水体积比为5:95和10:90时的乳滴粒径在0 d时显著高于20:80和30:70(P < 0.01);30 d后变化不大(P > 0.1)。

|
图 5 不同油水体积比制备的Pu-NSSPE室温放置30 d后的外观 Fig.5 Appearance of Pu-NSSPE prepared at different oil/water ratios after storage of 30 d at room temperature |
|
|
表 3 不同油水体积比制备的Pu-NSSPE室温放置30 d后的分层指数和乳滴粒径 Table 3 Cream index and droplet size of Pu-NSSPE prepared at different oil/water ratios after a storage of 30 d at room temperature |
2.6 匀质压力的影响 2.6.1 不同匀质压力制备Pu-NSSPE
分别称取350 mg葛根素,加入7 mL油相(川芎油-Labrafil M 1944 CS体积比为9:1),水浴超声分散,加入63 mL纯水,19 000 r/min高剪切2 min混合均匀,分别以60、80、100 MPa高压乳匀3 min制得Pu-NSSPE,室温静置,分别在0 d和30 d时对其进行成型和初步稳定性评价。
2.6.2 匀质压力对Pu-NSSPE成型和初步稳定性的影响图 6显示,60 MPa压力下高压乳匀制备的Pu-NSSPE放置30 d后油水分层明显,不成乳状。匀质压力达到80 MPa和100 MPa时,30 d后Pu-NSSPE的分层指数分别为10.0%和7.0%,0 d时的乳滴粒径分别为(12.09±0.070)μm和(8.43±1.22)μm,30 d时分别为(27.39±2.49)μm(P < 0.01)和(10.83±3.70)μm。可见,乳匀压力增大,粒径变化减弱。

|
图 6 不同匀质压力制备的Pu-NSSPE的室温放置30 d前后的外观 Fig.6 Appearance of Pu-NSSPE prepared at different homogenization pressure after storage of 30 d at room temperature |
2.7 水相pH值的影响 2.7.1 不同pH值水相制备Pu-NSSPE
分别称取350 mg葛根素,加入7 mL油相(川芎油-Labrafil M 1944 CS体积比为9:1),水浴超声分散(300 W,室温)5 min,分别加入用0.1 mol/L盐酸或0.1 mol/L NaOH调节pH值为3、5、7、9的63 mL水,依前述油相一步法制得Pu-NSSPE,室温静置,分别在0 d和30 d时对其进行成型和初步稳定性评价。
2.7.2 水相pH值对Pu-NSSPE成型和初步稳定性的影响图 7显示,水相pH值对Pu-NSSPE的形成与稳定有很大的影响。放置30 d后,pH值为3的样品完全分层,已不成乳液状;pH值为5的样品部分分层;pH值为7的样品分层指数为14.0%,乳滴粒径从(12.91±1.49)μm增大至(18.76±1.37)μm(P < 0.01);仅水相pH值为9制备的Pu-NSSPE放置30 d后未出现絮凝、分层等现象,乳滴粒径也未明显变大,分别为(11.47±6.88)μm和(12.68±4.32)μm。可见,随着水相pH值的增加,Pu-NSSPE越容易成型,稳定性也明显提高。

|
图 7 不同水相pH值制备的Pu-NSSPE室温放置30 d前后的外观 Fig.7 Appearance of Pu-NSSPE prepared at different pH of water after a storage of 30 d at room temperature |
2.8 优化条件下Pu-NSSPE制备和体外性质表征 2.8.1 Pu-NSSPE制备
称取350 mg葛根素,加入7 mL油相(川芎油-Labrafil M 1944 CS体积比为9:1)水浴超声(300 W,室温)5 min分散,加入用0.1 mol/L NaOH调节pH值为9的63 mL水,19 000 r/min高剪切2 min混合均匀,80 MPa高压乳匀3 min,即得Pu-NSSPE。
同法,不加油相制备葛根素纳米晶混悬液(puerarin nanocrystallines suspension,Pu-NCS)作为对照。
2.8.2 初步稳定性试验将Pu-NSSPE约25 mL置于25 mL玻璃瓶中,室温静置,分别在0 d及1、2、3、4、5、6个月观察乳液的外观,计算分层指数;光学显微镜观察乳滴形态,计算d43;样品用纯水稀释10倍后测定乳液的Zeta电位;另取1.5 mL乳液,4 000 r/min离心15 min,观察其外观变化。
Pu-NCS对照样品于0时刻时观察外观和纳米晶形态,样品用纯水稀释10倍后用纳米粒度及Zeta电位分析仪测定纳米晶的粒径和Zeta电位;室温静置,定时观察其外观和纳米晶形态的变化。
2.8.3 测定药物质量浓度取100 μL Pu-NSSPE于10 mL量瓶中,加入600 μL氯仿-甲醇(2:1)混合溶液,振摇使药物溶解完全,甲醇定容,15 000 r/min离心10 min,取上清液用HPLC法测定葛根素的质量浓度。色谱柱为Eclipse C18色谱柱(150 mm×4.6 mm,5 μm),流动相为甲醇-0.1%柠檬酸水溶液(29:71),体积流量为1 mL/min,检测波长为250 nm,柱温为30 ℃。
2.8.4 荧光显微镜表征分别将葛根素原料药粉末少许、Pu-NCS 1滴和Pu-NSSPE 1滴置于载玻片上,平铺展开,在荧光显微镜下观察样品形态和葛根素荧光分布区域。
2.8.5 优化工艺制备的Pu-NSSPE的体外性质表征优化工艺制备的Pu-NSSPE放置6个月前后的外观和乳滴形态见图 8,分层指数、粒径、Zeta电位和葛根素质量浓度变化见表 4。图 8显示,放置6个月后,Pu-NSSPE外观仍呈均匀的乳液状,没有油相析出或葛根素絮凝、聚集、沉淀等不稳定现象;乳滴形态也未发生明显变化。表 4显示,放置6个月后乳滴形态、Zeta电位和药物质量浓度与0时刻相比,未出现明显变化,粒径有所增大(P < 0.01)。由此证实,Pu-NSSPE室温下至少可以稳定6个月,后续观察仍在继续。4 000 r/min(7 900×g)离心15 min后乳液无分层、沉淀等不稳定现象,进一步说明Pu-NSSPE的稳定性较好。

|
图 8 Pu-NSSPE在0时刻和室温静置6个月后的外观与乳滴形态 Fig.8 Appearance and optical micrography of optimized Pu-NSSPE |
|
|
表 4 Pu-NSSPE在0 d时刻与静置6个月后的性质比较 Table 4 Characteristics of optimized Pu-NSSPE before and after a storage of six months at room temperature |
高压匀质法制备的Pu-NCS对照样品的纳米晶粒径为(250.70±50.60)nm,Zeta电位为(-38.20±1.70)mV。0 d时刻时为均匀的乳白色混悬液,放置1 h后出现明显分层,葛根素大量沉淀于底部,显微镜下可看到大量细长的絮状聚集物,明显区别于0 d时刻(图 9);荧光显微镜下观察到呈小球状(图 10-B)。这说明,未加任何稳定剂的Pu-NCS稳定性极差。图 10为葛根素原料药、Pu-NCS和Pu-NSSPE在荧光显微镜下的观察结果。可见,葛根素本身具有绿色荧光(图 10-A)。在荧光显微镜下见到Pu-NCS中有大量粒径较小的绿色小球(图 10-B),即为葛根素纳米晶颗粒。

|
图 9 Pu-NCS在0 h和室温静置1 h后的外观与形态 Fig.9 Appearance and optical micrography of Pu-NCS during storage after 0 h and 1 h at room temperature |
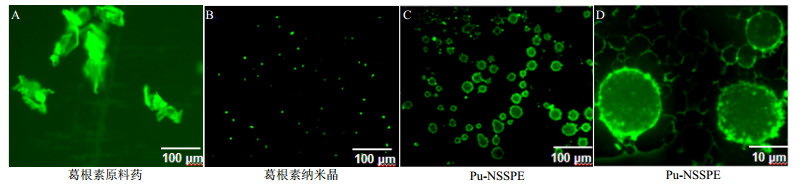
|
图 10 葛根素原料药(A)、纳米晶(B)与Pu-NSSPE (C, D)荧光显微镜相片 Fig.10 Fluorescence micrography of row puerarin (A), nanocrystalline (B) and optimized Pu-NSSPE (C, D) |
而在Pu-NSSPE中可见到大量粒径较大的圆形或椭圆形乳滴,乳滴表面绿色荧光较强,而内部较弱(图 10-C和D),这提示,葛根素纳米晶大部分吸附在乳滴的油水界面上,少量溶解在乳滴内部的油相中。油相中药物量很少,与葛根素在油相中溶解度很低的结果一致。
3 讨论 3.1 乳滴的粒径测定目前乳滴粒径的测定方法多用激光粒度分析仪测定或根据光学形态计算[7]。本研究在预试验时发现,根据光学形态,用软件计数得到的Pu-NSSPE乳滴粒径为13.86 μm,而用激光粒度分析仪测得的乳滴粒径为1.66 μm,两者相差近8倍。分析原因,这可能和激光粒度分析仪的测定方法和药物性质有关。用激光粒度分析仪测定时,需将约1 mL样品加入到500 mL纯水中,搅拌1 min使其分散均匀后才能测定。这相当于将样品稀释了500倍。葛根素在水中溶解度为2.3 mg/mL,稀释500倍后可能导致吸附于油滴表面的葛根素溶解于水中,从而使乳滴粒径明显减小。
3.2 药物加入顺序研究结果显示,葛根素需先分散于油相才能制得稳定的Pickering乳液。前期制备水飞蓟宾NSSPE时,水飞蓟宾需先分散于水相才能制得Pickering乳液[7]。原因可能是,形成Pickering乳液的固体微粒应具有适宜的亲水/疏水性,亲水性过强或疏水性过强都不利于Pickering乳液的成型和稳定[23];而药物的初始分散相会影响固体颗粒的润湿性:当粒子首先分散于油相时,粒子表面会吸附有油相分子,使得粒子的亲油性增强;当粒子首先分散于水相时,亲油性部分由于疏水作用而相互团聚,使得粒子的亲水部分裸露,整体亲水性增强[24-25]。相比较而言,水飞蓟宾疏水性较强,葛根素亲水性较强。因此,水飞蓟宾需先分散于水相中,增强其亲水性;而葛根素需先分散于油相中以增强其疏水性。这说明,在制备NSSPE时应根据不同药物的亲水/疏水性选择适宜的药物加入顺序。
3.3 油相对NSSPE的影响Pickering乳液的固体微粒稳定剂一般不具有表面活性,其稳定乳液的能力取决于固体微粒对油相或者水相的润湿性(三相接触角,θ):θ越接近90°,乳液越稳定;接触角为0°或180°的微粒可能导致其完全分散于水相或者油相,失去稳定作用[26]。葛根素对川芎油的θ最接近于90°,制备的Pickering乳液稳定性最好;葛根素对Captex 355的θ为0°,故无法制备出Pickering乳液。葛根素对Labrafil M 1944 CS的θ仅(14.8±1.31)°,但制备的Pickering乳液稳定性也较好,其原因可能在于Labrafil M 1944 CS本身具有一定的乳化作用。
3.4 葛根素加入量和油水体积比的影响固定油水体积比,当葛根素用量达到0.75%时,乳液絮凝现象严重。其原因可能是在油水体积比恒定的情况下,可吸附于乳滴界面的葛根素纳米晶数量是有限的,当吸附达到饱和时多余的葛根素纳米晶只能存在水相中,而由于缺乏其他稳定剂而导致葛根素纳米晶热力学稳定性差,放置后出现了絮凝。
固定葛根素用量,增大油水体积比,Pu-NSSPE的稳定性变差。分析原因可能是:当葛根素加入量恒定时,所形成的纳米晶数量有限,能稳定的油水界面积因此也是有限的;但增加油相体积后,未能被纳米晶吸附包裹的乳滴增多,容易合并、分层。由此可见,葛根素用量和油水体积比之间会相互影响,需要调节适当的葛根素用量和油水体积比,使葛根素刚好能完全吸附于所有的油滴界面,才有利于Pu-NSSPE的稳定。
3.5 匀质压力的影响研究结果证实,增大匀质压力,有利于Pu-NSSPE的稳定。这是因为固体微粒粒径越小,制得的Pickering乳液越稳定[27],而匀质压力能影响葛根素纳米晶的粒径,所以能影响Pickering乳液的稳定性。这也与前期水飞蓟宾NSSPE的研究结果一致[7]。
3.6 水相pH值的影响水相pH值对Pu-NSSPE的形成与稳定有很大的影响:随着水相pH值的增加,Pickering乳液越容易成型,稳定性也明显提高。水相pH值达到9时,制备的Pu-NSSPE放置30 d后仍未出现絮凝、分层等现象,乳滴形态、粒径未发生明显变化。其原因可能在于:(1)水相pH值从3增大到9,葛根素纳米晶粒径从3.4 μm减小到262 nm。纳米晶粒径越小,越能吸附于油滴表面,使乳滴稳定性增强;(2)葛根素为黄酮类化合物,在碱性条件下带有更多电荷,使Pickering乳滴的电荷增大,斥力作用增强,稳定性提高。
本研究以葛根素纳米晶为固体微粒稳定剂,制备药物纳米晶自稳定Pickering乳液。在前期研究基础上,研究主要制备工艺条件对NSSPE成型和稳定的影响,结果发现,药物在油/水相中的三相接触角是决定NSSPE成功构建的关键因素,接触角接近90°,有利于NSSPE的成型与稳定。水相pH值对Pu-NSSPE有显著影响,水相pH值为碱性时,可形成稳定的Pu-NSSPE。荧光显微镜观察到葛根素纳米晶在NSSPE乳滴油水界面有明显吸附,提示Pu-NSSPE的结构为小部分葛根素溶解于油相,大部分葛根素吸附于油水界面的乳滴结构。本研究结果表明,通过优化工艺,特别是找到接近90°三相接触角的油相,以难溶性药物自身纳米晶作为固体微粒稳定剂可以制备出稳定的NSSPE。
葛根素在水中溶解度为(2.32±0.45)mg/mL,在Pu-NSSPE中的溶解度为(4.28±0.22)mg/mL,提高了84.48%。葛根素在自微乳中的载药量较高,可达到50 mg/mL,但表面活性剂用量巨大,如陈小新等[28]制备的自微乳,聚山梨酯80和聚氧乙烯蓖麻油的用量为均达到了19%,此外还是用了19.0%助表面活性剂为1, 2-丙二醇;黄嗣航等[12]制备的自微乳中,聚山梨酯80的用量高达21.8%。可见,虽然NSSPE对葛根素的增溶效果不及自微乳,但未使用任何表面活性剂,是其优势之一。
NSSPE中仅存在水、油和药物3种物质,不含表面活性剂、异种固体微粒等其他辅料,安全性高,稳定性好;而且大量药物以纳米晶体形式吸附于油滴表面,提高了Pickering乳液的载药能力,在药剂学领域具有良好的应用前景。
| [1] | Lam S, Velikov K P, Velev O D. Pickering stabilization of foams and emulsions with particles of biological origin[J]. Curr Opin Colloid Interface Sci, 2014, 19(5): 490–500. DOI:10.1016/j.cocis.2014.07.003 |
| [2] | Frelichowska J, Marie A B, Pelletier J, et al. Topical delivery of lipophilic drugs from o/w Pickering emulsions[J]. Int J Pharm, 2009, 371(1/2): 56–63. |
| [3] | Wahlgren M, Engblom J H, Sjoo M L, et al. The use of micro-and nanoparticles in the stabilisation of Pickering-type emulsions for topical delivery[J]. Curr Pharm Biotechnol, 2014, 14(15): 222–1234. |
| [4] | Simovic S, He H, Song Y M. An oral delivery system for indomethicin engineered from cationic lipid emulsions and silica nanoparticles[J]. J Controlled Release, 2010, 143(3): 367–373. DOI:10.1016/j.jconrel.2010.01.008 |
| [5] | Li L L, Li T L, Fu C H, et al. Biodistribution, excretion, and toxicity of mesoporous silica nanoparticles after oral administration depend on their shape[J]. Nanomedicine, 2015, 11(8): 1915–1924. |
| [6] | Lin W, Huang Y W, Zhou X D, et al. In vitro toxicity of silica nanoparticles in human lung cancer cells[J]. Toxicol App Pharmacol, 2006, 217(3): 252–259. DOI:10.1016/j.taap.2006.10.004 |
| [7] | 张继芬, 刘川, 张焦, 等. 水飞蓟宾纳米晶自稳定Pickering乳液的制备及评价[J]. 药学学报, 2016, 51(5):813–820. |
| [8] | Zhou Y X, Zhang H, Peng C. Puerarin:A review of pharmacological effect[J]. Phytother Res, 2014, 28(7): 961–975. DOI:10.1002/ptr.v28.7 |
| [9] | Tang T T, Hu X B, Liao D H, et al. Mechanisms of microemulsion enhancing the oral bioavailability of puerarin:comparison between oil-in-water and water-in-oil microemulsions using the single-pass intestinal perfusion method and a chylomicron flow blocking approach[J]. Int J Nanomed, 2013, 8(5): 4415–4426. |
| [10] | 王洪宝.葛根素注射液溶血毒性机制研究[D].北京:中国人民解放军军事医学科学院, 2010. http://cn.bing.com/academic/profile?id=080f145e897f658e23c5892091fd4ec4&encoded=0&v=paper_preview&mkt=zh-cn |
| [11] | Wu J R, Zhang X M, Zhang B. Efficacy and safety of puerarin injection in treatment of diabetic peripheral neuropathy:a systematic review and Meta-analysis of randomized controlled trials[J]. J Tradit Chin Med, 2014, 34(4): 401–410. DOI:10.1016/S0254-6272(15)30039-X |
| [12] | 黄嗣航, 龙晓英, 袁飞, 等. 含天然乳化剂的新型葛根素自微乳与传统自微乳体内外性能的对比研究[J]. 中国药学杂志, 2014, 49(17):1530–1534. |
| [13] | 刘伟星, 李宁, 高崇凯. 葛根素自微乳化渗透泵控释胶囊的制备[J]. 中草药, 2013, 44(12):1568–1573. |
| [14] | 刘毅, 孙考祥, 姚文军, 等. 树枝状聚合物PAMAM包覆葛根素脂质体角膜渗透性研究[J]. 中国中药杂志, 2015, 35(1):30–34. |
| [15] | 孟祥平, 周群, 王治平, 等. 口服葛根总黄酮固体脂质纳米粒冻干粉的制备及其4种成分释放度考察[J]. 中草药, 2014, 45(17):2467–2474. |
| [16] | 王立, 张君, 王文倩. 葛根素泡腾性渗透泵控释片的制备及其体外评价[J]. 中草药, 2013, 44(6):686–691. |
| [17] | 刘新义, 李建荣, 张陆勇, 等. 多指标正交试验优选葛根素聚乙二醇衍生化合成工艺[J]. 中草药, 2011, 42(8):1528–1531. |
| [18] | Xia W, Onyuksel H. Mechanistic studies on surfactant-induced membrane permeability enhancement[J]. Pharm Res, 2000, 17(5): 612–618. DOI:10.1023/A:1007581202873 |
| [19] | Han N L, Tang C H. pH-dependent emulsifying properties of pea[Pisum sativum (L.)]proteins[J]. Food Hydrocolloids, 2013, 33(2): 309–319. DOI:10.1016/j.foodhyd.2013.04.005 |
| [20] | Spyropoulos F, Frasch-Melnik S, Norton I T. W/O/W emulsions stabilized by fat crystals-their formulation, stability and ability to retain salt[J]. Procedia Food Sci, 2011, 1: 1700–1708. DOI:10.1016/j.profoo.2011.09.251 |
| [21] | Li C, Li Y X, Sun P D, et al. Pickering emulsions stabilized by native starch granules[J]. Colloid Surface A:Physicochem Eng Aspects, 2013, 431: 142–149. DOI:10.1016/j.colsurfa.2013.04.025 |
| [22] | Li W, Zhao C H, Tan J J, et al. Roles of methyl orange in preparation of emulsions stabilized by layered double hydroxide particles[J]. Colloid Surface A:Physicochem Eng Aspects, 2013, 421(11): 173–180. |
| [23] | Zhou J, Wang L J, Qiao X Y, et al. Pickering emulsions stabilized by surface modified Fe3O4nanoparticles[J]. J Colloid Interface Sci, 2012, 367(1): 213–224. DOI:10.1016/j.jcis.2011.11.001 |
| [24] | 王莎.Pickering乳液的制备及其应用研究[D].西安:西安科技大学, 2010. |
| [25] | Rousseau D. Trends in structuring edible emulsions with Pickering fat crystals[J]. Curr Opin Colloid In, 2013, 18(4): 283–291. DOI:10.1016/j.cocis.2013.04.009 |
| [26] | Kaptay G. On the equation of the maximum capillary pressure induced by solid particles to stabilize emulsions and foams and on the emulsion stability diagrams[J]. Colloid Surface A:Physicochem Eng Aspects, 2006, 282(2): 387–401. |
| [27] | Binks B P, Lumsdon S O. Pickering emulsions stabilized by monodisperse latex particles:effects of particle size[J]. Langmuir, 2001, 17(15): 4540–4547. DOI:10.1021/la0103822 |
| [28] | 陈小新, 原素, 谢称石, 等. 葛根素自微乳给药系统的制备及其质量评价[J]. 中草药, 2011, 42(8):1512–1516. |
 2017, Vol. 48
2017, Vol. 48


