2. 重庆市食品药品检验所, 重庆 401121;
3. 成都中医药大学药学院, 四川 成都 610016;
4. 纽约州立大学石溪分校化学学院, 美国 纽约 11794
2. Chongqing Food and Drug Control Research Institute, Chongqing 401121, China;
3. Pharmacy College, Chengdu University of Traditional Chinese Medicine, Chengdu 610016, China;
4. College of Chemistry, Stony Brook University, New York 11794, US
清热灵颗粒(Qingreling Granules,QG)为药典收录的经典品种,为清热解毒常用药,该制剂由甘草、黄芩、连翘、大青叶4味中药组成,具有清热解毒之功效,常用于感冒发热、咽喉肿痛、热邪壅肺证。该制剂收载于《中国药典》2010、2015年版第一部[1-2],目前清热灵颗粒的质量标准仅对黄芩苷做了HPLC定量限度及连翘苷薄层检测进行了要求。该制剂属于刘昌孝院士等[3-4]提出的新概念——“中药质量标志物(Q-Marker)”控制中成药质量的代表制剂。经笔者检索,目前仅有HPLC法同时测定5个成分(黄芩苷、连翘苷、汉黄芩苷、黄芩素和汉黄芩素)的报道[5],距离Q-Marker还有较大差距[3]。在本课题组前期对单味中药的次生代谢快速鉴别的基础上[6-7],拟采用UPLC-Q Exactive四极杆-静电场轨道阱高分辨质谱仪联用技术,负离子监测模式、采用全扫描,建立一种可快速确认清热灵颗粒中多种化学成分的方法,为建立该制剂的Q-Marker系统质控方法奠定基础。
1 仪器与材料 1.1 仪器与设备UPLC-Q Exactive四级杆-静电场轨道阱高分辨质谱,赛默飞世尔科技公司,美国;Ultimate 3000超高效液相色谱系统,美国DIONEX公司;ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),美国Waters公司;ESJ200-4万分之一电子天平,沈阳龙腾电子有限公司;BT25S十万分之一电子天平,赛多利斯科学仪器(北京)有限公司;KQ5200E型超声波清洗器,昆山超声仪器有限公司。
1.2 药品与试剂清热灵颗粒购于正大青春宝药业,批号为1604109。甲醇为色谱纯(美国默克公司),色谱纯甲酸(美国Sigma-Aldrich公司),均为LC-MS级;水为纯净水,美国Milli-Q SP Regent Water System;甲醇为分析纯,质量分数≥99.5%。
2 方法 2.1 供试品溶液的制备取装量差异下的清热灵颗粒,研细,取0.3 g,精密称定,置于25 mL量瓶中,精密加入50%甲醇适量,25 ℃,超声处理(功率500 W,频率40 kHz)30 min,放冷,定容,摇匀,滤过,即得。
2.2 色谱条件与质谱条件 2.2.1 色谱条件色谱柱为ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm);流动相为甲醇-0.1%甲酸水溶液,梯度洗脱条件为0~2 min,5%甲醇;2~10 min,5%~20%甲醇;10~25 min,20%~30%甲醇;25~35 min,30%甲醇;35~40 min,30%~80%甲醇;40~45 min,80%甲醇;45~46 min,80%~5%甲醇;46~50 min,5%甲醇;体积流量为0.3 mL/min;进样室温度10 ℃;柱温35 ℃;进样量2 μL。
2.2.2 质谱条件离子源为HESI源,负离子检测模式,鞘气压力206.84 kPa;辅助气体积流量8 L/min;喷雾电压2.00 kV;离子传输管温度320 ℃;辅助气温度350 ℃;扫描模式:Full MS/dd-MS2,Full MS分辨率70 000,dd-MS2分辨率17 500,扫描范围m/z 80~1 200。MS/MS模式时,所用碰撞能为阶梯能量30 eV和40 eV。
2.3 数据处理使用Xcalibur 3.0软件(赛默飞科技有限公司,美国)进行质谱数据处理,通过高分辨率质谱信息推导其可能的分子式,质谱偏差范围δ≤5×10−6。
使用已报道的数据分析方法[6-8]构建清热灵颗粒的化学成分相关信息数据库,结合化合物的一级、二级质谱及裂解规律进行分析和鉴别。
2.4 与H5N1禽流感病毒神经氨酸酶的对接神经氨酸酶是流感治疗药物的作用靶点之一,是分布于流感病毒被膜上的一种糖蛋白,故本实验选择其为对接蛋白[9-10]。分子对接采用Autodock vina 1.1.2(http://vina.scripps.edu/)软件,受体为H5N1禽流感病毒神经氨酸酶(pdb ID:2HU0),利用AutoDock Tools 1.5.6(http://autodock.scripps.edu/)程序确定靶蛋白的活性口袋,以晶体结构中天然配体为中心的一定范围内的空间定义为活性口袋。活性口袋三维坐标为x:1.830,y:18.656,z:108.293,大小为x:15,y:15,z:15;小分子的三维结构通过Avogadro软件构建并进行能量优化,然后由AutoDock Tools 1.5.6处理生成对接所需的格式。DS Visualizer(http://accelrys.com/)软件用于进行相互作用分析及作图。.
3 结果与分析为了更准确地检测清热灵颗粒中的成分,对样品处理、色谱条件以及质谱条件等进行了优化,并对样品进行分析,在基峰离子流图负离子模式下显示更为丰富的信息,故选择负离子模式分析,基峰离子流图见图 1。通过UPLC-Q Exactive四级杆-静电场轨道阱高分辨质谱分析,共鉴定了39个化学成分,包括黄酮类化合物25个,有机酸4个,苯乙醇苷类6个,三萜类化合物2个,木脂素类2个。被鉴定化合物的保留时间、相对分子质量、一级质谱以及二级质谱碎片离子见表 1。
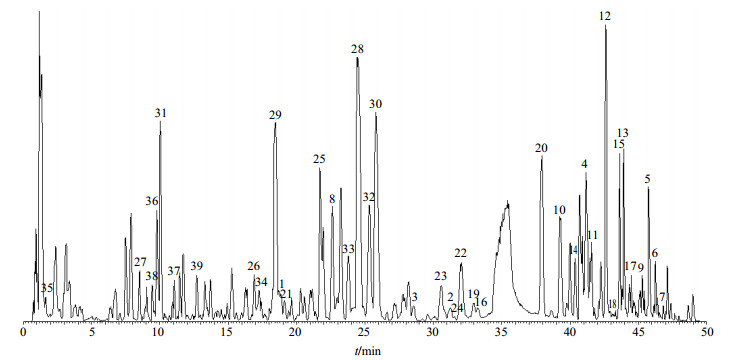
|
图 1 清热灵颗粒的总离子流图(负离子模式,峰号与表 1中所标化合物序号一致) Fig.1 Total ion chromatogram of QG (negative ion mode, peak numbers were same as compound numbers in Table 1) |
|
|
表 1 UPLC-Q Exactive四级杆-静电场轨道阱高分辨质谱对清热灵颗粒中化学成分的鉴定分析 Table 1 Characterization of chemical constituents in QG by UHPLC-quadrupole-orbitrap MS |
1号峰(甘草苷)、2号峰(异甘草苷)、3号峰(甘草素)、4号峰(异甘草苷)为甘草专属成分,10号峰(黄芩苷)、11号峰(汉黄芩苷)、12号峰(黄芩素)、13号峰(汉黄芩素)为黄芩专属成分,20号峰(连翘苷)、28号峰(连翘酯苷A)、29号峰(连翘酯苷H)、30号峰(连翘酯苷I)、31号峰(连翘酯苷E)、32号峰(连翘酯苷B)为连翘专属成分。
3.1 成分鉴别 3.1.1 黄酮类1号峰化合物的鉴别1号峰为黄酮类化合物中的甘草苷,以甘草苷为例对其裂解途径进行探讨。
甘草苷主要的碎片离子为m/z 255.065 03,为甘草苷脱去1分子糖(C6H10O5)产生的碎片离子,同时其也是异甘草苷、甘草素、异甘草素的特征分子离子峰,甘草苷的MS2的碎片离子主要为m/z 135.007 48、119.048 07、91.017 56,其中碎片离子m/z 135.007 48和m/z 119.048 07为甘草苷B环C1-C2和C3-C4键断形成,m/z 91.017 56(C6H3O)为碎片离子A环侧链C-O键和C-C键断裂形成,故鉴定1号化合物为甘草苷。
10号峰化合物黄芩苷的分子离子峰为m/z 445.077 42,特征碎片离子为[M-C6H10O6] m/z 269.045 47。
33号峰化合物芦丁的分子离子峰为m/z 609.147 09,特征碎片离子为m/z 300.027 89,为准分子离子峰脱掉2分子糖后产生的,根据负离子模式下精确相对分子质量和二级质谱碎片信息及与文献报道[13]比较,鉴定33号峰化合物为芦丁。
3.1.2 木脂素类20号峰化合物的鉴别多数木脂素类化合物可得到分子离子峰。发生苄基裂解,产生相应的碎片离子。木脂素苷可失去糖基,20号峰化合物在负离子模式下,结合1分子甲酸,得到m/z 579.208 98的分子离子峰,MS2的主要碎片离子为m/z 369.061 61,即为准分子离子峰脱糖(C6H10O5)、甲酸形成的,结合二级碎片信息以及文献报道[14]比较,鉴定20号峰化合物为连翘苷。
3.1.3 苯乙醇苷类28号峰化合物的鉴别连翘酯苷A、连翘酯苷H、连翘酯苷I为连翘中最明显的同分异构体,具有相似的裂解途径,在负离子模式下三者均具有m/z 623的分子离子峰。28号峰化合物的分子离子峰为m/z 623.023 36,正离子模式与负离子模式出峰时间相同,该化合物在负离子模式下主要的碎片离子有[M-C6H10O4] m/z 477.140 01和[M-C6H10O4-C8H9O2-C6H9O4-H2O] m/z 161.023 36,故鉴定该化合物为连翘酯苷A。根据文献报道[15]以及化合物极性,可以鉴定出29号峰化合物为连翘酯苷I,可以鉴定出30号峰化合物为连翘酯苷H。32号峰化合物连翘酯苷B也有明显的分子离子峰m/z 755.241 39,主要的碎片离子有[M-C5H9O4] m/z 623.198 73、[M-C5H9O4-C6H11O4-C8H8O2-C6H8O6]m/z 161.023 30。31号峰化合物连翘脂苷E在正离子模式下的分子离子峰为m/z 463.180 60,正负离子模式下,出峰时间相同。
3.1.4 有机酸类37号峰化合物的鉴别35、36、37、38号峰分别为丁二酸、咖啡酸、绿原酸[16-17]、隐绿原酸。在负离子模式下,37号峰化合物的裂解方式为分子离子峰为m/z 353.090 00,六元环3位的酯键断裂后形成m/z 191.019 08的碎片离子峰,继续脱去1分子H2O形成m/z 173.044 69的碎片离子峰,继续脱去1分子H2O形成m/z 154.973 13的碎片离子峰。
3.1.5 三萜类5号峰化合物的鉴别5、6号峰分别18β-甘草酸、18α-甘草酸,通常情况下甘草酸指的是18β-甘草酸。在负离子模式下,甘草酸的裂解方式为分子离子峰为m/z 821.397 77,主要的碎片离子有[M-C6H9O6-2H] m/z 644.335 21和[M-C40H42O4-2H] m/z 351.217 80,根据文献报道[18]鉴定甘草酸先出峰。
3.2 与神经氨酸酶的对接结果11个专属性成分均与神经氨酸酶具有较好的亲和力,其对接强弱顺序为汉黄芩苷(化合物11)、黄芩苷(化合物10)、连翘酯苷A(化合物28)、甘草苷(化合物1)、连翘酯苷E(化合物31)、连翘酯苷B(化合物32)、异甘草苷(化合物2)、黄芩素(化合物12)、连翘苷(化合物20)、汉黄芩素(化合物13)和甘草素(化合物3)。图 2展示了汉黄芩苷(化合物11)、连翘酯苷A(化合物28)和甘草苷(化合物1)这3种亲和力较强的专属性成分与神经氨酸酶的结合模式图。
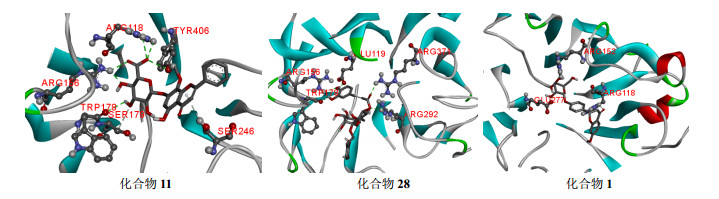
|
图 2 化合物11、28和1与神经氨酸酶的预测结合模式 Fig.2 Predicted binding mode of compounds 11, 28, and 1 with neuraminidase |
4 讨论与展望
本实验通过建立清热灵颗粒成分数据库、检索公共数据库,使用UPLC-Q Exactive四级杆-静电场轨道阱联用方法,快速鉴定39种成分。在这39种化合物中包括黄酮类化合物25个,有机酸4个,苯乙醇苷类6个,三萜类化合物2个,木脂素类2个,其中除黄芩苷、连翘苷、汉黄芩苷、黄芩素、汉黄芩素和甘草酸有报道进行鉴别外,其他32个化学成分均为首次在清热灵颗粒中被鉴定出,其中能代表清热灵颗粒制剂的专属性成分共有11个。中药是多成分复杂体系,有活性成分、辅助成分、无效成分,还有专属性成分、普通成分[3],同时受到品种、产地、栽培、采收加工、炮制、贮运影响;而中成药经过炮制加工,提取初级代谢产物,也有次级代谢产物,同样也有活性成分、辅助成分、无效成分、专属性成分和普通成分,在中成药生产过程中亦受到提取纯化、制剂成型、贮运等方面的影响;临床上使用中成药与人体代谢环境及各成分间交互作用[3],在过去由于仪器分析技术和统计模型方法的制约,很少进行中药海量数据多元的追踪和分析,客观上导致中成药标准难以代表中成药质量[3-5]。
现代研究表明,在该制剂中,甘草中的甘草苷、异甘草苷、异甘草素、甘草素等具有清热解毒、祛痰止咳作用[19],异甘草苷可以透过细胞膜从而破坏细胞膜完整性起到抗真菌的效果[20];异甘草素还具有增强免疫的活性[21],可以抑制乳癌细胞的迁移;另外,甘草素能效降低促炎性细胞因子的表达,在抗炎的同时还具有神经保护特性,在抗抑郁方面也表现出较好的活性[22],同时研究表明甘草素的肠吸收及血脑屏障通透性好[23],这也是“性-效-物”关联研究的体现。黄芩中的黄芩苷、汉黄芩苷、汉黄芩素、黄芩素具有抗炎作用[24],黄芩苷、汉黄芩苷的肠道通透性也较好[25],除此之外,汉黄芩苷还具有抑制肿瘤血管生成的作用[26];汉黄芩素除抗炎外,还具抑制肿瘤细胞增殖的作用[27];黄芩素还可以减少脑组织含水量、血脑屏障渗漏、神经细胞凋亡、神经功能缺损,对脑出血模型大鼠血脑屏障的保护作用[28]。连翘中的连翘苷、连翘酯苷A、连翘酯苷H、连翘酯苷I、连翘酯苷E、连翘酯苷B等[29]及大青叶中绿原酸等也均具有抗菌、抗病毒等相关活性[30],其中连翘酯苷A通过抑制炎症因子TNF-α、IL-1β、NO和PGE2的产生来实现其抗炎作用[31],连翘酯苷A在P-gp及CYP3A酶的底物的作用下产生的被动吸收,其在十二指肠、空肠、回肠、结肠段的吸收未发生明显变化[32],也可说明该物质的“性-效-物”的关联关系;连翘酯苷B抗菌、抗炎作用还表现在可抑制肺炎克雷伯菌外排泵的活性,从而抗肺炎的作用[33],这也是次级代谢产物发挥作用活性的体现。
根据清热灵颗粒功能主治、专属成分的活性进行评价、活性成分的可测性和与H5N1禽流感病毒神经氨酸酶的对接结果,确定11个专属性成分可作为质量标志物,且选择顺序为汉黄芩苷(化合物11)、黄芩苷(化合物10)、连翘酯苷A(化合物28)、甘草苷(化合物1)、连翘酯苷E(化合物31)、连翘酯苷B(化合物32)、异甘草苷(化合物2)、黄芩素(化合物12)、连翘苷(化合物20)、汉黄芩素(化合物13)和甘草素(化合物3),供《中国药典》提高清热灵颗粒标准参考。
本课题组后续将继续清热灵颗粒剂“性-效-物”的研究,对分析出这11个Q-Marker进一步定量分析,通过清热灵作用相关典型靶标蛋白结合的活性虚筛和蛋白互作,结合代谢组学探讨清热灵质控方法[3, 5]。因此,对中药的复杂体系的快速确定,是Q-Marker研究的第一阶段,直接影响后续研究的可行性和可靠性。
近年来,中药分析研究使用了多种高分辨液质联用技术,如UPLC-Q-TOF MS、UPLC-Q-TOF MS-NMR、UPLC-Q Exactive MS技术等[34-36],通过建立模型专属化学成分库的方法可以快速确认成分。本实验在完成中药复杂体系的成分快速指认方面做出探索,为进一步进行清热灵颗粒Q-Marker的研究奠定基础。
| [1] | 中国药典[S].一部.2010. |
| [2] | 中国药典[S].一部.2015. |
| [3] | 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker):中药产品质量控制的新概念[J]. 中草药, 2016, 47(9):1443–1457. |
| [4] | 熊亮, 彭成. 基于中药质量标志物(Q-Marker)的基本条件研究益母草和赶黄草的Q-Marker[J]. 中草药, 2016, 47(13):2212–2220. |
| [5] | 张铁军, 许浚, 申秀萍, 等. 基于中药质量标志物(Q-Marker)的元胡止痛滴丸的"性-效-物"三元关系和作用机制研究[J]. 中草药, 2016, 47(13):2199–2211. |
| [6] | 徐金钟, 邢丽红, 王书芳, 等. HPLC-UV定量分析清热灵颗粒中的5个成分[J]. 中国药学杂志, 2010, 45(2):147–149. |
| [7] | Li J H, Kuang G, Chen X H, et al. Identification of chemical composition of leaves and flowers from Paeonia rockii by UHPLC-Q-Exactive Orbitrap HRMS[J]. Molecules, 2016, 21(7): 947–952. DOI:10.3390/molecules21070947 |
| [8] | 董红娇, 陈晓虎, 曾锐. UPLC-Q-Exactive四级杆-静电场轨道阱高分辨液质联用快速分析民族药小大黄的化学成分[J]. 中草药, 2016, 47(14):2428–2435. |
| [9] | Muthuri S G, Venkatesan S, Myles P R, et al. Effectiveness of neuraminidase inhibitors in reducing mortality in patients admitted to hospital with influenza A H1N1pdm09 virus infection:a meta-analysis of individual participant data[J]. Lancet Respir Med, 2014, 2(5): 395–404. DOI:10.1016/S2213-2600(14)70041-4 |
| [10] | 池絮影, 傅咏梅, 崔曰新, 等. 板蓝根化学成分与抗流感病毒神经氨酸酶活性相关性的探讨[J]. 中草药, 2016, 47(22):3982–3989. |
| [11] | Liu G, Qiao S, Liu T, et al. Simultaneous determination of 18 chemical constituents in traditional Chinese medicine of antitussive by UPLC-MS-MS[J]. J Chromatogr Sci, 2016: 1540–1552. |
| [12] | Fong S Y K, Yin C W, Zhong Z. Development of a SPE-LC/MS/MS method for simultaneous quantification of baicalein, wogonin, oroxylin A and their glucuronides baicalin, wogonoside and oroxyloside in rats and its application to brain uptake and plasma pharmacokinetic studies[J]. J Pharmaceutic Biomed, 2014, 97: 9–23. DOI:10.1016/j.jpba.2014.03.033 |
| [13] | 罗玲, 黄玉婵, 黄琴, 等. UPLC-MS-MS同时测定双黄连粉针中7种活性成分[J]. 中国实验方剂学杂志, 2014, 20(13):80–84. |
| [14] | 张晨曦, 刘素香, 赵艳敏, 等. 基于液质联用技术的连翘化学成分分析[J]. 中草药, 2016, 47(12):2053–2060. |
| [15] | 季宇彬, 姜薇, 范玉玲, 等. 甘草黄酮的研究进展[J]. 中草药, 2004, 35(9):附5–附6. |
| [16] | 罗彬, 张进忠. 连翘提取物化学成分研究[J]. 中国实验方剂学杂志, 2013, 19(3):143–146. |
| [17] | 王福男.中药连翘的化学成分研究[D].北京:中国协和医科大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10023-2010041191.htm |
| [18] | 白洁, 王冬梅, 杨得坡. 长萼小连翘醇提物中黄酮类与金丝桃素类成分的HPLC/DAD-MS联用分析[J]. 分析测试学报, 2008, 27(2):185–187. |
| [19] | 丁楠, 高晓黎. 18α-甘草酸和18β-甘草酸差向异构体的比较研究概况[J]. 中国现代应用药学, 2011, 28(13):1312–1315. |
| [20] | Luo J, Li Z, Wang J, et al. Antifungal activity of isoliquiritin and its inhibitory effect against Peronophythora litchi Chen through a membrane damage mechanism[J]. Molecules, 2016, 21(2): 237–248. DOI:10.3390/molecules21020237 |
| [21] | Wang K L, Hsia S M, Chan C J, et al. Inhibitory effects of isoliquiritigenin on the migration and invasion of human breast cancer cells[J]. Expert Opin Ther Tar, 2013, 17(4): 337–349. DOI:10.1517/14728222.2013.756869 |
| [22] | Su Q, Tao W, Huang H, et al. Protective effect of liquiritigenin on depressive-like behavior in mice after lipopolysaccharide administration[J]. Psychiat Res, 2016, 240: 131–136. DOI:10.1016/j.psychres.2016.04.002 |
| [23] | 吕鹏, 卞广兴, 温利青, 等. 甘草素在体肠吸收及体外血脑屏障通透性研究[J]. 中国新药杂志, 2008, 17(8):661–666. |
| [24] | Cai W, Fu Y, Zhang W, et al. Synergistic effects of baicalein with cefotaxime against Klebsiella pneumoniae, through inhibiting CTX-M-1 gene expression[J]. BMC Microbiol, 2016, 16(1): 181–190. DOI:10.1186/s12866-016-0797-1 |
| [25] | Cai Y, Li S, Li T, et al. Oral pharmacokinetics of baicalin, wogonoside, oroxylin A7-O-β-d-glucuronide and their aglycones from an aqueous extract of Scutellariae Radix in the rat[J]. J Chromatogr B, 2016, 1026: 124–133. DOI:10.1016/j.jchromb.2015.11.049 |
| [26] | Huang Y, Zhao K, Hu Y, et al. Wogonoside inhibits angiogenesis in breast cancer via suppressing Wnt/β-catenin pathway[J]. Mol Carcinogen, 2015, 55(11): 1598–1612. |
| [27] | Yang L, Wang Q, Li D, et al. Wogonin enhances antitumor activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo through ROS-mediated downregulation of cFLIPL and IAP proteins[J]. Apoptosis, 2013, 18(5): 618–626. DOI:10.1007/s10495-013-0808-8 |
| [28] | Chen M, Lai L F, Li X F, et al. Baicalein attenuates neurological deficits and preserves blood-brain barrier integrity in a rat model of intracerebral hemorrhage[J]. Neurochem Res, 2016, 41(11): 3095–3102. DOI:10.1007/s11064-016-2032-8 |
| [29] | Su W, Xu H, Huang H. Effects of the extract of Forsythia suspensa on influenza A H1N1 infection in vitro[J]. J Med Plants Res, 2010, 4(14): 1468–1471. |
| [30] | Nakamura N, Hayasaka S, Zhang X Y, et al. Effects of baicalin, baicalein, and wogonin on interleukin-6 and interleukin-8 expression, and nuclear factor-kappab binding activities induced by interleukin-1beta in human retinal pigment epithelial cell line[J]. Exp Eye Res, 2003, 77(2): 195–202. DOI:10.1016/S0014-4835(03)00116-7 |
| [31] | Wang Y, Zhao H, Lin C, et al. Forsythiaside a exhibits anti-inflammatory effects in LPS-stimulated BV2 microglia cells through activation of Nrf2/HO-1 signaling pathway[J]. Neurochem Res, 2016, 41(4): 1–7. |
| [32] | 周伟, 狄留庆, 毕肖林, 等. 在体肠循环法研究连翘酯苷A的肠吸收机制[J]. 药学学报, 2010, 45(11):1373–1378. |
| [33] | 钟海琴, 张顺, 蔡挺. 连翘酯苷B对肺炎克雷伯菌外排泵活性的影响[J]. 中国新药与临床杂志, 2013, 32(4):303–306. |
| [34] | 谭乐俊, 王萌, 任晓亮, 等. 基于UPLC-Q/TOF-MS的中药水蜜丸制剂二至丸多成分稳定性研究[J]. 中草药, 2016, 47(13):2260–2268. |
| [35] | Zhang H B, Zhang T J, Xu J, et al. Rapid analysis and identification of absorbed components and their metabolites of Yuanhu Zhitong Dropping Pill in rat plasma and brain tissue using UPLC-Q-TOF/MS with multivariate statistical analysis[J]. Chin Herb Med, 2016, 8(2): 154–163. DOI:10.1016/S1674-6384(16)60025-4 |
| [36] | 丁晓萍, 费毅琴, 肖凌, 等. 珍珠明目滴眼液及珍珠液中蛋白多肽类成分的分析[J]. 中草药, 2016, 47(6):911–916. |
 2017, Vol. 48
2017, Vol. 48


