2. 新疆特色药食用植物资源化学实验室, 新疆喀什 844006
2. Xinjiang Laboratory of Native Medicinal and Edible Plant Resources Chemistry, Kashgar 844006, China
昆仑雪菊(Kunlun snow daisy),学名蛇目菊,别名两色金鸡菊Coreopsis tinctoria Nutt.,维吾尔语“古丽恰尔”[1, 2],是在新疆维吾尔药物中能与天山雪莲齐名并具有较高药用价值和独特功效的高寒野生植物。通过长期临床试验表明,长期冲泡饮用对糖尿病、高血压、高血脂以及冠心病患者有较显著的效果[3, 4]。除此之外昆仑雪菊还具有减肥养颜、抗菌消炎、营养心肌、改善睡眠质量等功效[5]。目前为止对昆仑雪菊有效成分分离提取的研究较多[6, 7, 8, 9, 10],富含黄酮类化合物[11, 12, 13, 14, 15, 16, 17, 18]。现有研究证实,绿原酸及槲皮素、芦丁、木犀草素等黄酮类物质及其与糖结合形成的苷是昆仑雪菊花对心血管疾病及糖尿病等慢性疾病具有预防与保护作用的主要活性成分[19]。买买提•艾买提等[20]和赵文惠等[21]利用RP-HPLC法对昆仑雪菊中木犀草素和绿原酸的量进行了测定。袁辉等[22]利用HPLC法测定昆仑雪菊中绿原酸和黄芩苷的量。但是尚未见用HPLC法同时分离测定昆仑雪菊中绿原酸、芦丁、槲皮素和木犀草素量的相关文献报道。本实验以不同批次昆仑雪菊研究对象,建立HPLC-二极管阵列法同时测定昆仑雪菊中绿原酸、芦丁、槲皮素和木犀草素量的方法,以期为昆仑雪菊药材的质量控制和药理作用研究及新疆特色资源的充分开发利用提供科学依据。
1 材料 1.1 材料与试剂槲皮素对照品(批号 100081,中国食品药品检定研究院);芦丁对照品(批号0080-9705,中国食品药品检定研究院);绿原酸(质量分数≥98%)、木犀草素(质量分数≥98%)对照品均购自Aladdin Chemistry Co. Ltd.;甲醇、乙腈为色谱纯,水为高纯水,其他试剂均为分析纯。昆仑雪菊分4批(I~IV)采购于喀什东巴扎茶叶街,经喀什大学生物与地理科学系司马义教授鉴定为菊科(Asteraceae)金鸡菊属Coreopsis Linn. 多年生草本植物两色金鸡菊Coreopsis tinctoria Nutt. 的头状花序。
1.2 仪器与设备岛津LC-20AT高效液相色谱仪(配有SPD-M20A二极管阵列检测器,DGU-20A5在线脱气机,LC-solution工作站);KQ3200DE型超声波清洗器(昆山市超声仪器有限公司);XA-1型多功能粉碎机(江苏姜堰市分析仪器厂);ZK-82B真空干燥箱(上海市实验仪器总厂);赛多利斯BS224S型电子天平(德国)。
2 方法与结果 2.1 对照品溶液的制备准确称取绿原酸、芦丁、槲皮素和木犀草素对照品各5.0 mg于25 mL量瓶中,用甲醇完全溶解,稀释并定容至刻度,摇匀,得200 μg/mL各对照品储备液。分别准确吸取不同体积绿原酸、芦丁、槲皮素和木犀草素对照品储备液于7个10 mL量瓶中,用甲醇稀释至刻度,摇匀,即得到7组混合对照品溶液,在冰箱里保存(6 ℃)。7组混合对照品溶液中绿原酸、芦丁、槲皮素和木犀草素的质量浓度见表 1。
| 表 1 混合对照品溶液中绿原酸、芦丁、槲皮素和木犀草素的质量浓度 Table 1 Concentration of chlorogenic acid,rutin,quercetin,and luteolin in mixed reference solution |
准确称取干燥、粉碎、过筛(60目)的昆仑雪菊粉末1.0 g,加75%甲醇(25 mL),浸泡1 h,超声提取20 min,抽滤除渣,55 ℃减压浓缩滤液至干,放置室温,用甲醇定容至25 mL,摇匀,用0.45 μm微孔滤膜滤过,滤液置于冰箱备用。
2.3 色谱条件色谱柱:安捷伦HC-C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.01%磷酸水溶液(B),梯度洗脱,洗脱程序见表 2;体积流量1.0 mL/min;检测波长315 nm;柱温30 ℃;进样量10 μL。
| 表 2 洗脱程序 Table 2 Elution procedure |
分别吸取7组混合对照品溶液20 μL进样,按照“2.3”项下色谱条件测定其峰面积。每组重复6次,以对照品在混合溶液中的质量浓度(C)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,实验结果表明峰面积与质量浓度呈良好的线性关系。得到的线性回归方程、相关系数、线性范围见表 3。
| 表 3 回归方程、相关系数、线性范围 Table 3 Linear regression equation,correlation coefficient,and linear range |
混合对照品溶液,按“2.3”项色谱条件下连续进样5次,测定绿原酸、芦丁、槲皮素和木犀草素峰面积的RSD分别为1.02%、0.95%、0.85%、1.38%和1.52%,表明仪器精密度良好。精密称取同一昆仑雪菊样品5份,每份约1.0 g,按“2.2”项方法制备供试品溶液,按上述色谱条件进行测定,计算样品中绿原酸、芦丁、槲皮素和木犀草素质量分数的RSD分别为1.14%、0.85%、1.37%和1.62%,实验结果表明重复性良好。
2.6 稳定性试验精密吸取同一样品溶液,分别放置0、3、6、9、12 h后,按“2.2”项色谱条件下进样检测。计算绿原酸、芦丁、槲皮素和木犀草素峰面积的RSD分别为0.96%、1.52%、1.41%和1.06%。结果表明样品溶液在12 h内稳定性良好。
2.7 加样回收率试验准确称取已测定的昆仑雪菊样品Ⅰ粉末5份,每份0.5 g,分别精密加入不同量的绿原酸、芦丁、槲皮素和木犀草素对照品溶液,按“2.2”项方法制备加标样品溶液,按上述色谱条件进行测定,以外标法计算回收率。结果绿原酸、芦丁、槲皮素和木犀草素平均回收率分别为102.4%、98.6%、103.5%、101.2%,RSD分别为1.05%、1.28%、0.95%、1.12%。
2.8 样品测定分精密吸取按“2.2”项下方法制备的昆仑雪菊供试品溶液10 μL,注入高效液相色谱仪,按“2.3”项色谱条件下进行测定。混合对照品和样品的HPLC色谱图见图 1,记录绿原酸、芦丁、槲皮素和木犀草素面积积分值,代入回归方程计算,测定结果见表 4。
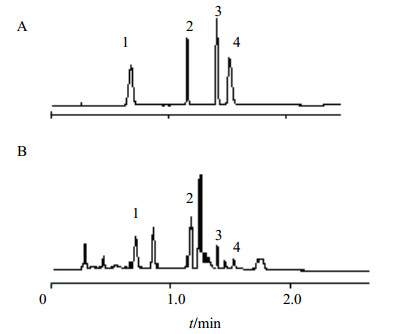 |
1-绿原酸 2-芦丁 3-槲皮素 4-木犀草素 1-chlorogenic acid 2-rutin 3-quercetin 4-luteolin 图 1 混合对照品(A)和供试品(B)溶液的色谱图 Fig.1 Chromatograms of mixed reference substances (A) and samples (B) |
| 表 4 样品中绿原酸、芦丁、槲皮素和木犀草素的测定结果 Table 4 Determination of chlorogenic acid,rutin,quercetin,and luteolin |
利用二极管阵列检测器能够在一次运行中同时采集200、254、280、315、327、360 nm波长色谱图的特点,结合文献报道[23, 24],芦丁和槲皮素在315 nm波长下色谱峰的峰形对称,达到定量分析要求,因此,可以确定315 nm作为检测波长。
3.2 流动相的选择根据文献[25, 26]考察了不同比例的甲醇-乙酸,甲醇-0.1%磷酸水溶液,甲醇-0.01%磷酸水溶液,乙腈-磷酸水溶液为流动相,分别做等度洗脱或梯度洗脱,观察样品中各个有效成分的分离情况,当甲醇-0.01%磷酸水溶液作为流动相,梯度洗脱时,绿原酸、芦丁、槲皮素和木犀草素峰形良好能达到基线分离,并且与其他杂质峰得到了良好的分离,峰形良好。因此,用甲醇-0.01%磷酸水溶液梯度洗脱分离绿原酸、芦丁、槲皮素和木犀草素。
3.3 提取溶剂及提取法的选择以不同浓度甲醇为提取溶剂考察了回流法、索氏提取法、浸提法、超声波法、解析法的不同方法的提取效果。结果显示,用75%甲醇超声提取20 min,浸泡1 h,再超声波提取20 min的方法,对绿原酸、芦丁、槲皮素和木犀草素的提取率最高,而且超声提取具有操作简单易行、能耗较低、快速高效、不破坏有效成分的特点。故选择75%甲醇超声提取20 min,浸泡1 h,再超声提取20 min作为昆仑雪菊中有效成分的提取方法。
昆仑雪菊以其高的观赏价值和奇妙的药用价值而备受青睐。昆仑雪菊资源丰富,开发利用前景光明。该方法简便快速、准确可靠、重现、精密度、稳定性、回收率都较好,是一种较好的测定方法。适用于同时测定昆仑雪菊中芦丁和槲皮素。为昆仑雪菊资源的深度开发利用、药用价值研究以及质量评价提供了科学依据。
| [1] | 新疆植物志编辑委员会. 新疆植物志(第5卷)[M]. 乌鲁木齐:新疆科技卫生出版社, 1999. |
| [2] | 木合布力·阿布力孜, 张燕, 景兆均, 等. 新疆昆仑雪菊化学成分的初步定性研究[J]. 新疆医科大学学报, 2010, 33(6):628-630. |
| [3] | 姜保平, 许利嘉, 贾晓光, 等. 两色金鸡菊的化学成分和药理作用研究进展[J]. 现代药物与临床, 2014, 29(5):567-573. |
| [4] | 胡正梅, 马清河. 昆仑雪菊的研究进展[J]. 新疆中医药, 2014, 32(6):76-78. |
| [5] | 过利敏, 张平, 张谦, 等. 雪菊化学成分分析、提取、及其物活性研究进展[J]. 食品科学, 2014, 35(7):298-304. |
| [6] | 古丽江·马合苏提汗, 李新霞, 李彬彬, 等. 气相色谱法测定新疆昆仑雪菊挥发油中柠檬烯的含量[J]. 中国医药导报, 2014, 11(17):96-99. |
| [7] | 沈维治, 邹宇晓, 刘凡, 等. 雪菊与市售菊花活性成分的比较研究[J]. 热带作物学报, 2012, 33(12):2284-2287. |
| [8] | 沈维治, 邹宇晓, 刘凡, 等. 顶空固相微萃取气质联用分析比较雪菊与市售菊花的挥发性成分[J]. 热带作物学报, 2013, 34(4):771-776. |
| [9] | 符继红, 史岷山. 新疆昆仑雪菊中微量元素的测定及溶出性研究[J]. 食品科技, 2013, 38(10):297-300. |
| [10] | 张彦丽, 阿布都热合曼·合力力, 阿依吐伦·斯马义. 苯酚-硫酸法测定维吾尔药昆仑雪菊多糖含量的研究[J]. 药物分析杂志, 2010, 30(11):2205-2207. |
| [11] | 张彦丽, 韩艳春, 阿依吐伦·斯马义. 分光光度法测定维吾尔药昆仑雪菊中总皂苷的含量[J]. 西北药学杂志, 2011, 26(2):87-88. |
| [12] | 孙自增, 毕肯·阿不都克力木, 张彦丽, 等. 不同产地雪菊化学成分含量测定及模式识别研究[J]. 中国实验方剂学杂志, 2012, 18(24):174-178. |
| [13] | 吴瑛, 王秀芳, 袁守亮. 响应面分析昆仑雪菊水溶性黄酮类化合物的提取工艺[J]. 食品科学, 2013, 34(6):129-133. |
| [14] | 阿不都哈力力·艾力, 西力扎提·阿布来提, 古海妮萨·麦合木提, 等. 超声微波协同萃取维药雪菊中总黄酮工艺研究[J]. 广州化工, 2013, 41(7):75-77. |
| [15] | 古扎力努尔·艾尔肯, 李新霞, 毛新民, 等. 新疆两色金鸡菊中绿原酸与总黄酮含量测定及指纹图谱的建立[J]. 西北药学杂志, 2013, 28(3):248-251. |
| [16] | 景玉霞, 兰卫. 不同产地昆仑雪菊总黄酮含量测定[J]. 新疆中医药, 2012, 30(5):62-64. |
| [17] | 张彦丽, 茹鲜古丽·哈斯木, 丁海燕, 等. 超声-微波协同萃取法提取昆仑雪菊中总黄酮的研究[J]. 广州化工, 2011, 39(21):57-59. |
| [18] | 买买提·艾买提, 木合布力·阿布力孜, 孟磊. 新疆昆仑雪菊水溶性总黄酮的含量测定[J]. 海峡药学, 2010, 22(10):56-58. |
| [19] | 王艳, 张彦丽, 阿依吐伦·斯马义. 分光光度法测定新疆昆仑雪菊中总黄酮的含量[J]. 新疆医科大学学报, 2011, 34(8):817-819. |
| [20] | 买买提·艾买提, 赵文惠, 木合布力·阿布力孜, 等. 反相高效液相色谱法测定昆仑雪菊中绿原酸的含量[J]. 新疆医科大学学报, 2011, 34(12):1370-1372. |
| [21] | 赵文惠, 朱雅琪, 李新霞. 反相高效液相色谱法测定昆仑雪菊中木犀草素的含量[J]. 新疆医科大学学报, 2014, 37(5):567-560. |
| [22] | 袁辉, 赵建勇, 杨文菊. 新疆不同产地雪菊UPLC指纹图谱的建立及其成分测定[J]. 中草药, 2015, 46(8):1223-1226. |
| [23] | 中华人民共和国卫生部药品标准维吾尔分册[S]. 1999. |
| [24] | 中国药典[S]. 一部. 2010. |
| [25] | 宾婕, 刘洁, 张春勇, 等. 正交设计优选苦荞中芦丁和槲皮素的提取工艺研究[J]. 现代食品科技, 2011, 27(4):437-439. |
| [26] | 黄菊, 翟淑敏. 正交设计和响应面法优化荞麦中芦丁提取工艺的比较[J]. 粮食与油脂, 2014, 27(9):45-48. |
 2016, Vol. 47
2016, Vol. 47



