远端缺血、神经损伤、局部感染是糖尿病足溃疡发病的主要原因,而创面微血管形成障碍和功能丧失,被认为是糖尿病溃疡创面难以愈合的主要因素[1, 2, 3]。目前糖尿病足的主要治疗方法有改善血液循环、控制感染、清创术、截肢等[4]。但是经治疗后,糖尿病足溃疡创面仍然难以愈合。近年来在标准治疗的基础上加用中医药辅助治疗能够明显促进创面愈合、减少瘢痕形成,并可提高愈合质量[5]。托里消毒散出自明代陈实功所著《外科正宗》,由生黄芪、党参、当归、金银花、连翘、白术、茯苓、赤芍、皂角刺、白芷、生甘草组成,是透托法的主要代表方剂,在中医外科临床上发挥着重要作用[6],托里消毒散方中黄芪、当归流通气血,防止毒邪内陷,是托法的代表方药;皂角刺善通经活血、消肿溃脓,白芷透脓而载毒外泄,是透法的代表方药。因此本研究采用托里消毒散精简方(黄芪、当归、白芷、皂角刺)及其拆方托法(黄芪、当归)、透法(白芷、皂角刺)为受试药物,观察各组方对糖尿病皮肤溃疡大鼠创面愈合的作用,并探讨其相关机制。
1 材料 1.1 动物健康雄性SD大鼠,SPF级,10周龄,体质量(300±20)g,购自北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2009-0004。
1.2 药物与试剂托里消毒散简方药材(当归、黄芪、白芷、皂角刺)购于天津天士力制药股份有限公司,药材样品经天津中医药大学李天祥教授鉴定,结果分别为伞形科植物当归Angelica sinensis ( Oliv. ) Diels 的干燥根、豆科植物蒙古黄芪Astragalus membranaceus ( Fisch. ) Bge. var. mongholicus ( Bge. ) Hsiao 的干燥根、伞形科植物白芷Angelica dahurica ( Fisch. ex Hoffm. ) Benth. et Hook. f. 的干燥根、豆科植物皂荚Gleditsia sinensis Lam. 的干燥棘刺。链脲佐菌素(STZ),美国Sigma公司;山羊抗人血管生成素1(Ang-1)一抗、山羊抗人血管生成素2(Ang-2)一抗、兔抗人血管生成素受体2(Tie-2)一抗(Santa Cruz公司);GAPDH鼠单克隆抗体(天津三箭生物技术有限公司);辣根酶标记山羊抗兔IgG(H+L)、辣根酶标记山羊抗鼠IgG(H+L)(天津三箭生物技术有限公司);辣根酶标记兔抗山羊IgG(H+L,北京中杉金桥生物技术有限公司)。
1.3 仪器卓越纤巧型血糖仪及试纸,罗氏诊断产品有限公司;3K30型高速台式冷冻离心机,美国Sigma公司;BioTek Synergy2多功能酶标仪,美国Bio-TeK公司;Bio-Rad电泳仪,美国Bio-Rad公司;Syngene G BOX凝胶成像系统,英国Syngene公司。
2 方法 2.1 中药浸膏的制备全方及拆方按药物配伍比例采用醇提取浓缩法制备中药浸膏。称取当归255 g、黄芪255 g、白芷204 g、皂角刺204 g,粉碎,加入70%乙醇回流提取2次,每次乙醇用量分别为10、8倍量,每次各提取1.5 h,药液滤过合并,减压回收乙醇,得到全方组的浸膏,生药质量浓度为0.267 g/mL。称取当归255 g、黄芪255 g,粉碎,加入70%乙醇回流提取2次,每次乙醇用量分别为10、8倍量,每次各提取1.5 h,药液滤过合并,减压回收乙醇,得到托法组的浸膏,生药质量浓度为0.232 g/mL。称取白芷500 g、皂角刺500 g,粉碎,加入70%乙醇回流提取2次,每次乙醇用量分别为10倍量、8倍量,每次各提取1.5 h,药液滤过合并,减压回收乙醇,得到透法组的浸膏,生药质量浓度为0.178 g/mL。
2.2 模型制备及分组健康雄性SD大鼠200只,适应性喂养7 d后随机分为2组,对照组40只,糖尿病组160只。糖尿病组大鼠尾iv给予50 mg/kg STZ制备糖尿病模型,随机血糖≥16.7 mmol/L为糖尿病模型诱导成功,死亡及未成模的大鼠予以剔除。常规饲料喂养1周后苯巴比妥麻醉,利用直径1 cm打孔器在背部皮肤上打孔2个,制备皮肤溃疡动物模型。将成模的糖尿病大鼠随机分为4组:模型组、托里消毒散精简方(全方)组、托法组、透法组。
2.3 给药及取材全方组大鼠ig给予全方浸膏2 mL,相当于生药(当归1.5 g/kg、黄芪1.5 g/kg、白芷1.2 g/kg、皂角刺1.2 g/kg),托法组大鼠ig给予托法浸膏2 mL(相当于生药当归1.5 g/kg、黄芪1.5 g/kg),透法组大鼠ig给予透法浸膏2 mL(相当于生药白芷1.2 g/kg、皂角刺1.2 g/kg),各组给药体积约2 mL,对照组和模型组大鼠ig给予等量生理盐水,各组每天给药1次,连续给药14 d。分别于创伤5、8、11、14 d观察创面溃疡愈合状态,计算创面愈合率。取与造模时溃疡面积、大小相同的溃疡组织,使用直径1 cm的皮肤打孔器取材,备用。
创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积
2.4 组织病理学检查将已固定的溃疡组织标本分别经梯度浓度乙醇脱水,二甲苯透明,浸蜡,包埋,切片(约5 μm厚)。脱蜡至水,进行HE染色、免疫组织化学法染色,观察各组肉芽组织生成情况及相关因子定位表达情况。
2.5 Western blotting法检测创面组织Tie-2、Ang-1、Ang-2蛋白表达创面组织称质量,加入适量含蛋白酶抑制剂的RIPA裂解液(蛋白酶抑制剂-RIPA裂解液1:100)裂解组织,提取总蛋白,BCA法测蛋白浓度,蛋白变性,12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿法转膜法将蛋白转移至PVDF膜上,经5%脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜;TBST漂洗后加入辣根过氧化物酶标记二抗,室温孵育1 h;TBST漂洗后ECL化学发光,显影,定影。以GAPDH作为内参蛋白,目的蛋白与GAPDH的灰度比值作为蛋白的相对表达丰度,进行半定量分析。
2.6 统计学方法数据均采用SPSS 18.0统计软件进行分析,计量资料以x±s表示;两样本均数间的比较采用t检验;多个样本均数间的比较采用单因素方差分析(One-way ANOVA LSD法)。
3 结果 3.1 造模情况注射STZ后第3、5、7天,分别尾静脉取血测定大鼠随机血糖,血糖值2次或2次以上≥16.7 mmol/L,则判定糖尿病造模成功。实验中共160只大鼠注射STZ,有4只大鼠注射后死亡,8只大鼠未达到糖尿病成模标准,剔除实验,糖尿病成模率为92.5%(148/160)。148只糖尿病大鼠平均分配到糖尿病各干预组,每组37只大鼠。
制作皮肤创伤模型时,大鼠由于麻醉意外及糖尿病急性并发症、应激能力下降等情况,在手术后至实验终点,对照组死亡1只大鼠,糖尿病组死亡5只大鼠,托法组死亡3只大鼠,透法组死亡4只大鼠,全方组死亡3只大鼠。创伤后各时间点取材时的情况为:创伤后5天取材时,对照组9只,糖尿病组9只,托法组9只,透法组8只,全方组7只;创伤后8天取材时,对照组10只,糖尿病组8只,托法组8只,透法组8只,全方组10只;创伤后11天取材时,对照组10只,糖尿病组8只,托法组8只,透法组8只,全方组9只;创伤后14天取材时,对照组10只,糖尿病组7只,托法组9只,透法组9只,全方组8只。
3.2 各组大鼠创面愈合情况创伤后5、8、11、14 d,糖尿病各组愈合率均低于对照组(P<0.05)。创伤后5 d,透法组愈合率高于模型组、托法组和全方组(P<0.05),全方组和托法组与模型组比较无统计学差异。创伤后8、11、14 d,各给药组愈合率均明显高于模型组(P<0.05)。创伤后8 d,全方组愈合率明显高于托法组和透法组(P<0.05),透法组高于托法组(P<0.05)。创伤后11 d,全方组和托法组均高于透法组(P<0.05),全方组与托法组比较无统计学差异。创伤后14 d,全方组愈合率高于托法组和透法组(P<0.05),托法组与透法组比较差异无统计学意义。结果见表 1。
| 表 1 各组大鼠创面愈合率比较 Table 1 Comparision on wound healing rates of rats in each group |
HE染色显示:创伤后8 d,对照组创面组织几乎无中性粒细胞浸润,毛细血管含量丰富,管腔较大,多垂直于创面,可见较多成纤维细胞,少量胶原沉积。模型组炎症细胞较多,可见大量中性粒细胞,新生毛细血管少,且管腔小。全方组可见少量中性粒细胞及巨噬细胞,毛细血管数量较多,毛细血管内径较大。透法组炎症细胞浸润较少,可见少量中性粒细胞,毛细血管数目较模型组略有增加,血管内径较小。托法组炎症细胞浸润较模型组略少,毛细血管数目较多,管腔较大。结果见图 1。
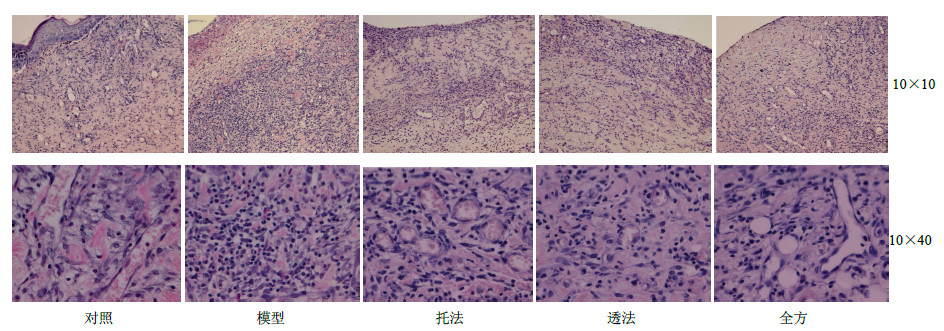 | 图 1 创伤后8 d各组大鼠创面肉芽组织HE染色Fig.1 HE stainning of wound granulation of rats in each group after mediation for 8 d |
创伤后5、8、11、14 d,糖尿病各组大鼠创面Ang-1、Tie-2蛋白表达水平均低于对照组(P<0.05),全方组大鼠创面Ang-1、Tie-2蛋白表达水平明显高于模型组、托法组和透法组(P<0.05);创伤后5 d,托法组和透法组与模型组比较差异无统计学意义;创伤后8 d,托法组和透法组Ang-1、Tie-2表达水平均高于模型组(P<0.05),两组比较无统计学差异。创伤后11、14 d,托法组Ang-1、Tie-2蛋白表达水平高于透法组(P<0.05)。结果见图 2和表 2、3。
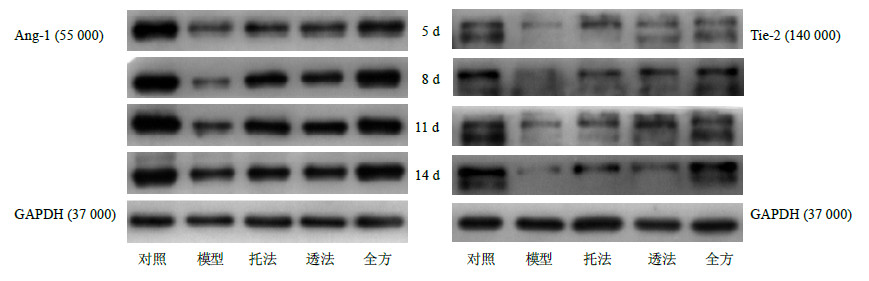 | 图 2 各组大鼠创面组织中Ang-1和Tie-2蛋白表达 (Western blotting) Fig.2 Protein expression of Ang-1 and Tie-2 in wound of rats in each group (Western blotting) |
| 表 2 各组大鼠创面组织中Ang-1的蛋白表达水平比较 Table 2 Comparision on protein expression of Ang-1 in wound granulation tissue of rats in each group |
| 表 3 各组大鼠创面组织Tie-2的蛋白表达水平比较 Table 3 Comparision on protein expression of Tie-2 in wound granulation tissue of rats in each group |
创伤后5、8、11、14 d,糖尿病各组大鼠创面Ang-2蛋白表达水平明显高于对照组(P<0.05),各给药组均低于模型组(P<0.05);创伤后5 d,透法组Ang-2蛋白表达水平低于全方组和托法组(P<0.05),且全方组低于托法组(P<0.05);创伤后8、11、14 d,全方组Ang-2蛋白表达水平低于托法组和透法组(P<0.05)。结果见图 3和表 4。
 | 图 3 各组大鼠创面组织中Ang-2的蛋白表达 (Western blotting)Fig.3 Protein expression of Ang-2 in wound of rats in each group (Western blotting) |
| 表 4 各组大鼠创面肉芽组织Ang-2的蛋白表达水平比较 Table 4 Comparision on protein expression of Ang-2 in wound granulation tissue of rats in each group |
镜下可见Tie-2阳性物质呈棕黄色,分布于血管内皮细胞胞膜,对照组血管丰富,管腔大,Tie-2强阳性表达;模型组血管少,管腔小,Tie-2呈弱阳性表达;全方组血管较多,管腔较大,Tie-2阳性表达较多;托法组和透法组血管较少,管腔较小,Tie-2阳性表达较模型组多。Ang-1阳性物质呈棕黄色分布于血管周围,对照组表达较多,模型组表达较少,全方组多于模型组、托法组和透法组。镜下可见Ang-2阳性物质呈棕黄色颗粒状,分布于血管周围基质中,对照组Ang-2呈弱阳性表达;模型组Ang-2呈强阳性表达;全方组Ang-2表达较少;托法组和透法组Ang-2表达均低于模型组。结果见图 4。
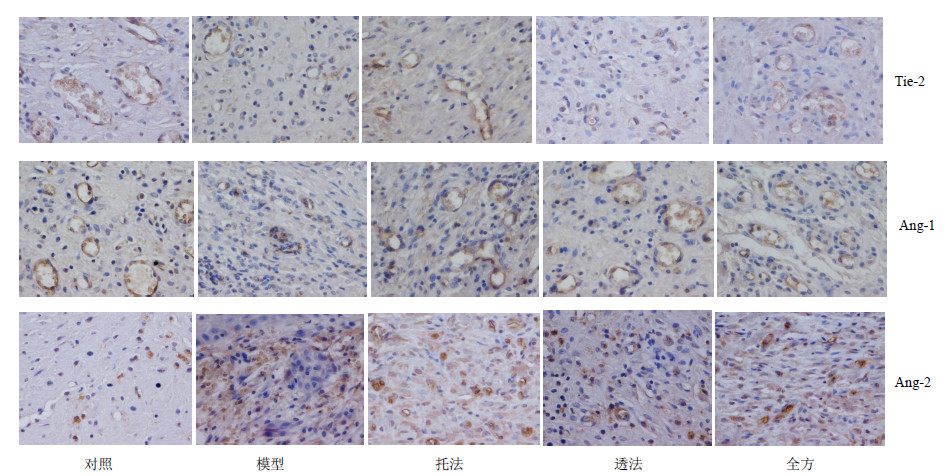 | 图 4 创伤后8 d各组大鼠创面肉芽组织Tie-2、Ang-1、Ang-2阳性表达情况 (免疫组化) Fig.4 Positive expression of Tie-2,Ang-1,and Ang-2 protein in wound granulation of rats in each group after mediation for 8 d (immunohistochemistry) |
皮肤创伤愈合是一个有序的、复杂的过程,包括炎症反应、肉芽组织形成、组织重塑和再上皮化等[7]。高血糖条件下,创伤愈合受损,主要表现为早期炎症反应低下、炎症阶段延长、血管生成受损、肉芽组织形成减少、基质蛋白水解酶水平升高、胶原合成减少等[8]。肉芽组织填充是创面愈合的关键步骤,肉芽组织形成质量的好坏可直接影响创伤愈合的程度及其预后,其中血管再生及血管网的形成起着极其重要的作用。丰富的新生血管改善创面微循环,为组织修复提供所必须的氧及丰富的营养物质,从而有利于创面愈合。此外,炎症细胞需要与内皮细胞基底膜相互作用从而进入创伤部位,因此,血管生成是创面修复的关键环节[9]。血管生成是一个动态过程,受多种因子调控,血管生成素/受体(Ang/Tie)系统是近年来发现的有效创面血管生成因子,在控制新生血管萌芽、血管重塑及调节内皮细胞状态中发挥重要作用。Ang-1和Ang-2均是血管内皮细胞酪氨酸激酶受体Tie-2的内源性配体,均可以与Tie-2结合。Ang-1与Tie-2结合引起受体磷酸化,Ang-2与Tie-2结合,占据Ang-1结合位点,不引起受体磷酸化,因而被认为是Ang-1的天然拮抗剂。研究表明,Ang-1主要由周细胞、血管平滑肌细胞、纤维母细胞等分泌[10],在血管生成的后期如血管重塑、新生血管系统的成熟以及稳定毛细血管方面起重要作用[11]。此外,Ang-1还能抑制内皮细胞凋亡,并能募集周细胞等血管支持细胞促进内皮细胞存活,维持血管的完整性[10]。Ang-2作为Ang-1的拮抗剂,主要由内皮细胞分泌,并储存在Weibel palade小体中,在各种刺激的作用下迅速释放,使内皮细胞处于不稳定的激活状态,促进血管结构松解,消除血管基底膜和周围细胞对内皮的支撑作用,失去正常微环境的内皮细胞非常容易浸润、迁移,形成新生血管[12]。因此,Ang-2主要在血管生成的早期起作用。同时,Ang-2还能增加血管的渗透性,引起蛋白酶、细胞因子、炎症因子等渗透到局部组织,参与炎症反应[12]。因此,血管生成素/受体系统在维持血管的完整性和内皮细胞稳态中起重要作用,Ang-1激活Tie-2受体维持内皮细胞的静息状态,Ang-2打破内皮细胞的稳态,增加内皮细胞对外源性刺激的反应性,促进炎症因子和血管生成相关因子的活动,因此,血管生成素/受体系统是连接血管生成和炎症反应的桥梁[13]。
研究表明,高糖水平可以刺激Ang-2的表达[14],且高糖条件下Ang-1、Tie-2表达水平降低[15]。本研究结果与既往研究一致,与同时间点对照组相比,模型组创面肉芽组织中Ang-2的表达水平明显升高,Ang-1、Tie-2表达水平明显降低。且创伤愈合后期对照组Ang-2表达水平明显降低,模型组Ang-2表达水平无明显下降,提示糖尿病皮肤溃疡愈合困难可能与创面局部Ang-2表达水平持续升高及Ang-1、Tie-2表达水平下降有关。升高的Ang-2水平一方面导致炎症过程延长,另一方面拮抗Ang-1的作用,导致新生毛细血管成熟障碍、渗透性增加、创面愈合缓慢。与同时间点模型组相比,全方组Ang-2表达水平明显下降,且Ang-1、Tie-2表达水平上调,提示托里消毒散精简方可能通过上调创面肉芽组织中Ang-1、Tie-2的表达水平,下调Ang-2的表达水平促进创面愈合。本研究中托法组Ang-1、Tie-2表达水平较模型组均有不同程度的上调,且现代研究表明当归中的有效成分阿魏酸能提高膜稳定性、保护内皮细胞[16],黄芪中的有效成分黄芪多糖能有效地降低高血糖,改善胰岛素抵抗[17, 18],黄芪甲苷具有抗氧化功能,可以改善高血糖条件下内皮细胞功能障碍[19],提示托法方药可能通过上调Ang-1、Tie-2的表达水平,促进血管重塑及新生血管成熟,防止血管渗漏,抑制内皮细胞凋亡,促进肉芽组织生长,进而促进伤口愈合。本实验中,透法方药在创伤愈合早期能显著下调Ang-2的表达水平,方中白芷有效成分欧前胡素具有舒张血管活性的作用,临床上与其他中药配伍常用于各类炎症、溃疡病及皮肤问题[20, 21],皂角刺有抗菌、抗炎作用,多用于消炎、镇痛[22],临床上亦有用于下肢溃疡治疗,疗效颇佳,提示透法可能通过降低Ang-2表达水平,一方面减轻Ang-2引起的炎症反应,一方面减轻Ang-2对Ang-1的拮抗作用,从而促进创面愈合。
以上实验表明,托里消毒散精简方及其拆方可以改善糖尿病皮肤溃疡大鼠的创面愈合情况,抑制炎症反应,促进肉芽组织生长和创面愈合。托法和透法在创伤愈合的不同阶段发挥了不同作用,全方应用优于拆方。但是托里消毒散精简方促进糖尿病皮肤溃疡愈合的具体作用机制及物质基础,还需要进一步实验研究。
| [1] | Al-Kaabi J M, Al Maskari F, Cragg P, et al. Illiteracy and diabetic foot complications[J]. Prim Care Diabetes, 2015, 9(6):465-472. |
| [2] | Bowling F L, Rashid S T, Boulton A J. Preventing and treating foot complications associated with diabetes mellitus[J]. Nat Rev Endocrinol, 2015, 11(10):606-616. |
| [3] | Noor S, Zubair M, Ahmad J. Diabetic foot ulcer-A review on pathophysiology, classification and microbial etiology[J]. Diabetes Metab Syndr, 2015, 9(3):192-199. |
| [4] | Helary C, Zarka M, Giraud-Guille M M. Fibroblasts within concentrated collagen hydrogels favour chronic skin wound healing[J]. J Tissue Eng Regen Med, 2012, 6(3):225-237. |
| [5] | 冯鑫, 周永梅, 房德敏. 中药对伤口愈合干预作用的机理研究[J]. 辽宁中医杂志, 2015, 42(8):1498-1501. |
| [6] | 郝福明. 托里消毒散研究评述[J]. 中华中医药学刊, 2008, 26(3):598-599. |
| [7] | Zielins E R, Atashroo D A, Maan Z N, et al. Wound healing:an update[J]. Regen Med, 2014, 9(6):817-830. |
| [8] | Lee Y H, Chang J J, Chien C T, et al. Antioxidant sol-gel improves cutaneous wound healing in streptozotocin- induced diabetic rats[J]. Exp Diabetes Res, 2012. doi:10.1155/2012/504693. |
| [9] | Bodnar R J. Chemokine Regulation of Angiogenesis During Wound Healing[J]. Adv Wound Care, 2015, 4(11):641-650. |
| [10] | Fagiani E, Christofori G. Angiopoietins in angiogenesis[J]. Cancer Lett, 2013, 328(1):18-26. |
| [11] | Koh G Y. Orchestral actions of angiopoietin-1 in vascular regeneration[J]. Trends Mol Med, 2013, 19(1):31-39. |
| [12] | Reiss Y. Angiopoietins[J]. Recent Results Cancer Res, 2010, 180:3-13. |
| [13] | Kreuger J, Phillipson M. Targeting vascular and leukocyte communication in angiogenesis, inflammation and fibrosis[J]. Nat Rev Drug Discov, 2016, 15(2):125-142. |
| [14] | Yao D, Taguchi T, Matsumura T, et al. High glucose increases angiopoietin-2 transcription in microvascular endothelial cells through methylglyoxal modification of mSin3A[J]. J Biol Chem, 2007, 282(42):31038-31045. |
| [15] | Kämpfer H, Pfeilschifter J, Frank S. Expressional regulation of angiopoietin-1 and -2 and the tie-1 and -2 receptor tyrosine kinases during cutaneous wound healing:a comparative study of normal and impaired repair[J]. Lab Invest, 2001, 81(3):361-373. |
| [16] | 赵保胜, 桂海水, 朱寅荻, 等. 阿魏化学成分、药理作用及毒性研究进展[J]. 中国实验方剂学杂志, 2011, 17(17):279-281. |
| [17] | Mao X Q, Yu F, Wang N, et al. Hypoglycemic effect of polysaccharide enriched extract of Astragalus membranaceus in diet induced insulin resistant C57BL/6J mice and its potential mechanism[J]. Phytomedicine, 2009, 16(5):416-425. |
| [18] | 韩镕徽, 王洪新, 唐富天, 等. 黄芪多糖对异丙肾上腺素诱导的心肌肥厚大鼠内皮功能的影响[J]. 中草药, 2015, 46(24):3722-3726. |
| [19] | Zhang N, Wang X H, Mao S L, et al. Astragaloside IV improves metabolic syndrome and endothelium dysfunction in fructose-fed rats[J]. Molecules, 2011, 16(5):3896-3907. |
| [20] | 朱艺欣, 李宝莉, 马宏胜, 等. 白芷的有效成分提取、药理作用及临床应用研究进展[J]. 中国医药导报, 2014, 11(31):159-162. |
| [21] | Nie H, Meng L Z, Zhou J Y, et al. Imperatorin is responsible for the vasodilatation activity of Angelica Dahurica var. Formosana regulated by nitric oxide in an endothelium-dependent manner[J]. Chin J Integr Med, 2009, 15(6):442-447. |
| [22] | 覃华亮, 韦怡. 皂角刺研究进展及临床应用[J]. 亚太传统医药, 2014, 10(17):54-56. |
 2016, Vol. 47
2016, Vol. 47


