植物内生真菌是指生活史部分或全部定殖于健康活体植物组织内,不引起植物明显病害的微生物[1],能产生与宿主植物相同或相似的生物活性成分[2]。植物内生真菌可对寄主植物产生多种有益作用,如抗病原微生物[3],增强抗逆性[4],抗昆虫、线虫等摄食[5],被认为是寻找新的生物活性物质的重要资源之一[6]。
银杏Ginkgo biloba L.,又称白果树、公孙树,主产中国,其叶、果实等皆具药用价值[7, 8]。根据内共生理论,银杏内生真菌代谢产物中可能含有多种生物活性成分,应加强对其内生真菌的研究和开发[9]。Xiao等[10]对80株银杏内生真菌的抗菌活性进行了研究,发现15株内生菌至少能抑制一种指示菌,多株内生真菌代谢产物具有较强抑菌活性,说明银杏内生真菌是寻找抗菌活性物质重要潜在资源。刘小莉等[11]从银杏内生真菌中分离到一株抗菌活性较强的菌株,对金黄色葡萄球菌有强力抑制作用,经形态学和分子生物学鉴定,将其确定为Xylaria venosula Speg.,认为从中开发新型抑菌生物制剂具有应用前景。Ye等[12]从80株银杏内生真菌中筛选出一株产黄柄曲菌素的Chaetomium globosum CDW7菌株,并对其发酵参数进行了优化。高敬红等[13]从银杏内生真菌一株镰刀菌属发酵液中分离出抗革兰阳性菌较强的活性化合物A和B,经结构解析,推断化合物A和B分别为恩镰孢菌素B和恩镰孢菌素D。以上相关研究表明,银杏内生真菌生物多样性丰富,且代谢产物中含有多种生物活性物质,因此继续从银杏内生真菌代谢产物中探寻新型生物活性物质具有重要的理论和现实意义。
本研究对40株银杏内生真菌的抗菌活性进行比较,从中筛选抗菌活性强的菌株。在此基础上,利用多种分离、纯化方法,对抗菌活性强的菌株的抗菌活性成分进行了初步分析,为从植物内生真菌资源中开发新型抗菌生物制剂提供相关基础和理论依据。
1 材料 1.1 药材与试剂银杏叶、枝条、果实等采自安徽省芜湖市赭山公园和安徽工程大学境内,由安徽农业大学朱虹副教授鉴定为银杏科银杏属植物银杏Ginkgo biloba L.。内生真菌由健康银杏叶、枝条、果实中分离、纯化所得;指示菌:大肠杆菌(SWGC012)、金黄色葡萄球菌(SWGC021)、枯草芽孢杆菌(SWGC036)、酿酒酵母(SWGC007)、黑曲霉(SWGC008)、根霉(SWGC019),由安徽工程大学微生物发酵安徽省工程技术研究中心保藏;分离培养基为PDA培养基;液体发酵培养基为PDB培养基;细菌类指示菌培养基为牛肉膏蛋白胨培养基;真菌类指示菌培养基为PDA培养基;100~200目柱色谱硅胶、200~300目柱色谱硅胶、高效薄层色谱硅胶板购自安徽良臣硅源材料有限公司;Sephadex LH-20购自北京绿百草科技发展有限公司;其余试剂为国产分析纯或色谱纯。
1.2 仪器与设备Cimiao超净工作台,上海新苗医疗制造有限公司;XSP-8CE生物显微镜,上海蔡康光学仪器公司;HS-J2常温高速离心机,美国贝克曼公司;QHZ-123B恒温振荡培养箱,江苏太仓市华美生化仪器厂;LDZX-50KBS高压蒸汽灭菌锅,上海申安医疗器械厂;FD-83冷冻干燥机,美国SIM公司;LC-20A高效液相色谱仪,日本岛津公司;ODS2反相C18半制备柱,美国Waters公司;6210 Time-of-flight LC/MS,美国Agilent公司。
2 方法 2.1 银杏内生真菌的分离、纯化、鉴定参考文献方法[14, 15]对健康银杏叶、枝条、果实中的内生真菌进行分离、纯化。对分离得到的银杏内生真菌进行显微观察,结合《真菌鉴定手册》,进行初步分类[16]。
2.2 银杏内生真菌液体培养及其发酵液处理挑取经活化的内生真菌菌丝或孢子接种于PDB液体培养基中,28 ℃、170 r/min条件下摇床振荡培养7 d。5 000 r/min离心20 min去除菌丝体,收集上清液,冷冻干燥。用无菌水溶解后,经旋转蒸发仪浓缩至原体积1/5,4 ℃冰箱保存,备用。
2.3 银杏内生真菌发酵液抗菌活性实验采用滤纸片法进行抗菌活性初筛[17]。采用平板孔阱扩散法进行抗菌活性复筛[18]。
2.4 草酸青霉菌YXY009菌株发酵液抗菌活性成分的分离与纯化采用抽滤法对菌株YXY009发酵液进行分离,去除菌丝体,所得滤液用75%乙醇进行醇沉处理,25 ℃下静置24 h,再经滤过、离心处理,去除蛋白质、多糖等大分子物质。将醇沉后发酵液40 ℃减压浓缩至浸膏状,获得浸膏约20 g。将20 g浸膏溶于甲醇,称取100~200目硅胶40 g进行拌样后,采用干法上样,湿法上柱(柱中充填200~300目硅胶20 g),以不同体积比甲醇-三氯甲烷溶液进行梯度洗脱。硅胶柱分离的样品被自动收集器收集后,经薄层色谱(TLC)分析、合并,得到Po.1~Po.7共7个组分。以黑曲霉为抑菌指示菌,采用平板孔阱扩散法进行抗菌活性成分跟踪监测。对所得7个组分的抗菌活性测定结果表明,仅Po.3组分具有抗菌活性。将活性组分Po.3再上硅胶柱,以醋酸乙酯-甲醇不同梯度溶液进行洗脱,获得Po.3-1~4共4个组分,其中Po.3-2具有抑菌活性。
将Po.3-2组分上Sephadex LH-20凝胶柱,经甲醇-氯仿(1:1)溶液洗脱后,获得2个组分,即Po.3-2-1和Po.3-2-2,其中Po.3-2-1具有抑菌活性。将Po.3-2-1过制备型HPLC,流动相为甲醇-0.04%磷酸水溶液(4:6),根据样品出峰时间,收集组分,获得一个抑菌活性组分,将其命名为POM。
2.5 抗菌活性组分POM的鉴定分析 2.5.1 TLC分析取一定量样品加入适量的甲醇溶液,制备成5 mg/mL的样品,超声振荡30 min后,用0.45 μm滤膜滤过。用微量点样器吸取适量样品,于GF254硅胶板上点样后,展开剂展开,当所有样品展开长度达到8~12 cm时,将薄层板移出晾干。观察、标记色谱结果。
2.5.2 HPLC分析流动相为甲醇-0.04%磷酸水溶液(4:6);柱温25 ℃;体积流量1.0 mL/min;检测波长360 nm;分析时间30 min。
2.5.3 质谱和紫外光谱分析取纯化后的样品冻干粉配制成0.1 mg/mL的甲醇溶液进行质谱分析。样品以HPLC自动进样器进样,进样量10 μL,洗脱体积流量为0.2~0.3 mL/min。电离方式为ESI,雾化气压力为241.325 kPa(35 psi),氮气体积流量为10 L/min;阴离子模式的离子化电压为3 500 V,碎片电压为175 V;阳离子的离子化电压为4 000 V,碎片电压为215 V。阳离子和阴离子模式进行测试分析。由于本实验的HPLC-MS接有DAD检测器,因此样品分析时可同时获得其紫外光谱。
3 结果与分析 3.1 40株银杏内生真菌种群组成从健康银杏叶、枝条和果实组织中共分离得到40株内生真菌。经菌落和形态学观察,比对《真菌鉴定手册》,对40株银杏内生真菌进行初步鉴定。有18株菌株在PDA培养基上不产孢,占总分离菌株的45.0%,其他22株均为产孢真菌,且多数菌株为青霉属、曲霉属和交链孢霉属,占总分离菌株比例分别为17.5%、15.0%和7.5%,简梗孢霉属、毛壳菌属、黑孢霉属、毛霉属、镰孢霉属和拟盘多毛孢属各1株(表 1)。
| 表 1 40株银杏内生真菌种群组成 Table 1 Fungal taxa of 40 endophyte strains in G. biloba |
采用滤纸片抑菌法对从银杏组织中分离的40株内生真菌发酵液的抗菌活性进行初步筛选,结果发现有16株菌株有抑菌活性,占菌株总数的40.0%,其他24株菌株未显示抑菌活性。其中有活性的16株菌株的抑菌活性结果见表 2,可以看出,16株菌株发酵液均至少对1种指示菌有抑制效果,对2种及2种以上指示菌有抑制效果的菌株有8株,占菌株总数的20%。
| 表 2 银杏内生真菌发酵液抑菌活性初筛结果 Table 2 Screening results of antipathogenic activities of brothfromendophyte fungi strains in G. biloba |
根据初筛实验结果和菌株在人工培养基上生长、退化、染菌等状况,选择YXY003、YXY004、YXY006、YXY009、YXY014、YXY015、YXY016和YXY019共8株菌株作为复筛对象。
3.3 抑菌活性菌株复筛结果采用平板孔阱扩散法对初筛实验结果和生物学特性较好的YXY003等8株银杏内生真菌进行复筛,结果见表 3。可见,选用的6种指示菌中,大肠杆菌的敏感性最差,复筛菌株发酵液对其均无抑菌活性;黑曲霉敏感性最强,8株菌株发酵液对其均有不同程度的抑制作用,其中YXY009菌株发酵液的抑菌圈直径最大,为(18.46±1.29)mm;其他指示菌的敏感性介于黑曲霉和大肠杆菌之间;活性菌株中4株对金黄色葡萄球菌、2株对枯草芽孢杆菌、5株对酿酒酵母、7株对根霉有抑菌作用。YXY014菌株发酵液对金黄色葡萄球菌的抑菌效果最为显著,抑菌圈直径达(19.26±0.58)mm;YXY019菌株发酵液对枯草芽胞杆菌的抑菌圈最大,为(13.47±0.46)mm;YXY009菌株发酵液对酿酒酵母和根霉抑菌效果最佳,抑菌圈直径分别为(22.35±1.32)和(23.60±0.83)mm。
| 表 3 银杏内生真菌发酵液抑菌活性复筛结果 Table 3 Rescreening results of antipathogenic activities of broth from endophyte fungi strains in G. biloba |
由抑菌活性复筛结果可以看出,YXY009菌株发酵液的抑菌活性明显高于其他菌株,因此选择该菌株进行进一步深入研究。采用形态学和分子生物学相结合的方法,对YXY009菌株进行了分类鉴定,确定该菌株为草酸青霉Penicillium oxalicum[19]。
3.4 草酸青霉YXY009菌株发酵液抗菌活性成分鉴定结果从YXY009菌株发酵液中分离得到的抗菌活性组分POM对应的HPLC图谱上为单峰,见图 1,总离子流图见图 2。HPLC-MS正离子模式图谱(图 3-a)中,有质荷比为407.254 19离子峰,为 [M+H]+峰,对应的分子式为C20H23O9(误差为0.95×10−6);负离子模式图谱(图 3-b)中,有质荷比为405.223 08离子峰,为 [M-H]−峰,对应的分子式为C20H21O9(误差为1.08×10−6);显然,组分POM对应的分子式是C20H22O9。根据该化合物分子式,并结合其紫外光谱(UV)吸收特性(图 4),经天然产物数据库查询发现,该化合物与已知化合物毛果杨苷分子式完全一致。在此基础上,将组分POM与毛果杨苷的TLC、HPLC及UV图谱进行比对,发现其Rf值、保留时间及UV谱特征完全一致。因此,初步鉴定组分POM为毛果杨苷(trichocarpin,5-羟基-2-[(2S,3R,4S,5S,6R)-3,4,5-三羟基-6-(羟甲基)-O-2-环己氧基]苯甲酸苄酯)。
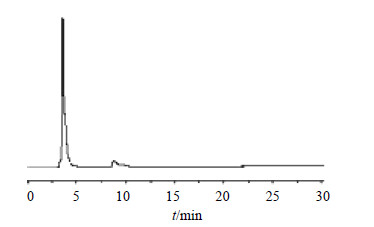 | 图 1 POM组分HPLC图谱 Fig.1 HPLC of compound POM |
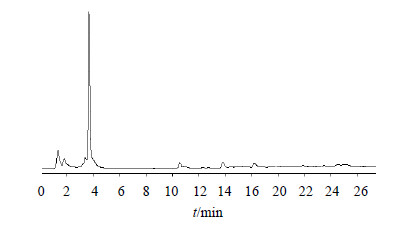 | 图 2 POM组分总离子流图 Fig.2 HPLC-MS total ion chromatogram of compound POM |
 | 图 3 POM组分正离子 (a) 和负离子 (b) 质谱图 Fig.3 HPLC-MS of compound POM in positive (a) and negative (b) model |
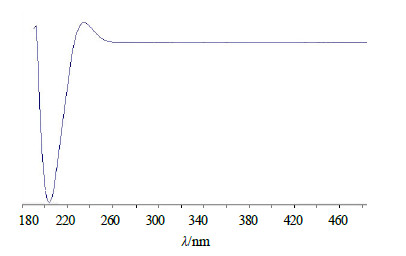 | 图 4 POM组分UV图谱 Fig.4 UV absorption spectrum of compound POM |
目前,国内外对于银杏内生真菌代谢产物的相关研究主要集中在寻找产黄酮内酯类等生物活性代谢产物方面,而对银杏内生真菌其他生物活性物质研究相对较少。王国平等[20]从浙江天目山自然保护区银杏中分离获得1株Penicillium commune TMSF169菌株,并从其发酵液中分离获得1个具抗真菌及除草活性化合物圆弧菌醛酸。Ye等[12]从80株银杏内生真菌中筛选出一株Chaetomium globosum CDW7菌株,并从其代谢产物中分离出具有抗氧化活性的黄柄曲菌素。
本实验从健康银杏组织中分离出40株银杏内生真菌,并对其进行了初步的形态学鉴定分类,发现22株产孢真菌中,大部分为青霉属、曲霉属和交链孢霉属;而不产孢的18株真菌由于缺少进一步的形态学鉴定特征,如产孢结构等,未对其进行进一步的分类,可采用分子生物学的方法对其进行深入研究。利用滤纸片法和平板孔阱扩散法对40株银杏内生真菌的抗菌活性进行了初筛和复筛,获得1株抗菌活性较高的草酸青霉菌YXY009菌株。由于该菌株具有较高且稳定的抗菌活性,因此对其进行进一步开发利用具有重要的理论和应用价值。
通过硅胶柱色谱、凝胶柱色谱、TLC、HPLC、高分辨LC-MS等方法,采用平板孔阱扩散法进行抗菌活性成分跟踪监测和TLC检测,结合分离过程中活性化合物的极性、Rf值等特点,对200~300目硅胶柱色谱、Sephadex LH-20凝胶柱色谱的分离条件进行优化,合并洗脱液,反复纯化,最终从草酸青霉菌YXY009菌株发酵液中成功分离纯化出抗菌活性组分POM。结合该化合物的色谱特性、紫外光谱特性、质谱特性和天然产物数据库查询,初步推断为毛果杨苷,分子式为C20H22O9,但具体结构还有待于进一步确认。毛果杨苷为首次从银杏内生真菌代谢产物中分离获得,未见相关报道。如何提高草酸青霉菌YXY009菌株代谢产物中抗菌活性成分毛果杨苷的量,可作为下一步目标对其进行研究探讨,提高该菌株的应用价值。
| [1] | Carroll G. Fungal endophytes in stems and leaves:From latent pathogen to mutualistic symbiont[J]. Ecology, 1988, 69(1):2-9. |
| [2] | Strobel G, Daisy B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiol Mol Biol Rev, 2003, 67(4):491-502. |
| [3] | Sutherland B L, Hume D E, Tapper B A. Allelopathic effects of endophyte-infected perennial ryegrass extracts on white clover seedlings[J]. NZ J Agric Res, 1999, 42(1):19-26. |
| [4] | Ravel C, Courty C, Coudret A, et al. Beneficial effects of Neotyphodium lolii on the growth and the water status or drought stress[J]. Agronomie, 1997, 17(3):173-181. |
| [5] | Wilkinson H H, Siegel M R, Blankenship J D, et al. Contribution of fungal loline alkaloids to protection from aphids in a grass-endophyte mutualism[J]. Mol Plant Microbe Interact, 2000, 13(10):1027-1033. |
| [6] | Debbab A, Aly A H, Proksch P, et al. Bioactive secondary metabolites from endophytes and associated marine derived fungi[J]. Fungal Diversity, 2011, 49(1):1-12. |
| [7] | 杨强, 李新华, 张振, 等. 银杏果精多糖的降血脂作用[J]. 食品与发酵工业, 2013, 39(5):62-65. |
| [8] | 丁银花, 孙永成, 王振中, 等. 银杏叶的指纹图谱建立及质量评价研究[J]. 中草药, 2015, 46(6):901-905. |
| [9] | 邓振山, 赵龙飞, 张薇薇, 等. 银杏内生真菌的分离及其对苹果腐烂病病原菌的拮抗作用[J]. 西北植物学报, 2009, 29(3):608-613. |
| [10] | Xiao Y, Li H X, Li C, et al. Antifungal screening of endophytic fungi from Ginkgo biloba for discovery of potent anti-phytopathogenic fungicides[J]. FEMS Microbiol Lett, 2013, 339(2):130-136. |
| [11] | 刘小莉, 周剑忠, 黄开红, 等. 古银杏内生真菌的分离及其抑菌活性[J]. 微生物学通报, 2009, 36(10):1513-1518. |
| [12] | Ye Y, Xiao Y, Ma L, et al. Flavipin in Chaetomium globosum CDW7, an endophytic fungus from Ginkgo biloba, contributes to antioxidant activity[J]. Appl Microbiol Biotechnol, 2013, 97(16):7131-7139. |
| [13] | 高敬红, 易大为, 邹宇. 一株银杏内生真菌抗菌代谢产物的分离与鉴定[J]. 中国抗生素杂志, 2015, 40(10):728-731. |
| [14] | 高樱萍, 葛飞, 张慧敏, 等. 32株银杏内生真菌清除DPPH自由基活性的比较研究[J]. 安徽工程大学学报, 2013, 28(1):1-4. |
| [15] | 杨明俊, 李娟, 薛鸿燕, 等. 水仙内生真菌的分离及抑菌和抗肿瘤活性研究[J]. 中草药, 2014, 45(6):819-824. |
| [16] | 魏景超. 真菌鉴定手册[M]. 上海:科学技术出版社, 1979. |
| [17] | Balows A. Manual of Clinical Microbiology[M]. 7th Ed. Washington DC:American Society for Microbiology, 1999. |
| [18] | Pelaez F, Collado J, Arenal F, et al. Endophytic fungi from plants living on gypsum soils as a source of secondary metablites with antimicrobial activity[J]. Mycol Res, 1998, 102(6):755-761. |
| [19] | 葛飞, 龚倩, 石贝杰, 等. 一株高抑菌活性银杏内生真菌SPE009的鉴定及其培养条件优化[J]. 食品工业科技, 2015, 36(6):195-199. |
| [20] | 王国平, 王丽薇, 张亚磊, 等. 一株银杏内生真菌的鉴定及其活性代谢产物研究[J]. 中国生物防治学报, 2012, 28(2):226-234. |
 2016, Vol. 47
2016, Vol. 47

