决明子为豆科植物决明Cassia obtusifolia L. 或小决明Cassia tora L. 的干燥成熟种子,功效清热明目、润肠通便[1]。药理研究表明决明子具有显著的降血压、调血脂、保肝、抗氧化、抑菌等活性[2, 3, 4, 5, 6, 7]。决明子是国家卫生部公布的药食两用中药,被广泛应用于保健食品中,截止2010年上半年,在国家食品药品监督管理局公布的国产保健品目录中含决明子保健品198种;同时由于决明子中含有大量蒽醌类成分,其安全性引人关注。《中国药典》2010年版一部仅以蒽醌类成分大黄酚和橙黄决明素量对其实现质量控制,并未对决明子中其他蒽醌类成分进行测定。多指标质控模式符合中药化学成分复杂的特点,能够更好地控制药材质量,但其需要对照品的种类和数量均比较大,难以推广。王智民等[8]提出了一测多评法(QMSA)的多指标质控模式,即在多指标质量控制时,以样品中对照品廉价易得的典型成分为内标,建立该成分与其他成分间的相对校正因子(fk/s),再通过fk/s计算出其他成分的量。已有成功应用QMSA实现对陈皮、大黄、黄柏、牡丹皮、五味子、丹参、预知子等中药的质量控制标准[9, 10, 11, 12, 13, 14, 15]的报道,其中黄连药材的QMSA法被《中国药典》2010年版收载。为了对决明子进行多指标质量进行控制,本研究采用HPLC法建立了4种蒽醌类成分QMSA测定分析方法。
1 材料 1.1 仪器Shimadzu LC-20AT高效液相色谱仪2台,SIL-20A自动进样器,SPD-20A检测器,CTO-20A柱温箱,LC solution色谱工作站软件(日本岛津公司)。Agilent 1260高效液相色谱仪,G1311C四元泵,G1329B进样器,G1316A柱温箱,G1362A检测器(美国Agilengt公司);BP211D电子分析天平(德国Sartouris股份有限公司);旋转蒸发仪RE-2000B(上海亚荣生化仪器厂);UPT-I-10T优普系列超纯水机(成都超纯科技有限公司)。
1.2 试药与试剂大黄素甲醚(批号110758-201013),大黄素(批号110756-200110),大黄酚(批号110796-201017)均购自中国食品药品检定研究院,橙黄决明素(批号 must-15042315)购自四川省曼斯特生物科技有限公司,上述对照品经HPLC峰面积归一化法检测质量分数均在98%以上。乙腈为色谱纯(国药集团化学试剂有限公司),水为超纯水,其余试剂均为分析纯。
1.3 药材6批决明子药材于2015年于成都荷花池专业中药材市场、成都中医药大学附属医院及同仁堂采购。经成都中医药大学卢先明教授鉴定均为豆科植物决明Cassia obtusifolia L. 或小决明Cassia tora L. 的干燥成熟种子,其中除成都同仁堂采购的为炒决明子,其他均为净决明子,样品信息见表 1。
|
|
表 1 样品信息 Table 1 Sample information |
色谱柱为Wondasil C18柱(250 mm×4.6 mm,5 μm);以0.1%磷酸水溶液(A)-乙腈(B)为流动相,梯度洗脱:0~10 min,30%~50% B;10~30 min,50% B;30~65 min,50%~85% B;65~70 min,85%~15% B;70~80 min,15% B。体积流量0.8 mL/min,检测波长285 nm,柱温30 ℃。
2.1.2 混合对照品溶液制备分别取橙黄决明素、大黄素、大黄酚、大黄素甲醚适量,精密称定,加无水乙醇-醋酸乙酯(2∶1)混合溶液分别制成含橙黄决明素1.64 mg/mL、大黄素0.400 mg/mL、大黄酚1.29 mg/mL、大黄素甲醚1.26 mg/mL的溶液,作为各对照品储备液。分别精密移取上述各储备液各1 mL转移至50 mL量瓶中,加无水乙醇-醋酸乙酯(2∶1)混合溶液稀释至刻度,摇匀,即得混合对照品溶液。
2.1.3 供试品溶液制备取本品粉末(过4号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL。称定质量,加热回流2 h,放冷,再称定质量,用甲醇补足减失质量,摇匀,滤过,精密量取续滤液25 mL,蒸干,加稀盐酸30 mL,置水浴中加热水解1 h,立即冷却,用三氯甲烷振摇提取4次,每次30 mL,合并三氯甲烷液,回收溶剂至干,残渣用乙醇-醋酸乙酯(2∶1)混合溶液使溶解,转移至25 mL量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
分别精密吸取上述对照品溶液与供试品溶液各20 μL,注入液相色谱仪,测定,结果见图 1。
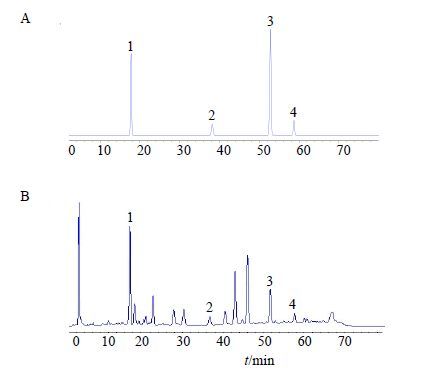
|
1-橙黄决明素 2-大黄素 3-大黄酚 4-大黄素甲醚 1-aruantio-obtusin 2-emodin 3-chrysophanol 4-physcion 图 1 对照品 (A) 及决明子样品 (B) HPLC色谱图 Fig. 1 HPLC of reference substance (A) and Cassiae Semen sample (B) |
取“2.1.2”项中混合对照品溶液8、12、15、18、20、25 μL,按上述色谱条件测定,以对照品溶液质量浓度(X)为横坐标,峰面积(Y)为纵坐标,进行回归处理,得线性回归方程。混合对照品逐级稀释,分别以信噪比3和10考察检测限和定量限,结果见表 2。
|
|
表 2 4种蒽醌类成分线性关系考察 Table 2 Linear relationship of four kinds of anthraquinones |
取“2.1.2”项下混合对照品溶液,连续进样6次,每次20 μL,分别记录各成分峰面积并计算其RSD,结果橙黄决明素、大黄素、大黄酚、大黄素甲醚RSD分别为0.51%、0.23%、0.15%、0.23%,表明仪器精密度良好。
2.1.6 重复性试验取J5样品按“2.1.3”项制备6份供试品溶液,进样分析,得各成分的质量分数及其RSD,结果橙黄决明素、大黄素、大黄酚、大黄素甲醚平均质量分数分别为0.120%、0.034%、0.168%、0.028%,RSD分别为2.45%、4.16%、1.39%、3.65%,表明本方法重复性良好。
2.1.7 稳定性试验取“2.1.3”项中供试品溶液,分别于0、2、4、8、12、24、36 h进样分析,分别记录各成分峰面积并计算其RSD,结果橙黄决明素、大黄素、大黄酚、大黄素甲醚RSD分别为0.52%、0.97%、0.50%、4.39%,表明样品溶液在36 h内稳定。
2.1.8 加样回收率试验精密称取橙黄决明素、大黄素、大黄酚与大黄素甲醚对照品适量,加甲醇分别制成每毫升含橙黄决明素、大黄素、大黄酚与大黄素甲醚0.582、0.175、0.842、0.180 mg的溶液,取J5样品6份,每份0.5 g,分别加入上述溶液各1 mL,按供试品溶液制备方法,加入甲醇46 mL制备样品,在上述液相色谱条件下测定,计算加样回收率及其RSD,结果橙黄决明素、大黄素、大黄酚、大黄素甲醚加样回收率分别为101.5%、100.8%、98.9%、102.9%,RSD分别为1.67%、3.60%、1.71%、1.39%,表明本方法加样回收率良好。
2.1.9 耐用性试验分别考察流动相水相磷酸浓度值变化±0.05%、柱温变化±5 ℃、体积流量变化±0.05 mL/min进行测定时,仪器色谱行为的变化。检测同一批决明子4种成分的量及其RSD。结果各条件下所测各成分质量分数量的RSD均<5%。表明本方法具有较好的耐用性。
2.2 校正因子计算 2.2.1 多点校正法参照文献方法[9, 10, 11]以多个质量浓度点计算所得的fk/s取平均值作为定量用fk/s。fk/s计算公式:fk/s=(Cs×Ak)/(Ck×As);待测成分质量浓度计算公式:Ck′=(Cs×Ak′)/(fk/s×As)。两式中Cs为参照物质质量浓度,As为参照物质色谱峰峰面积,Ck为其他对照组分质量浓度,Ak为其他对照组分色谱峰峰面积,Ck′为待测组分质量浓度,Ak′为待测组分色谱峰峰面积。应用此法需先获得一个参照物的质量浓度Cs和色谱峰峰面积值As。选择大黄素为内参物计算其他成分fk/s,结果见表 3。
|
|
表 3 以大黄素为参照的fk/s Table 3 fk/susing emodin as reference |
在标准曲线Y=A X+B中,X=(Y-B)/A=Y/A-B/A,由于B值通常为误差引起,在A/B值大于100时,B/A值可以忽略不计,此时可以X=Y/A直接计算。故fk/s可以二者的斜率A之比直接计算(fk/s=Ak/As),即可以参照物快速推算其余待测成分的量。Ck′=Ak′/(As×fk/s),As为参照物斜率,Ak为其他对照组分斜率。应用此法需先建立参照物的标准曲线获其As。结果橙黄决明素、大黄酚、大黄素甲醚相对于大黄素的相对校正因子fk/s分别为1.629、0.516、0.795。
2.2.3 fk/s重复性考察考察了不同实验室的3套色谱系统(岛津LC-20A(2台)和Agilent 1260)及不同的色谱柱(Kromasil C18 250 mm×4.6 mm,5 μm;Wondasil C18 250 mm×4.6 mm,5 μm;Diamonsil C18 250 mm×4.6 mm,5 μm)对fk/s的影响,结果见表 4。
|
|
表 4 不同实验室、不同仪器、不同色谱柱对fk/s的影响 Table 4 Effects of different laboratories,instuments,and columns on fk/s |
QMSA法色谱峰的准确定位一般可以采用相对保留值结合色谱图整体特征,以及每个峰的紫外吸收特征来定位其余待测成分(a,b,…,i,…)色谱峰。相对保留值指各待测成分与内参物s间保留时间的比值,计算公式:ras=tRa/tRs(式中ras为相对保留时间,tRa为待测成分对照品保留时间,tRs为内参物保留时间)。本研究分别考察相对保留值在不同品牌仪器和不同品牌色谱柱中的重现性。结果见表 5。
|
|
表 5 QMSA法待测成分色谱峰的定位 Table 5 Positioning of components to be measured by QMSA |
首先采用外标法对决明子中5种蒽醌类成分进行多成分同步定量测定,再用建立的QAMS法对其进行计算,并将2种方法计算的结果进行比较,以验证QMSA法用于决明子中蒽醌类多指标成分质量评价的准确性。结果表明,2种方法测得的决明子蒽醌类成分量没有显著性差异,RSD<5%,提示建立的方法具有较好的可信度。结果见表 6。
|
|
表 6 外标法与QMSA法同步测定决明子中蒽醌类成分 (n = 3) Table 6 Determination of anthraqinone contents from Cassiae Semen by external standard method and QMSA synchronously (n = 3) |
参考紫外可见分光光度法,在200~400 nm下对4种对照品进行了扫描。结果显示橙黄决明素、大黄素、大黄酚、大黄素甲醚分别在284、222、225、223 nm处有最大吸收,且大黄素、大黄酚、大黄素甲醚在285 nm附近均有吸收峰,本实验综合考虑选择285 nm作为检测波长。
3.2 内参物的选择本实验选用大黄素为内参物,大黄素廉价易得,理化性质稳定,试验中发现其对照品溶液长期放置后峰面积没有明显变化,因此选择大黄素为内参物对决明子药材中3种蒽醌类成分进行测定。
3.3 QMSA法待测色谱峰的定位目前主要用准确定位色谱峰的方法主要有,色谱法、光谱法、色谱法与光谱法相结合3种方法。试验发现4种蒽醌类成分在不同高效液相色谱仪和不同品牌色谱柱的相对时间保留值无明显差异,其RSD均小于5%。因此利用实验建立的色谱峰相对时间保留值结合光谱法即可准确定位色谱峰。
3.4 测定结果分析本研究测定了6批决明子中4种蒽醌类成分量,结果表明橙黄决明素量大于0.08%的有4批,大黄酚量大于0.2%的有2批。符合《中国药典》2010年版一部决明子测定项下规定的药材仅有2批。可见市场上流通的决明子药材质量不一,相关部门应加强监管力度。
本研究采用QMSA法同时对决明子中4种蒽醌类成分进行了测定。结果表明采用QMSA法计算的结果与外标法测定结果无明显差异,可以在缺少橙黄决明素、大黄酚、大黄素甲醚对照品情况下,通过fk/s及色谱峰定位计算其量,实现决明子药材4种成分质量控制。实验建立的QMSA法为决明子药材及制剂的质量控制提供了新的方法。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 陈 洁, 刘 红. 决明子对心血管系统的药理作用研究进展 [J]. 中国中医药信息杂志, 2005, 7(12): 109-110. |
| [3] | 高 钦, 徐慧琴, 陈建伟, 等. 不同炮制的决明子保肝及润肠通便作用研究 [J]. 中国新药与临床药理, 2007, 3(18): 194-195. |
| [4] | 何宝江, 屈 展, 曾世通. 款冬花和决明子中挥发性成分及抗氧化性质研究 [J]. 中国酿造, 2014, 13(3): 81-82. |
| [5] | 邓响潮, 孙桂波, 宋 威. 决明子蒽醌苷对小鼠免疫功能的调节作用药物研究 [J]. 中国药业, 2007, 11(17): 10-11. |
| [6] | 韩昌志. 决明子煎剂对家兔和狗睫状肌中乳酸脱氢酶活性的影响 [J]. 同济医科大学学报, 1994, 23(6): 470-472. |
| [7] | 韩丽梅, 刘 博. 大扶康与决明子巩固治疗霉菌性阴道炎280例临床观察 [J]. 中国社区医师, 2007, 20(9): 89. |
| [8] | 王智民, 高慧敏, 付雪涛, 等. “一测多评”法中药质量评价模式方法学研究 [J]. 中国中药杂志, 2006, 31(23): 1925-1928. |
| [9] | 杨秀梅, 王 瑾, 黄勤挽, 等. 一测多评法测定陈皮中三种黄酮类成分 [J]. 中国实验方剂学杂志, 2014, 11(20): 45-46. |
| [10] | 谭玉柱, 童婷婷, 赵高琼, 等. 基于一测多评法对大黄地上部位提取物的质量控制研究 [J]. 中草药, 2013, 44(9): 1190-1194. |
| [11] | 胡昌江, 吴珊珊, 吕非非, 等. 一测多评法测定黄柏中五种生物碱 [J]. 中成药, 2014, 13(6): 130-131. |
| [12] | 宋永贵, 张武岗, 刘岩庭, 等. 一测多评法同时测定预知子中4种三萜皂苷 [J]. 中草药, 2012, 43(7): 1418-1421. |
| [13] | 丁梦锦, 邓仙梅, 孟 江, 等一测多评法测定牡丹皮中丹皮酚和3种单萜芍药苷类成分 [J]. 中国实验方剂学杂志, 2014, 20(20): 80-81. |
| [14] | 蓝天凤, 王 晓, 王岱杰, 等. 一测多评法测定丹参中4种丹参酮类成分 [J]. 中草药, 2012, 43(12): 2420-2423. |
| [15] | 寇志华, 安丽萍, 陈 敏. 一测多评法同时测定五味子中六种木脂素类成分含量 [J]. 中国药学杂志, 2014, 24(9): 147-148. |
 2016, Vol. 47
2016, Vol. 47



