植物内生真菌是指在植物体内定植,但不引起植物明显病害的一类真菌[1]。内生真菌与宿主植物具有非常复杂的关系,其能够产生激素促进植物生长[2],也能够产生拒食素帮助宿主抵御生物取食[3],还能够产生药用成分[4]以及众多具有生物活性的产物[5, 6]等。内生真菌分布广泛,种类丰富,而且众多菌株能够产生各式各样的活性天然产物[7]。据统计在2012年前的几十年里,约一半新发现的真菌天然产物来源于内生真菌[8],其中包括大量的具有抗菌活性的天然化合物[5, 9]。
川麦冬Ophiopogon japonicus (L. f.) Ker-Gawl,又称涪城麦冬、绵麦冬,为百合科沿阶草属植物麦冬,是中国名贵传统中药材之一,已有500多年的种植历史。它具有养阴润肺、清热除烦、益胃生津、凉血止血等功效。2006年,国家质检总局批准对涪城麦冬实施地理标志产品保护。药用植物内生真菌目前研究的重点是药用植物资源的充分利用,同时也是获取具有重要研究价值菌株的基础[6, 10]。目前程东庆等[11]观察到麦冬根部存在丰富的菌丝,陈宜涛等[12]也对江浙地区的麦冬根部内生真菌做了初步研究,Liang等[13]对重庆地区的麦冬内生真菌的抗菌活性进行研究,并发现其提取物表现出良好的抗菌活性。但是四川地区作为川麦冬的主产区,关于其内生真菌的研究却未见报道,而且关于麦冬叶部内生真菌也未见报道。为此,本实验收集了野生和大田栽培川麦冬,利用组织块法对其根部和叶部的内生真菌进行了分离纯化,并结合形态学和分子生物学手段,对所得内生真菌的分类地位进行了鉴定,此外利用金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、粪肠球菌和白色念珠菌共5种病原菌为指示剂,对其抗菌活性进行了初步研究,以期明确川麦冬内生真菌分布的多样性和特异性,同时筛选出具有良好抑菌活性的内生真菌,为进一步获得抗菌活性成分奠定基础。
1 材料与方法 1.1 材料与试剂 1.1.1 供试植株供试植株于2015年3月采自四川省绵阳市三台县花园镇的野生型和大田栽培型川麦冬全株。野生型的生长环境为土质疏松、肥沃、排水良好的沙质土壤中,大田栽培型为本地农民长期种植的川麦冬品种。所采样品经绵阳师范学院生命科学与技术学院罗明华教授鉴定为百合科植物川麦冬Ophiopogon japonicus (L. f.) Ker-Gawl。
1.1.2 指示菌株金黄色葡萄球菌Staphyloccocus aureus Rosenbach(革兰阳性菌),大肠埃希菌Escherichia coli (Migula) Castellani & Chalmers(革兰阴性短杆菌),铜绿假单胞菌Pseudomonas aeruginosa (Schroeter) Migula(革兰阴性杆菌),粪肠球菌Enterococcus faecalis Schleifer & Kilpper-Bälz(革兰阳性菌),白色念珠菌Candida albicans (C. P. Robin) Berkhout(真菌)由四川农业大学农学院提供。
1.1.3 试剂DNA提取试剂盒(Fungus DNA Isolation Kit,Cat. No. LB1235)和2×Pfu PCR预混液(2×Pfu PCR Mix,Cat. No. LB2003)购于成都兰博生物科技有限公司。DNA-Marker购于上海天根生物公司。引物ITS1(5’-TCCGTAGGTGAACC-TGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATA-TGC-3’)由北京擎科新业生物技术有限公司合成。其余试剂均为分析纯。
1.2 内生真菌分离纯化与保存分别除去川麦冬的地下茎和地上部分,依次按以下程序消毒:清水冲洗3~4次,75%乙醇漂洗30 min,无菌水冲洗3~5次,0.1%升汞消毒3~5 min,无菌水冲洗5~8次。用无菌刀片将材料切成5 mm×5 mm的小块贴于PDA培养基上,置28 ℃恒温箱中培养5~7 d,并设置超净工作台空气对照,并参考陈鹊所述“印三法”来检查消毒是否彻底[14]。待植物组织周围长出菌丝后,挑少许菌丝到PDA平板上反复纯化4~6代,然后保存菌种。
1.3 内生真菌形态学鉴定将菌丝接种于PDA培养基平板上左右各1个,放入恒温培养箱培养(黄石市恒丰医疗器械有限公司生产,型号SKP-02B)至菌丝长出,再将灭菌的盖玻片插入菌丝边缘,待菌丝爬上玻片约2/5处后,用无菌镊子取出玻片,自然干燥后,放在干净的滴有蒸馏水的载玻片上,利用数码双筒显微镜进行观察,并记录形态特征。
1.4 内生真菌分子生物学鉴定取川麦冬全株发酵后离心,取菌丝冷冻干燥。取(80±5)mg菌丝于2 mL EP管内按照DNA提取试剂盒说明书的步骤采用CTAB法提取内生真菌DNA。按照表 1所示反应体系,以ITS1和ITS4进行PCR反应,95 ℃、5 min,95 ℃、45 s,52 ℃、30 s,72 ℃、3 min,35个循环,72 ℃、15 min扩增ITS1-5.8S rDNA-ITS2序列。对PCR反应产物利用1%的凝胶于120 V电泳30 min,根据Marker判断是否存在400~800 bp大小片段。对于成功扩增目的片段的样品送交北京擎科新业生物技术有限公司进行电泳切胶纯化测序。
|
|
表 1 PCR反应体系 Table 1 PCR amplification system |
将病原菌金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌和粪肠球菌接种于牛肉膏蛋白胨平板培养基上,白色念珠菌接种于PDA平板培养基上,放入35 ℃恒温培养箱培养,待其完全长出备用。准备6个离心管(50 mL),其中5管中加入10 mL的生理盐水,另一管加入9 mL的生理盐水,放入灭菌锅中灭菌20 min后,取出,待冷却备用。先将4种细菌接种到灭菌后的10 mL生理盐水的离心管中,选择浓度为0.1 CFU/mL,轻轻振荡,使其充分混匀。将真菌病原菌(白色念珠菌)接种到10 mL生理盐水的离心管中,轻轻振荡混匀,再用移液枪吸取1 mL转入到装有9 mL生理盐水中,浓度定为0.01 CFU/mL,振荡混匀。将制备好的菌悬液涂布到PDA培养基的平板上,并用涂布棒涂布均匀。
1.5.2 抑菌测试用无菌小试管,在长有内生菌菌落的平板上,打孔10个,将打好的菌饼接种到涂有病原菌的平板上,每个平板放2个菌饼。同时将氨苄青霉素钠和硫酸链霉素分别配制成1.0 mg/mL和1.5 mg/mL溶液,取无菌培养基饼(大小和上述菌饼相同)置于培养基中浸泡24 h后,作为阳性对照。以无浸泡培养基菌饼作为阴性对照。每个处理重复3次,放入28 ℃的恒温箱中培养,随时观察并记录结果。将得到的抑菌圈,采用十字交叉法进行测定抑菌圈直径大小,最后取3个平板的平均值作为最后测量值。
2 结果与分析 2.1 麦冬内生真菌的分离采用组织块法共分离得到27株内生真菌。从野生型川麦冬中分离到22株内生真菌,其中来源于根部的有14株,来源于叶部的有8株,分别为分离菌株数量的51.85%和29.63%。从大田栽培川麦冬中得到5株,其中来源于根部的有3株,来源于叶部的有2株,分别为分离菌株数量的11.11%和7.41%。可见野生型川麦冬内生真菌明显高于大田栽培植株,而且根部内生真菌的数量也明显多于叶部内生真菌,可见内生真菌的分布受环境影响明显,并且具有组织偏好。也说明不同环境下内生真菌丰富,在长期的接触中,有更大概率侵入到植物体内,这与杨明俊等[15]对水仙内生真菌的研究结果一致。此外,空白对照培养基上未长出菌落,说明无环境污染,并且接触表面消毒后材料表面的培养基上也无菌落长出,说明消毒完全,表明所得菌株为来自植物体内真菌。
2.2 内生真菌的形态学研究通过菌落形态和显微结构可以看出(表 2),麦冬内生真菌在生长状态、菌落形态和显微结构上存在较多差异,具有较为丰富的形态多样性,这也预示着其分类地位存在差异,并具有一定的多样性。而且产色素方面也存在较多差异,有产红色素、紫色素、绿色素、黄色素等,而部分真菌仅为白色。此外部分真菌未观察到孢子,既可能其为不产孢真菌,也有可能与培养条件有关。
|
|
表 2 麦冬内生真菌形态描述 Table 2 Morphology characteristics of fungal endophytes isolated from O. japonicas |
通过对川麦冬内生真菌的DNA提取,PCR扩增后对扩增产物进行电泳检测可以发现,所有菌株均扩增出明亮的450~700 bp的目的条带,专一性较好(图 1),表明所用的提取方法,PCR反应体系和反应条件均较合适。对目的条带进行纯化并测序,并将所有序列在NCBI数据库中进行BLAST比对,并将最高匹配度菌株列于表 3中。并且将所有测序序列提交到NCBI数据,其NCBI序列登录号如表 3所示。

|
图 1 利用PCR技术扩增出的麦冬内生真菌ITS1-5.8 S rDNA-ITS2片段凝胶电泳条带 Fig. 1 PCR amplification results of ITS1-5.8 S rDNA-ITS2 of fungal endophytes using ITS1 and ITS4 primers |
|
|
表 3 与NCBI数据库中匹配度高的可培养内生真菌 Table 3 Culturable endophytic fungal closely matching to genbank sequences |
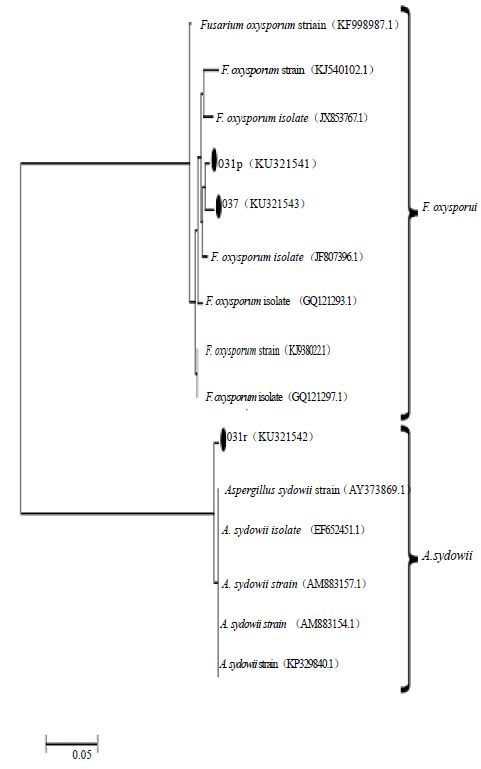
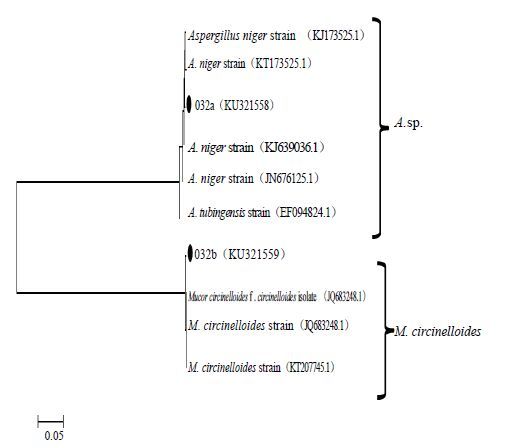
将比对后获得的相似度最高且具有代表性的2~4菌株序列与本研究所得序列一起利用MEGA 5.1软件进行聚类分析,并用NJ法构建系统发育树(图 2~5)。由图 2和图 3比较可见,分离自栽培型内生真菌不仅数量少,其种类相对单一,但是根部和叶部来源的内生真菌均未有相同属的菌株。根部来源的菌株031p和031r根据比对结果和聚类分析结果,同时参考形态学特征被鉴定为尖孢镰刀菌Fusarium oxysporum ;菌株037被鉴定为聚多曲霉Aspergillus sydowii。分离自栽培型叶部的内生真菌032a,其ITS序列比对和聚类分析结果并不完全一致,但是同为Aspergillus属,参考形态特征也只能鉴定为聚多曲酶Aspergillus sp.。而菌株032b被鉴定为Mucor circinelloides。
|
图 2 栽培川麦冬根部内生真菌ITS和5.8 S rDNA序列聚类分析图 (NJ法构建) Fig. 2 NJanalysis of ITS and 5.8S rDNA sequences of fungal endophytes isolated from the roots of cultivated O. japonicas |
|
图 3 栽培川麦冬叶部内生真菌ITS和5.8 S rDNA序列聚类分析图 (NJ法构建) Fig. 3 NJ analysis of ITS and 5. 8S rDNA sequences of fungal endophytes isolated from leaves of cultivated O. japonicas |
|
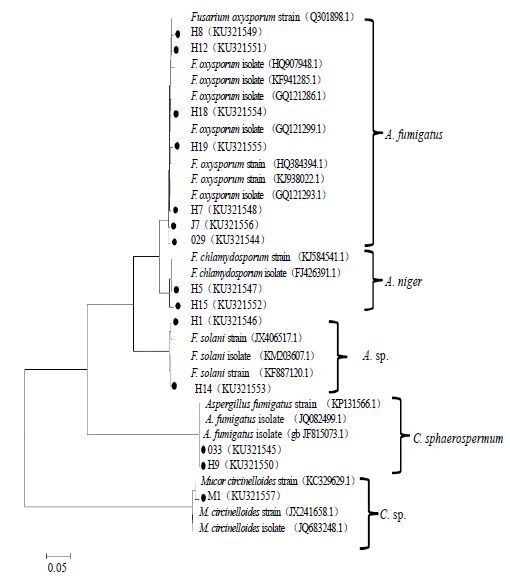
图 4 野生麦冬根部内生真菌ITS和5.8 S rDNA序列聚类分析图 (NJ法构建) Fig. 4 Neighbour-joining analysis of ITS and 5.8 S rDNA sequences of fungal endophytes isolated from roots of wild O. japonicas |

|
图 5 野生川麦冬叶部内生真菌ITS和5.8 S rDNA序列聚类分析图 (NJ法构建) Fig. 5 NJ analysis of ITS and 5.8 S rDNA sequences of fungal endophytes isolated from leaves of wild Ophiopogon japonicas |
根据形态学特征、Blast比对结果和聚类分析,基本上可以将所有来源于野生川麦冬的内生真菌鉴定到种(图 4、5),但是分离自野生川麦冬根部的菌株H5和H15,分离自野生川麦冬叶部的菌株001和008只鉴定到属(图 4、5)。由图 4可见,野生川麦冬根部内生真菌可以分为5个分类群,主要为镰刀菌属Fusariumex Fr.、曲霉菌属Aspergillus Mich. ex Link: Fr. 和毛霉属Mucor Fresenius,其中以镰刀菌占比最大,可见镰刀菌属为其优势菌属,镰刀菌菌株的数量占野生麦冬根部内生真菌的78.57%,而占所有分离得到的菌株比例为40.74%。其次就是曲霉菌属,从野生川麦冬根部分离得到2株本属内生真菌。由图 5可见,从野生川麦冬叶部分离得到的内生真菌也分为5个分类群,主要为曲霉属、炭疽菌属Colletotrichum Cda. 和枝孢属Cladosporium Link。其中以曲霉属占比最大,表明曲霉属内生真菌为野生麦冬叶部的优势菌属。曲霉属菌株的数量占野生麦冬叶部内生真菌的75.00%,而占所有分离得到的菌株比例为22.22%。可见,根部优势菌属与叶优势菌属并不一致,这可能是由根与叶不同的周边环境及其组织特异性所致。就野生麦冬整体内生真菌来说,镰刀菌所占比例最大,为优势均属,而曲霉属其次。
就整体而言,麦冬具有较为丰富的内生真菌,野生型无论是在种类还是在数量上都较大田栽培的麦冬具有更为丰富的内生真菌。可见药用植物麦冬的内生真菌分布同时受宿主植物、植物部位和环境等多方面的因素影响。此外也可能是植物与环境长期相互影响,在野生环境下受人为因素干扰较小,而在栽培条件下,化肥和农药的使用都会影响内生真菌的数量和分布。
2.4 川麦冬内生真菌抗菌活性由表 4可知,有11株菌对白色念珠菌具有抑菌活性,占整个内生真菌数目的40.74%。有2株菌对大肠埃希菌具有明显抑菌活性,占整个内生真菌数目的7.40%。分别有1株对金黄色葡萄球菌、铜绿假单胞菌和粪肠球菌具有明显抑菌活性,其均占3.70%。此外所有内生真菌均表现出只对单一指示菌具有明显抑制作用,表现出明显的抑菌专一性。依据《中药药理学》规定的抑菌能力判断标准:抑菌圈直径<10 mm为低敏,10~14 mm为中敏,15~19 mm为高敏,>20 mm为极敏。可见在所有所得内生真菌中,H5、031p和H8的抑菌圈均大于20 mm,表现出相对较强的抑制活性,值得进一步研究。
|
|
表 4 麦冬内生真菌对金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、粪肠球菌和白色念珠菌的抗菌活性 Table 4 Antimicrobial activity of fungal endophytes isolated from O. japonicas against Staphyloccocus aureus,Escherichia coli,Pseudomonasaeruginosa,Enterococcus faecalis,and Moniliaalbican |
内生真菌广泛存在于植物体内,其种类和数量与宿主植物种类、部位、生长状况,自然环境等密切相关。其与植物长期共生,除受到植物的影响外,在一定程度上也影响植物的生长发育,抗逆境胁迫,与宿主形成互利互惠的共生关系[2, 16, 17, 18]。大量研究表明其存在广泛的生物多样性,作为重要的微生物资源,不仅在生态学上,在医学,农业等方面具有重要的价值[19]。程东庆等[11]通过对麦冬根部切片染色观察的方法发现麦冬根部具有丰富的内生真菌菌丝体。本实验中从野生和大田栽培的麦冬根和叶部位分离得到27株内生真菌,在空间分布上不仅具有营养部位特异性,而且还具有生长环境特异性。在野生麦冬体内分布上无论是数量还是种类都明显较大田栽培丰富,而且根部内生真菌数量也明显多于叶部。杨明俊等[15]在研究水仙内生真菌时也发现水仙根部内生真菌数量远多于其鳞茎,毕江涛等[20]研究桃儿七内生真菌时也发现同样的规律。这可能有多方面的原因,首先是野生环境受到生物或非生物胁迫相对较多,内生真菌具有帮助宿主抵御逆境胁迫的能力,那些具有丰富内生真菌的植株更易生活下去[21, 22]。其次就是在野生环境条件下,其生态群落相对复杂,环境真菌多样性更为丰富,且受人为影响较少(如施用农药),在长期植物与环境、植物与植物间的相互作用必然影响植物内环境[23, 24],从而导致野生麦冬较大田栽培麦冬内生真菌更为丰富,同时也导致根部较叶部内生真菌内生真菌更为丰富。另一方面,镰刀菌属和曲霉菌属内生真菌为麦冬内生真菌的优势菌株在大田和野生麦冬中均有获得,但是镰刀菌属内生真菌均只在麦冬的根部获得,而曲霉菌属在根部和叶部均有获得。可见不同种类内生真菌在麦冬不同部位分布具有一定特异性。陈宜涛等[12]曾从麦冬根部内生真菌中随机选出4株进行鉴定发现,其均为镰刀菌,进一步印证镰刀菌为麦冬根部的优势菌群。这也进一步印证了内生真菌的类群具有组织特异性和分布广泛性[25, 26, 27]。
Liang等[13]研究表明麦冬内生真菌对金黄色酿脓葡萄球菌Staphylococcus aureus和新型隐球菌Cryptococcus neoformans具有良好的抑制活性,但是对大肠杆菌没有抑制作用。本研究利用5种病原菌作为指示菌研究显示,尽管均有对5种病原菌具有抑制活性的菌株存在,但是对大肠埃希菌、铜绿假单胞菌和粪肠球菌抑制的菌株数量极少,而对白色念珠菌具有抑制活性的菌株相对较多,占整个菌株数的40.74%。一方面表明麦冬内生真菌对如大肠埃希菌等普遍抑制活性较低,也表明内生真菌的抑菌谱也具有专一性,且后续研究选择更多供试病原菌种类进行抑菌试验研究,将更有利于了解麦冬内生真菌抗菌活性特点。麦冬内生真菌作为麦冬植物内部重要的微生物资源,具有丰富的多样性,而且也具有良好的抑菌活性。其中菌株H5、031p和H8具有很强的抑菌活性,具有从中挖掘较强抗菌活性成分的潜力,这也是进一步工作的重点之一。
| [1] | 郭良栋. 内生真菌研究进展 [J]. 菌物系统, 2001, 20(1): 148-152. |
| [2] | Khan A L, Hamayun M, Kang S, et al. Endophytic fungal association via gibberellins and indole acetic acid can improve plant growth under abiotic stress: an example of Paecilomyces formosus LHL10 [J]. BMC Micro, 2012, doi: 10.1186/1471-2180-12-3. |
| [3] | 李春杰, 南志标, 张昌吉, 等. 醉马草内生真菌对家兔的影响 [J]. 中国农业科技导报, 2009, 11(2): 84-90. |
| [4] | Pan F, Su X, Hu B, et al. Fusarium redolens 6WBY3, an endophytic fungus isolated from Fritillaria unibracteata var. wabuensis, produces peimisine and imperialine-3β-D-glucoside [J]. Fitoterapia, 2015, 103: 213-221. |
| [5] | Mousa W K, Raizada M N. The diversity of anti-microbial secondary metabolites produced by fungal endophytes: an interdisciplinary perspective [J]. Front Microbiol, 2013, doi:10.3389/fmicb.2013.00065. |
| [6] | Wiyakrutta S, Sriubolmas N, Panphut W, et al. Endophytic fungi with anti-microbial, anti-cancer and anti-malarial activities isolated from Thai medicinal plants [J]. World J Micro Biot, 2004, 20(3): 265-272. |
| [7] | Kumar S, Kaushik N. Metabolites of endophytic fungi as novel source of biofungicide: a review [J]. Phyto Rev, 2012, 11(4): 507-522. |
| [8] | Bérdy J. Thoughts and facts about antibiotics: where we are now and where we are heading [J]. J Antibioti, 2012, 65(8): 385-395. |
| [9] | Stierle A A, Stierle D B. Bioactive secondary metabolites produced by the fungal endophytes of conifers [J]. Nat prod communicat, 2015, 10(10): 1671-1682. |
| [10] | Xiang L, Gong S, Yang L, et al. Biocontrol potential of endophytic fungi in medicinal plants from Wuhan Botanical Garden in China [J]. Biol Control, 2016, 94: 47-55. |
| [11] | 程东庆, 余志仁, 潘佩蕾, 等. 麦冬内生真菌与麦冬生长周期 [J]. 中药材, 2006, 29(3): 205-206. |
| [12] | 陈宜涛, 丁立孝, 程东庆, 等. 麦冬内生真菌镰刀菌的分离鉴定 [J]. 莱阳农学院学报, 2006, 23(1): 13-16. |
| [13] | Liang H, Xing Y, Chen J, et al. Antimicrobial activities of endophytic fungi isolated from Ophiopogon japonicus (Liliaceae) [J]. BMC Compl Alter Med, 2012, 12(1): 1-6. |
| [14] | 陈 鹊. 川贝母内生真菌及其次生代谢产物的研究 [D]. 成都: 四川农业大学农学院, 2012. |
| [15] | 杨明俊, 李 娟, 王永刚, 等. 水仙内生真菌的分离鉴定及聚类分析 [J]. 中草药, 2014, 45(11): 1625-1630. |
| [16] | Zhang H W, Song Y C, Tan R X. Biology and chemistry of endophytes [J]. Nat Prod Reports, 2006, 23(5): 753-771. |
| [17] | Rodriguez R J, White Jr J F, Arnold A E, et al. Fungal endophytes: diversity and functional roles [J]. New Phytol, 2009, 182(2): 314-330. |
| [18] | Shoresh M, Harman G E, Mastouri F. Induced systemic resistance and plant responses to fungal biocontrol agents [J]. Ann Rev Phyto, 2010, 48: 21-43. |
| [19] | 文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题 [J]. 生态学杂志, 2004, 23(2): 86-91. |
| [20] | 毕江涛, 何 萍, 吕 雯, 等. 桃儿七内生真菌分离及其抑菌活性初步研究 [J]. 中草药, 2013, 44(12): 1667-1672. |
| [21] | Khan A L, Hussain J, Al-Harrasi A, et al. Endophytic fungi: resource for gibberellins and crop abiotic stress resistance [J]. Criti Rev Biotechnol, 2013, 35(1): 62-74. |
| [22] | Rodriguez R, Redman R. More than 400 million years of evolution and some plants still can't make it on their own: plant stress tolerance via fungal symbiosis [J]. J Exper Bot, 2008, 59(5): 1109-1114. |
| [23] | 杜 峰, 梁宗锁, 胡莉娟. 植物竞争研究综述 3 [J]. 生态学杂志, 2004, 23(4): 157-163. |
| [24] | 孔垂华, 徐 涛, 胡 飞, 等. 环境胁迫下植物的化感作用及其诱导机制 [J]. 生态学报, 2000, 20(5): 849-854. |
| [25] | 王 涛, 游 玲, 崔晓龙, 等. 四川宜宾三种乔木内生真菌的多样性 [J]. 微生物学通报, 2009, 36(3): 339-344. |
| [26] | Dong Y, Iniguez A L, Ahmer B M, et al. Kinetics and strain specificity of rhizosphere and endophytic colonization by enteric bacteria on seedlings of Medicago sativa and Medicago truncatula [J]. Appl Environ Micro, 2003, 69(3): 1783-1790. |
| [27] | 俞晓平, 陈列忠, 申屠旭萍. 植物内生菌及其代谢物在生物农药创制中的应用 [J]. 浙江农业学报, 2006, 18(5): 289-293. |
 2016, Vol. 47
2016, Vol. 47

