味苦、性微寒,归肺、心、小肠经,具有清热解毒、消肿散结、疏散风热之功效[1, 2]。现代药理研究表明其具有抗菌、抗炎、抗病毒、抗氧化、调血脂等作用。连翘主要含苯乙醇苷类、木脂素类、三萜类、黄酮类、C6-C2天然醇类及挥发油类等成分[3, 4, 5]。《中国药典》2015年版收载的连翘为木犀科植物连翘Forsythia suspensa (Thunb.) Vahl的干燥果实,依据果实的成熟度分为青翘(秋季果实初熟尚带绿色时采收,除去杂质,蒸熟,晒干)和老翘(果实熟透时采收,晒干,除去杂质)[1]。连翘广泛分布于我国山西、河南、河北、陕西、湖北、四川等地,其中市场上50%以上的连翘药材资源由山西供给[6, 7],目前市场上青翘为连翘药材的主要商品来源。
青翘是指连翘初熟尚带绿色的果实经过蒸熟、晒干等产地初加工过程而形成,这一蒸熟、晒干的过程习称为“杀青”。“杀青”是药材初加工的重要环节,该环节对青翘品质有重要影响,其是通过一定的方法和条件破坏鲜活药材中的各类酶活性,从而抑制化学成分的酶促反应及水解反应[8, 9]。常采用的“杀青”方法有晒青、蒸制及煮制。关于这方面的文献报道主要集中在不同的“杀青”技术比较及工艺的优化[10, 11, 12, 13, 14, 15]。而关于生品与杀青品化学成分的比较研究报道较少,本课题组前期研究发现连翘生品与杀青品相比,连翘酯苷A显著降低[16, 17],上述研究在一定程度上解释了连翘杀青环节的重要性,但由于连翘药材的化学成分复杂,仅以连翘酯苷A为检测指标无法全面评价“杀青”对连翘化学成分的影响,仍需对其进行整体化学组成分析。
代谢组学是一种以高通量检测和数据处理为手段,对代谢物进行无差别全面分析的技术,适合于植物尤其是传统中药等复杂体系分析[18]。基于核磁共振氢谱(1H-NMR)的代谢组学分析技术具有备样方法简单、重现性好、分析时间短、可以获得几乎全部含氢化合物信息的优点[19],目前已成功应用于人参[20]、当归[21]、白芍[22]、远志[23]等多种药材的化学分析。因此,本研究拟采用基于1H-NMR的代谢组学技术从整体化学物质组成角度研究“杀青”对连翘化学成分的影响,阐释连翘药材产地初加工“杀青”环节对于连翘药材品质的重要性及科学性。
1 材料本实验所用连翘果实于2014年8月27日采摘于山西太原山西大学校园6株连翘,样品经山西大学张立伟教授鉴定为木犀科植物连翘Forsythia suspense (Thunb) Vahl的未完全成熟果实(青翘),采集后样品分成2份,一份直接阴干备用(生品,RF);另一份按本课题组建立的杀青工艺[24],加水量为鲜连翘的6倍,沸水煮8 min,平摊开,阴干后备用(杀青品,DF);标本保存在山西大学分子科学研究所。NMR试剂D2O购于Norell(Landisville,美国);Methanol-d4(99.8%)购于Merck(Darmstadt,德国);NaOD购于Armar(Dottingen,瑞典);3-(三甲硅烷基)丙酸-d4钠盐(TSP)购于Cambridge Isotope Laboratories Inc.(Andover,MA),其余试剂均为分析纯。
Bruker AVANCE Ⅲ 600 MHz NMR spectrometer(600.13 MHz proton frequency,德国布鲁克公司600 MHz磁仪);SC-3610低速离心机(安徽中科中佳科学仪器有限公司);TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司);超声波清洗器(KQ5200E,昆山市超声仪器有限公司);旋转蒸发仪(RE-52A,上海亚荣生化仪器厂)。
2 方法 2.1 样品制备分别称取各样品粉末300 mg,置于10 mL具塞离心管中,加入甲醇和水各3 mL,先涡旋混匀1 min,再超声提取25 min后,室温下离心(3 500 r/min)30 min,移取上清液至25 mL圆底烧瓶中,减压浓缩蒸干,置干燥器中。于测定前用氘代甲醇400 μL与重水缓冲液(KH2PO4溶于D2O中,以1 mol/L NaOD溶液调节pH值至6.0,含0.05% TSP)400 μL溶解,然后转移至1.5 mL离心管中,低温离心(13 000 r/min)10 min,取上清液600 μL于5 mm核磁管中,待测。
2.2 1H-NMR测定样品于600 MHz NMR(25 ℃)仪上测定,采用noesygppr1d脉冲序列,扫描次数为64,谱宽12 345.7 Hz,脉冲角度90°,采样时间2.654 2 s,延迟时间1.0 s,采样数据点65 536,采样间隔40.5 μs,内标为TSP。
2.3 数据分析核磁图谱采用MestReNova(version 8.0.1,Mestrelab Research,Santiago de Compostella,西班牙)进行处理。核磁图谱经过定标、手动相位、基线校准后,以0.04积分段对化学位移δ 0.5~10.0进行分段积分,其中δ 4.76~4.94(残余水峰)和δ 3.30~3.38(残余甲醇峰)不进行积分。将积分数据导入SIMCA-P 13.0(Umetrics,Sweden)软件中进行主成分分析(principal component analysis,PCA),再用偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal PLS-DA,OPLS-DA)找出差异代谢物,并用SPSS16.0软件对代谢物采用独立样本t检验进行分析。
3 结果 3.1 1H-NMR代谢物指认连翘生品与杀青品的1H-NMR图谱如图 1所示,通过与对照品、BMRB(www.bmrb.wisc.edu.com)数据库中的标准物质及文献报道数据[25, 26, 27, 28, 29]对照,共指认出24个代谢产物(表 1)。1H-NMR图谱可以大致分为3个区域:有机酸和氨基酸区(δ 3.10~0.00)主要包括缬氨酸、丙氨酸、精氨酸、苹果酸、琥珀酸等,此外该区还有苯乙醇苷类及C6-C2天然醇类次生代谢产物的甲基信号,如连翘酯苷A(δ 1.22,d)、连翘酯苷C(δ 1.25,d)、连翘环己醇(δ 1.73,t)、连翘环己醇苷(δ 2.02,t)、芦丁(δ 1.14,d)、棘木苷(δ 2.12,t)等。糖区(δ 5.50~3.10)鉴定的成分包括α-葡萄糖、β-葡萄糖、蔗糖、木糖和棉籽糖等。芳香区(δ 9.50~5.50)主要是苯乙醇苷类、C6-C2天然醇类、木脂素、黄酮类化合物及含苯环的氨基酸类的信号,主要包括连翘酯苷A(7.63,d;7.16,d;7.06,dd;6.90,d;6.81,d;6.68,dd),连翘酯苷C(7.62,d;6.41,d),芦丁(δ 7.69,d),连翘苷(δ 7.18,d),棘木苷(δ 7.11,d;δ 6.24,dd),连翘环己醇酮(δ 6.05,d),没食子酸(δ 7.00,s)以及苯丙氨酸(δ 7.40,m;7.31,d)等。
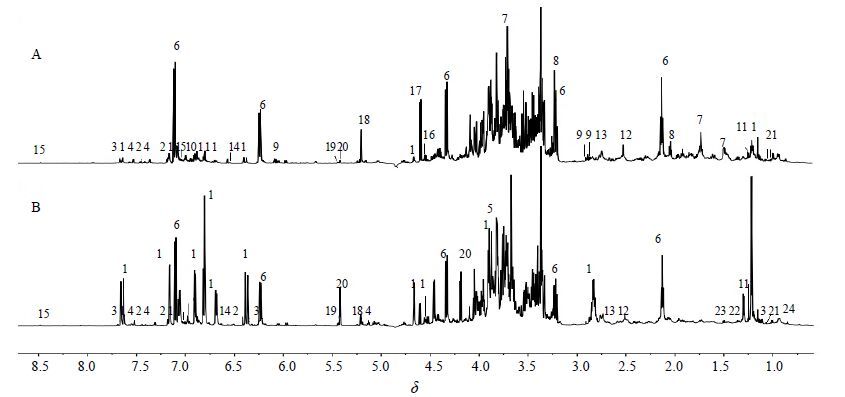
|
1~24编号见表 1 Numbers of 1—24 corresponded with those in Table 1 图 1 连翘生品 (A) 与杀青品 (B) 的1H-NMR图谱 Fig. 1 1H-NMR spectra of RF (A) and DF (B) |
|
|
表 1 连翘生品与杀青品中部分代谢产物1H-NMR数据归属 Table 1 Assignments of 1H-NMR spectral peaks obtained from RF and DF |
直观分析显示“杀青”对连翘药材化学成分的影响主要表现在芳香区苯乙醇苷类的信号,说明“杀青”可明显抑制苯乙醇苷类尤其是连翘酯苷A的降解;而连翘生品中蔗糖信号显著降低,葡萄糖信号明显增强。以下采用多元统计分析进一步揭示连翘生品与杀青品的化学差异。
3.2 多元统计分析PCA分析是最早且最广泛应用于代谢组学领域的多元统计分析方法,是采用线性投影将原来的多个变量转换转化成一组新的正交变量的一种无监督的模式识别方法。通过对原始数据降维,降低了问题的复杂性,能反映数据的原始状态,可获取数据的可视化总览[30]。但是PCA不能忽略与研究目的无关的组内误差和随机误差,因而分类判别能力弱于有监督的模式识别方法(PLS-DA和OPLS-DA)[31]。为了阐明“杀青”导致的连翘化学成分变化,对连翘生品和杀青品进行PCA、PLS-DA及OPLS-DA分析。
图 2-A为生品和杀青品的PCA散点图,由主成分1(t[1]:45.3%)和主成分2(t[2]:14.9%)为坐标构建的二维得分散点图,生品和杀青品可明显区分,而且“杀青”后的连翘样本更集中,即组内差异小于生品,说明经过“杀青”处理可提高连翘药材的均一性。然后通过有监督的模式识别分析方法OPLS-DA确定生品和杀青品连翘样本的差异代谢物。首先以PLS-DA分析的排列实验对模型进行有效性验证,可见原始模型的预测能力大于任何一次随机排列变量(y)的预测能力(图 2-B),即模型有效可靠,可进一步通过OPLS-DA分析寻找差异代谢物[32]。图 2-C为生品和杀青品OPLS-DA得分散点图(R2=0.787,Q2=0.975,CV-ANOVA验证的P=7.92×10−6),通过相应的S-plot图(图 2-D)与ⅥP值(ⅥP>1.0)结合分析确定,杀青品中连翘酯苷A、连翘酯苷C、连翘苷、芦丁、蔗糖的量较高,而生品中连翘环己醇及其苷、连翘环己醇酮、α-葡萄糖、β-葡萄糖的量较高。
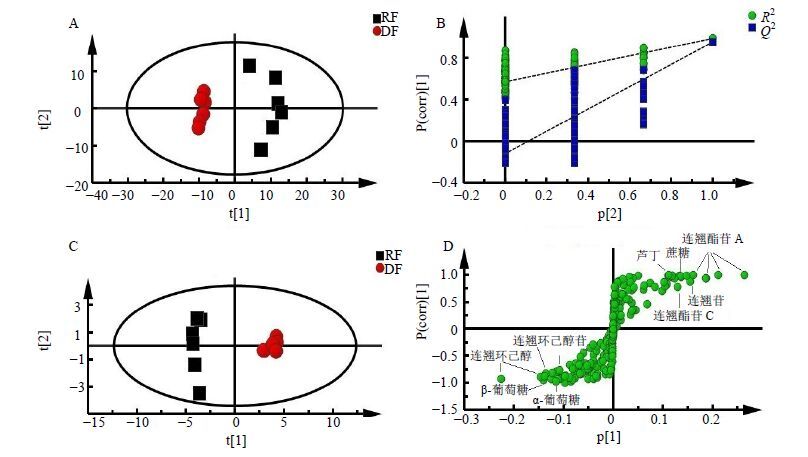
|
A-PCA得分图,B-置换检验,C-OPLS-DA得分图,D-S-Plot图 A-PCA score plots,B-permutation test with 200 permutations of PLS-DA model,R2 = (0.0,0.574),Q2 = (0.0~0.118),C-OPLS-DA score plots,D-S-plot 图 2 连翘生品 (RF) 与杀青品 (DF) 的多元统计分析 Fig. 2 Multiple statistical analysis of RF and DF |
此外,以TSP为内标,对上述差异代谢物通过积分面积进行半定量分析,并用SPSS 16.0软件进行独立样本t检验(n=6),结果与多元统计分析一致(图 3)。
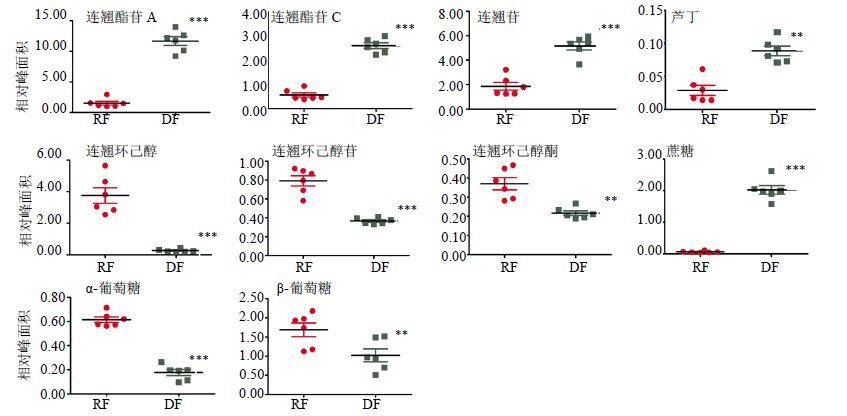
|
与连翘生品比较:**P<0.01 ***P<0.001 **P < 0.01 ***P < 0.001 vs RF 图 3 连翘生品 (RF) 和杀青品 (DF) 1H-NMR图谱中差异代谢物的相对峰面积 Fig. 3 Scatter-plot of relative peak areas of significant metabolites in 1H-NMR spectra of RF and DF |
连翘酯苷A是目前从连翘中分离得到的活性最高的化合物之一,具有较好的抗氧化、抗菌及抑制碱性磷酸酶等活性,且连翘酯苷A也是评价连翘质量的指标性成分之一[33]。前期研究证实连翘中确实含有一类降解连翘酯苷A的酶,而高温蒸煮可使这类酶失去活性,所以“杀青”是使这类酶迅速失去活性的重要环节[17],从而抑制连翘酯苷A发生降解。并且通过比较连翘生品和杀青品的化学成分,显示生品中连翘环己醇、连翘环己醇苷、连翘环己醇酮等C6-C2天然醇类的量明显升高,而这些化合物与连翘酯苷A在生源上密切相关。因此,结合文献中这类成分的生物合成途径[34, 35],推测了连翘酯苷A可能的降解途径:首先在糖苷酶的作用下先水解失去咖啡酸转变成连翘酯苷E,进而在另一种糖苷酶的作用下失去鼠李糖,转变成3,4-二羟基苯乙醇葡萄糖苷,再在一系列转移酶和还原酶系的作用下转化成连翘环己醇苷,而后在糖苷酶的作用下最终转化为连翘环己醇。
4 讨论本研究采用基于核磁共振的代谢组学技术研究了“杀青”对连翘代谢物轮廓及代谢产物的影响,并结合多元统计分析确定了连翘生品与杀青品的10个差异成分:连翘杀青品中连翘酯苷A、C和连翘苷、芦丁及初生代谢物蔗糖的量高于生品,而连翘环己醇及其苷、连翘环己醇酮、α-葡萄糖、β-葡萄糖的量低于连翘生品。连翘生品中这些成分升高的原因可能是连翘酯苷A、C、连翘苷、芦丁及蔗糖被鲜果中水解酶,裂解酶等酶解所致,即“杀青”这一产地加工过程可有效避免连翘中苯乙醇苷类如连翘酯苷A,木脂素类如连翘苷,黄酮类如芦丁,以及一些初级代谢物(如蔗糖)被酶解。这些在“杀青”过程得以保存的成分与连翘功效的相关性有待进一步研究。连翘中连翘酯苷A的量较高,在连翘生品与杀青品中的差异也最为显著,本研究结合这类成分的生物合成途径首次推测了连翘酯苷A可能的降解途径。
核磁共振技术可以同时表征药材中的初级和次级代谢物,获得药材中相对完整的化学信息,适合于中药材中多种成分的同时分析,但其灵敏度较低,量相对较低的代谢物难以检测。在后续的工作中还将通过多种分析联用技术如LC-MS等进行全面的化学表征,进一步阐释“杀青”对连翘药材品质的影响及其科学内涵。
| [1] | 中国药典 [S]. 一部. 2015. |
| [2] | 王 宁. 连翘的本草考证 [J]. 中药材, 2013, 34(4): 670-674. |
| [3] | 支旭然, 苑 霖, 生 宁, 等. HPLC-MS/MS法测定不同采收期连翘叶中9种成分 [J]. 中草药, 2013, 44(22): 3231-3235. |
| [4] | 张海燕. 连翘化学成分及药理活性的研究进展 [J]. 中药材, 2000, 23(10): 657-660. |
| [5] | 付云飞, 李 清, 毕开顺. RP-HPLC法同时测定不同产地连翘中的7种成分 [J]. 中草药, 2013, 44(8): 1043-1046. |
| [6] | 滕训辉. 山西野生连翘资源保护与可持续利用研究 [J]. 中国医药导报, 2010, 7(34): 81-82. |
| [7] | 王进明, 王瑞娜, 范圣此. 野生连翘资源调查与分析 [J]. 安徽农业科学, 2012, 40(15): 8483-8484. |
| [8] | 段金廒, 宿树兰, 严 辉, 等. 药材初加工“杀青”环节的科学性与适宜性分析 [A]//全国第9届天然药物资源学术研讨会论文集 [C]. 广州: 中国自然资源学会天然药物资源专业委员会, 2010. |
| [9] | 段金廒, 宿树兰, 严 辉, 等. 药材初加工“杀青”环节与药材品质形成的探讨 [J]. 中药材, 2011, 34(1): 1-4. |
| [10] | 卢玉兰. 不同炮制方法对连翘中连翘苷含量的影响 [J]. 西部中医药, 2011, 24(8): 23-24. |
| [11] | 赵 超, 郑伶俐, 胡亚刚, 等. 陕西道地药材连翘鲜品蒸煮工艺研究 [J]. 时珍国医国药, 2011, 22(2): 438-440. |
| [12] | 张淑蓉, 裴香萍, 梁学伟, 等. 青翘炮制方法的研究 [J]. 中国实验方剂学杂志, 2010, 16(18): 33-35. |
| [13] | 张 涛, 陈学松. 连翘不同炮制品中连翘苷的HPLC测定 [J]. 中草药, 2005, 36(9): 1339-1340. |
| [14] | 周改莲, 辛 宁, 张守平, 等. 连翘不同部位及不同炮制方法的活性成分比较 [J]. 中国中医药信息, 2008, 15(1): 30-31. |
| [15] | 白吉庆, 王小平, 曹林林, 等. 产地加工方法对青翘中连翘苷、连翘酯苷A的影响 [J]. 中国中药杂志, 2011, 36(23): 3258-3261. |
| [16] | 薛智民, 张立伟. 炮制方法对连翘主要化学成分连翘酯苷的影响 [J]. 化学研究与应用, 2011, 63(5): 606-609. |
| [17] | 侯雅楠, 许 佳, 陈廷贵, 等. 连翘鲜果粗酶对连翘酯苷A的酶解作用 [J]. 化学研究与应用, 2013, 25(5): 660-664. |
| [18] | 李震宇, 李爱平, 张福生, 等. 植物代谢组学技术在山西道地药材研究中的应用 [J]. 中草药, 2013, 44(7): 785-789. |
| [19] | Schripsema J. Application of NMR in plant metabolomics techniques, problems and prospects [J]. Phytochem Anal, 2010, 21(1): 14-21. |
| [20] | Yang S O, Shin Y S, Hyun S H, et al. NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages [J]. J Pharm Biomed Anal, 2012, 58(2): 19-26. |
| [21] | Li Z Y, Zhang Z Z, Du G H, et al. Comparative analysis of Danggui and European Danggui using nuclear magnetic resonance-based metabolic fingerprinting [J]. J Pharm Biomed Anal, 2015, 103(16): 44-51. |
| [22] | 李震宇, 范玛丽, 秦雪梅. 基于NMR代谢组学技术的白芍及其醋制品的化学比较 [J]. 药学学报, 2015, 50(2): 211-217. |
| [23] | 王雪洁, 李震宇, 薛水玉, 等. 基于植物代谢组学技术的远志不同炮制品质量控制研究 [J]. 中草药, 2012, 43(9): 785-789. |
| [24] | 姜 涛, 许 佳, 秦 臻, 等. 连翘炮制工艺研究 [J]. 中国中药杂志, 2013, 38(7): 1000-1003. |
| [25] | Endo K, Hikino H. Structures of rengyol, rengyoxide and rengyolone, new cyclohexylethane derivatives from Forsythia Suspensa fruits [J]. Can J Chem, 1984, 62(10): 2011-2014. |
| [26] | Kobler C, Effenberger F. Chemo enzymatic synthesis of rengyol and isorengyol [J]. Tetrahedron, 2006, 62(20): 4823-4828. |
| [27] | Liu N Q, Cao M, Frédérich M, et al. Metabolomic investigation of the ethnopharmacological use of Artemisia afra with NMR spectroscopy and multivariate data analysis [J]. J Ethnopharmacol, 2010, 128(1): 230-235. |
| [28] | Georgiev M I, Ali K, Alipiev K, et al. Metabolic differentiations and classification of Verbascum species by NMR-based metabolomics [J]. Phytochemistry, 2011, 72(16): 2045-2051. |
| [29] | Kim H S, Park S J, Hyun S H, et al. Biochemical monitoring of black raspberry (Rubus coreanus Miquel) fruits according to maturation stage by 1H NMR using multiple solvent systems [J]. Food Res Int, 2011, 44(7): 1977-1987. |
| [30] | 漆小泉, 王玉兰, 陈晓亚. 植物代谢组学-方法与应用 [M]. 北京: 化学工业出版社, 2011. |
| [31] | 徐国旺. 代谢组学方法与应用 [M]. 北京: 科学出版社, 2008. |
| [32] | Eriksson L, Trygg J, Wold S. CV-ANOVA for significance testing of PLS and OPLS models [J]. J Chemom, 2008, 22(11/12): 594-600. |
| [33] | Wang G N, Pan R L, Liao Y H, et al. An LC-MS/MS method for determination of forsythiaside in rat plasma and application to a pharmacokinetic study [J]. J Chromatogr B, 2010, 878(1): 102-106. |
| [34] | Kuwajima H, Takai Y, Takaishi K, et al. Synthesis of 13C-labeled possible intermediates in the biosynthesis of phenylethanoid derivatives, cornoside and rengyosides [J]. Chem Pharm Bull, 1998, 46(4): 581-586. |
| [35] | Seya K, Endo K, Hikino H. Structures of rengyosides A, B and C, three glucosides of Forsythia suspensa fruits [J]. Phytochemistry, 1989, 28(5): 1495-1498. |
 2016, Vol. 47
2016, Vol. 47



