碱性亮氨酸拉链(basic region/leucine zipper motif,bZIP)转录因子广泛存在于动植物和微生物中,参与多种生物学过程,由DNA结合结构域和亮氨酸拉链二聚体这2个基本结构域组成,是转录因子中较大的基因家族,同时bZIP转录因子是真核生物中广泛存在且结构十分保守的一类转录因子[1],主要功能是通过与特定的顺式作用元件的结合来调控下游基因的表达[2]。拟南芥bZIP转录因子研究得比较深入且成果显著,分别参与调控组织分化、细胞生长、糖代谢、生物和非生物胁迫等多个生物过程。小麦TabZIP20转录因子参与小麦对条锈菌的抗病过程[3],水稻中的OsbZIP1不仅受到ABA和MeJA等激素诱导而且参与到稻瘟病菌的防御应答[4]。
红花Carthamus tinctorius L. 是我国传统的中草药,又叫草红花、金红花,为1~2年生菊科植物红花的管状花,又是新型的油用植物和工业用植物,经济价值高,具有较大的开发潜力,是我国各地有待开发的经济作物。红花为常用中药,用量大,味辛、性温、归心、肝经,具有活血化瘀、止痛的功能,用于治疗经闭、痛经、跌打损伤、疮疡肿痛等症,并对冠心病、心绞痛、血管栓塞性疾病、传染性肝炎也有一定疗效[5, 6, 7, 8, 9]。根腐病是红花生产过程中的重大病害之一,由尖孢镰刀菌Fusarium oxysporum引起,危害幼苗、成株和花球,造成产量和品质下降,给菜农带来一定的损失[10, 11]。分子育种是培育新品种的重要途径之一,利用现代分子生物学技术,挖掘与红花抗病、抗逆以及红花黄色素合成相关的功能基因,将为分子育种提供重要的目标基因。
本实验室从红花中克隆到1个编码bZIP蛋白的基因,命名为CtbZIP20,之前的转录组(SRA047279.2)研究显示,红花中有19个bZIP类转录因子[12],这些转录因子很可能参与红花生长发育和次生代谢的调控过程。目前,bZIP类转录因子在拟南芥中研究较多,而在红花中只克隆得到CtbZIP20基因。本研究从红花转录组中得到了1条bZIP类转录因子的unigene,在序列分析的基础上,研究了CtbZIP20基因在不同组织及尖孢镰刀菌侵染下的表达模式,同时构建植物表达载体,以期为该基因功能鉴定和抗逆分子育种奠定基础。
1 材料与方法 1.1 材料红花样品采自吉林农业大学种植基地,发育至苗期阶段后经由吉林农业大学胡全德教授鉴定为药源植物红花Carthamus tinctorius L.。红花根腐病病原菌:尖孢镰刀菌Fusarium oxysporum由吉林农业大学植物病理系高杰教授馈赠。
1.2 方法 1.2.1 实验设计与处理组培红花苗栽培在无菌石英砂中,培养温度为28 ℃,相对湿度为(70±10)%,每天光照时间为14 h。待红花幼苗长至5~6叶期时,随机选30株幼苗在浓度为1×106个/mL的尖孢镰刀菌悬浮液中浸根2 h,另选30株幼苗在无菌水中浸根相同时间。试验共计2个处理,即对照(NI)和接种病原菌处理(I)。接种病原菌之后,于2 d采红花根部[13]。每次样品采集之后液氮冻干,保存于−20 ℃冰箱中,样品采集完成后用于提取总RNA。同时,取红花的茎、叶、种子和花,不同花期的花瓣经液氮速冻,−80 ℃保存,用于提取总RNA。
1.2.2 RNA提取和cDNA合成取红花组织置于液氮中研碎,总RNA提取方法按照Trizol试剂说明书进行;并于−80 ℃保存备用。cDNA合成根据Biotek公司反转录试剂盒操作进行,反转录产物分离纯化后置于−20 ℃保存备用。
1.2.3 CtbZIP20基因的克隆及序列分析根据基因编码区序列特异引物bZIP20-F、bZIP20-R(表 1),以红花花瓣cDNA为模板进行PCR扩增。反应程序为94 ℃预变性5 min;94 ℃、30 s,62 ℃、1 min、72 ℃、90 s,35个循环;72 ℃、10 min,4 ℃终止反应。将目的条带切胶回收后克隆到pEASY-T1载体并进行测序,分析测序结果与所拼接得到的全长序列的一致性。
|
|
表 1 扩增CtbZIP20基因及qRT-PCR所用的引物序列 Table 1 Primers used for amplification of CtbZIP20 genes and qRT-PCR |
ORF Finder在线软件分析CtbZIP20基因相应的氨基酸序列。将获得的CtbZIP20基因开放阅读框(ORF)序列通过BLAST搜索NCBI的蛋白质和核苷酸数据库,并通过DNAMAN软件翻译成氨基酸序列,利用DNAMAN软件对来源于各种植物的bZIP相关氨基酸序列进行同源比对。相对分子质量与理论等电点(pI)预测采用ExPASy在线服务器的Compute Pi/Mw工具,二级结构预测使用Dublin大学的Porter服务器,三级结构预测使用Swiss-Model服务器,结构功能域分析采用ExPASy在线服务器Prosite Scanprosite。利用TMHMM Server v. 2.0在线软件进行跨膜区预测。利用MEGA5.0软件中的邻位相连(Neighbor-Joining,NJ)法构建系统进化树等。
1.2.5 CtbZIP20基因表达分析取红花种子、花、茎、叶、根,提取RNA,并反转录为cDNA用于real-time PCR分析。定量PCR反应体系为:SYBR Premix Ex Taq(Tli RNaseH Plus)(2×)10 μL;上下游引物(表 1)各0.4 μL;ROX Reference Dye Ⅱ(50×);DNA模板2 μL;ddH2O 6.8 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。
1.2.6 CtbZIP20基因植物表达载体的构建以多克隆位点上游带有CaMV 35S启动子的pBasta载体为骨架,在红花CtbZIP20基因两侧设计含有Xma I和EcoR I酶切位点的引物,克隆到pEASY-T1 simple载体上,测序正确的基因片段经双酶切后连接到pBasta表达载体上,通过质粒酶切和菌液PCR鉴定,验证表达载体是否构建成功。
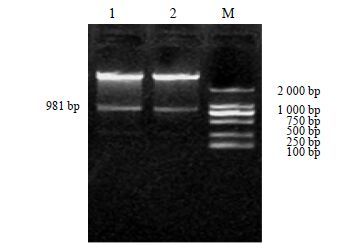
2 结果与分析 2.1 CtbZIP20基因ORF片段的克隆根据CtbZIP20基因编码区序列特异引物(bZIP201-F、bZIP201-R),以红花花瓣cDNA为模板扩增出1条981 bp的条带(图 1)。经回收纯化后,PCR产物与pEASY-T1载体连接,通过菌液PCR验证及双酶切验证后测序结果正确,命名该基因为CtbZIP20(GenBank登录号为KT692605)。
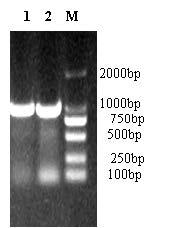
|
M-Marker 1~2-bZIP20基因RT-PCR电泳 M-Marker 1—2-RT-PCR electrophoresis of bZIP20 gene 图 1 基因的克隆 Fig. 1 Cloning of safflower CtbZIP20 gene |
将转录组序列通过电子克隆和序列拼接后得到1 128 bp的序列,经ORF Finder预测,该序列具有完整的ORF。利用RT-PCR引物进行扩增,获得预期长度的产物,将该序列和拟南芥的数据库比对后,由于其具有和拟南芥AtbZIP20最高的同源性,故将其命名为CtbZIP20。与拟南芥bZIP转录因子中的TGA类相似度最高,其中和AtTGA2(又名AtbZIP20,登录号:ABR46126.1)的相似性达到59%。CtbZIP20基因序列具有长为981 bp的完整ORF,共编码326个氨基酸,分C1562H2526N482O500S11,总原子数为5 081。相对分子质量是36 410.8;pI:8.65,带正电残基(Arg+Lys)为40,带负电残基(Asp+Glu)为38。脂肪系数为79.72,亲水性系数为−0.571,表明CtbZIP20是1个水溶性蛋白。InterProScan分析表明47~71位氨基酸具有一个保守的bZIP结构域,125~203位氨基酸具有一个DOG1超级家族保守结构域。
利用DNAMAN和MEGA 5.0软件对CtbZIP20蛋白氨基酸序列与其他物种bZIP蛋白进行比对,结果显示(图 2、3),红花CtbZIP20与芝麻Sesamum indicum Linn.(XP-011075851.1)、野茶树(AGD98703.1)的氨基酸序列相似性高达85.41%和83.99%,表明它们具有极高的同源性。进一步的进化树分析也表明,红花CtbZIP20与芝麻(XP-011075851.1)、野茶树Camellia assamica L.(AGD98703.1)、大豆Glycine max (Linn.) Merr.(NP 001237963.1)、可可Theobroma cacao L.(XP 00702814.3)等亲缘关系较近,但与拟南芥(P43273.1)及大叶藻Zostera marina(KMZ62646.1)的亲缘关系较远。

|
图 2 CtbZIP20编码蛋白与其他物种bZIP的氨基酸序列比对 Fig. 2 Multiple alignment of CtbZIP20 and bZIP from other species |
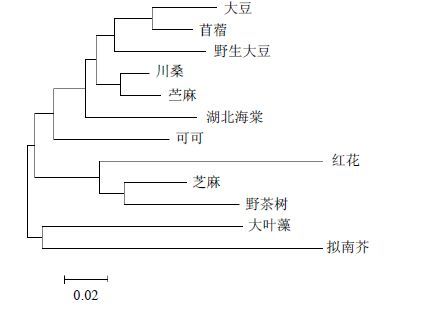
|
图 3 CtbZIP20蛋白与其他11种植物bZIP蛋白的系统进化分析 Fig. 3 Phylogenetic analysis on bZIP20 in safflower with other 11 plant bZIPs |
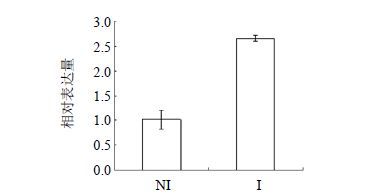
利用RT-PCR技术检测CtbZIP20基因在不同组织中的相对表达量。组织差异表达可为研究基因的功能和调控机制提供依据,本实验选取红花的种子、花、茎、叶和根5个组织对CtbZIP20基因进行了组织差异表达分析。由图 4可知,CtbZIP20在不同组织的表达水平具有显著差异,在花中呈现高表达,而在其他组织中低表达。不同花期CtbZIP20基因的表达水平随着花期的延长逐渐降低,花蕾期最高,衰花期最低(图 5)。通过对NI组和I组的红花根部组织提取RNA并进行荧光定量分析,结果表明(图 6)与对照组相比,接种尖孢镰刀菌的红花根部组织中bZIP20基因的表达显著上调。
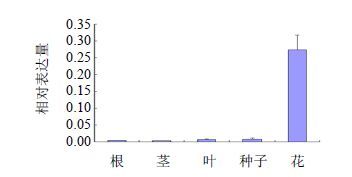
|
图 4 CtbZIP20基因的组织表达分析 Fig. 4 Tissue expression analysis onbZIP20 gene in safflower |
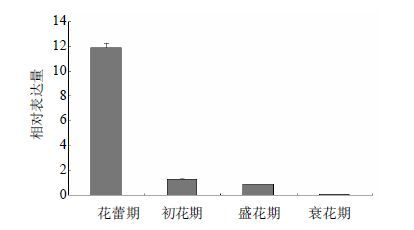
|
图 5 CtbZIP20基因在不同花期的表达分析 Fig. 5 Expression analysis on safflower bZIP20 gene in different blossom periods |
|
图 6 接种尖孢镰刀菌前后红花根部CtbZIP20基因的表达模式 Fig. 6 Transcription pattern of bZIP20 in safflower root pre- and post- incubation with F. oxysporum |
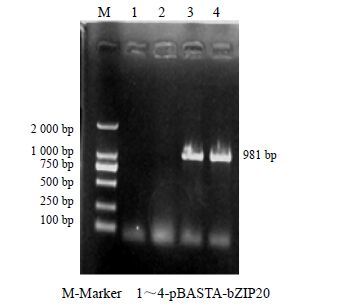
将植物表达载体pBASTA和带有目的基因序列的重组载体pEASY-T-bZIP20分别用Xma I和EcoR I进行双酶切,将目的片段与酶切后的pBASTA载体用T4 DNA连接酶连接后,获得植物表达载体pBASTA-bZIP20。将构建好的植物表达载体转化大肠杆菌DH5α,对重组阳性质粒进行菌液PCR验证(图 7)和双酶切验证(图 8),都获得预期大小为981 bp的目的片段,证明该植物表达载体构建正确。
|
M-Marker 1 and 2-pBASTA-bZIP20 PCR 图 7 植物表达载体pBASTA-bZIP20菌液PCR验证 Fig. 7 PCR verification of bacterium of pBASTA-bZIP20 |
|
M-Marker 1~4-pBASTA-bZIP20 图 8 植物表达载体pBASTA-bZIP20双酶切验证 Fig. 8 Enzyme digestion verification of pBASTA-bZIP20 |
红花在食品、药品领域起着重要作用,是我国重要的油料和经济作物。红花病害的发生和流行一直是影响红花黄色素及红花油产量的重要因素,特别是根腐病、锈病等病害严重影响了红花的产量及品质。因此,通过生物技术手段提高红花品种的抗性,确保红花食品、药品的安全是十分必要的。本课题组已经对红花中基因的克隆与表达进行了大量研究[14, 15, 16]。
植物bZIP转录因子在植物的生命过程中具有非常重要的作用,bZIP不仅参与调控植物的生长发育过程,还参与调控植物抵抗恶劣的自然环境,诸如重金属胁迫、病原菌的入侵、高盐、干旱、寒冷等不利条件[17, 18]。大豆GmbZIP44、GmbZIP62和GmbZIP78作为ABA信号途径中的负调控因子提高转基因拟南芥的耐盐性及耐低温特性;大豆GmbZIP132受到干旱和高盐胁迫的诱导,过表达GmbZIP132的拟南芥表现出低ABA敏感性和高失水率;过表达 GmbZIP1提高拟南芥和烟草的抗旱性、耐盐性及耐低温的特性;高表达野生大豆GsbZIP33的拟南芥对高盐胁迫的敏感性提高[19, 20, 21, 22]。蛋白质三级结构预测显示,CtbZIP20蛋白具有高度保守的由α-螺旋和亮氨酸形成的bZIP结构域,与报道的拟南芥AtbZIP蛋白的三级结构模型相似[18]。
本研究通过对14种植物与克隆得到的CtbZIP20氨基酸序列进行多重比对发现,红花与芝麻、野茶树的氨基酸序列相似性高达85.41%和83.99%,表明它们具有极高的同源性。组织表达分析结果表明,CtbZIP20基因主要在红花花瓣中高表达,而在其他组织中低表达,具有显著的组织表达特异性,同时不同花期CtbZIP20基因的表达水平随着花期的延长逐渐降低,花蕾期最高,衰花期最低,这与刘秀明等[23]报道的CHI基因在不同花期表达趋势相一致,说明CtbZIP20基因很可能参与红花主要药效成分(红花黄色素、黄酮等)的合成;并且接种尖孢镰刀菌的红花根部组织中CtbZIP20基因的表达显著上调,初步说明CtbZIP20很可能参与红花抗病性的调控;同时构建该基因的植物表达载体,为进一步利用CtbZIP20提高红花的抗性研究奠定基础,以推动红花转基因育种的进程。下一步实验会进一步验证CtbZIP20基因在红花花瓣不同发育时期的表达量与红花主要药效成分(红花黄色素或黄酮等)之间的关系,以及将植物表达载体pBASTA-bZIP20转化到红花中,进行CtbZIP20基因的表达及功能验证,期望获得抗病抗逆能力增强或提高红花黄酮类物质量的转基因植物;同时,亦可构建原核表达载体,获得纯化的CtbZIP20蛋白用于EMSA来鉴定CtbZIP20蛋白与元件的作用情况及植物体内CtbZIP20蛋白表达水平的检测,为后期进一步研究红花转录因子CtbZIP20的生物化学和分子生物学功能奠定基础。
| [1] | Glover J M, Harrison S C. Crystal structure of the heterodimeric bZIP transcription factor c-Fos-c-Jun bound to DNA [J]. Nature, 1995, 373: 257-261. |
| [2] | Niu X P, Renshaw G L, Miller L. Bipartite determinants of DNA-binding specificity of plant basic leucine zipper protein [J]. Plant Mol Biol, 1999, 41(1): 1-13. |
| [3] | 魏国荣, 张宁宇, 汤春蕾, 等. 小麦转录因子基因TabZIP20的克隆及其在小麦-条锈菌互作中的表达 [J]. 西北农业学报, 2012, 21(12): 20-25. |
| [4] | Meng X B, Zhao W S, Lin R M, et al. Identification of a novel rice bZIP-type transcription factor gene, OsbZIP, involved in response to infection of Magnaporthe grisea [J]. Plant Mol Biol, 2005, 23(3): 301-313. |
| [5] | Liu Y N, Zhou Z M, Chen P. Evidence that hydroxyl safflor yellow A protects the heart against ischemia-reperfusion injury by inhibiting mitoehondrial permeability transition pore opening [J]. Clin Exper Pharm Physiol, 2008, 35(2): 211-216. |
| [6] | Zhu H B, Zhang L, Wang Z H, et al. Therapeutic effects of hydroxyl safflor yellow A on focal cerebral ischemic injury in rats and its primary mechanisms [J]. J Asian Nat Prod Res, 2005, 7(4): 607-613. |
| [7] | 范 莉, 濮 润, 赵海誉, 等. 红花抗ADP诱导的血小板聚集活性研究 [J]. 中国中药杂志, 2011, 36(9): 1242-1244. |
| [8] | Tian Y, Yang Z F, Li Y, et al. Pharmacokinetic comparisons of hydroxyl safflower yellow A in normal and blood stasis syndrome rats [J]. J Ethnopharmacd, 2010, 129: 1-4. |
| [9] | Han B, Hu J, Shen J, et al. Neuroprotective effect of hydroxyl safflor yellow A on 6-hydroxydopamine-induced Parkinson's disease in rats [J]. Eur J Pharm, 2013, 714(2): 83-88. |
| [10] | 陈招荣, 兰 谱, 于玮玮, 等. 天津地区红花病虫害调查研究 [J]. 河南农业科学, 2014, 43(3): 102-106. |
| [11] | 翟亚娟, 白庆荣, 高 洁, 等. 红花根腐病病原菌鉴定及药剂敏感性研究 [J]. 黑龙江农业科学, 2013(8): 59-61. |
| [12] | Li H Y, Dong Y Y, Yang J, et al. De novo transcriptome of safflower and and the identification of putative genes for oleosin and the biosynthesis of flavonoids [J]. PLoS One, 2012, 7(12): 1-10. |
| [13] | 刘喜梅, 许艳丽, 张 韧, 等. 大豆根组织受尖孢镰刀菌侵染后基因表达反应的cDNA-AFLP分析 [J]. 植物病理学报, 2008, 2(6): 165-170. |
| [14] | 官丽莉, 张 雪, 韩怡来, 等. 红花转录因子CtMYB1基因的克隆及原核表达 [J]. 中草药, 2015, 46(17): 2603-2609. |
| [15] | 王艳芳, 张 娜, 张 玲, 等. 红花天冬氨酸激酶基因片段的分离及表达分析 [J]. 中草药, 2015, 46(20): 3065-3070. |
| [16] | 代斯宁, 王文玲, 韩怡来, 等. 红花2-甲基-6-叶绿基-1,4-苯醌甲基转移酶基因的克隆及表达分析 [J]. 中草药, 2015, 46(18): 2774-2780. |
| [17] | Liu L, White M J, MacRae T H. Transcription factors and their genes in higher plants [J]. Eur J Biochem, 1999, 262(2): 247-257. |
| [18] | Inaba S, Kurata R, Kobayashi M, et al. Identification of putative target genes of bZIP19, a transcription factor essential for Arabidopsis adaptation to Zn deficiency in roots [J]. Plant J, 2015, 26: 12-19. |
| [19] | Liao Y, Zhang J S, Chen S Y, et al. Role of soybean GmbZIP132 under abscisic acid and salt stresses [J]. J Integr Plant Biol, 2008, 50(2): 221-230. |
| [20] | Liao Y, Zou H F, Wei W, et al. Soybean GmbZIP44, GmbZIP62 and GmbZIP78 genes function as negative regulator of ABA signaling and confer salt and freezing tolerance in transgenic Arabidopsis [J]. Planta, 2008, 228(2): 225-240. |
| [21] | Gao S Q, Chen M, Xu Z S, et al. The soybean GmbZIP1 transcrip-tion factor enhances multiple abiotic stress tolerances in transgenic plants [J]. Plant Mol Biol, 2011, 75(6): 537-553. |
| [22] | 才 华, 朱延明, 柏 锡, 等. 野生大豆GsbZIP33基因的分离及胁迫耐性分析 [J]. 分子植物育种, 2011, 9(4): 397-401. |
| [23] | 刘秀明, 张 宇, 姚 娜, 等. 红花 (Carthamus tinctorius L.) 不同开花时期的转录组测序及黄酮合成相关基因的验证 [J]. 中国细胞生物学学报, 2015, 37(9): 1207-1215. |
 2016, Vol. 47
2016, Vol. 47


