胃癌是世界上发病率最高的癌症之一,在我国胃癌发病率在各种恶性肿瘤中居首位,在所有恶性肿瘤中其肿瘤相关死亡率更高,居第2位。由于胃癌早期症状不明显,就诊时患者多处于进展期,大多数已发生淋巴道转移或者周围浸润[1]。正因为胃癌的早期症状不明显,就诊时多发生转移,胃癌切除术后,复发和转移率较高。由于胃癌的高转移率,患者一般预后差、化疗敏感性低,严重制约着胃癌患者生存率的提高[2],迫切需要寻找到或者开发出新型抗肿瘤转移的有效药物。以基质金属蛋白酶(matrix metalloproteinases,MMPs)天然抑制剂-金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases,TIMPs)为切入点的新药研究日益受到关注。传统中药南蛇藤Celastrus orbiculatus Thunb. 为卫矛科(Celastraceae)南蛇藤属Celastrus L. 植物,是中国重要的药用植物。前期实验研究发现,南蛇藤提取物(Celastrus orbiculatus extracts,COE)能显著抑制肿瘤细胞的侵袭和转移[3, 4, 5, 6],而COE抑制肿瘤细胞侵袭转移的生物学机制尚不完全清楚,前期研究也只揭开了COE抑制胃癌转移和侵袭部分通路和机制,而COE通过调控MMPs及TIMPs的研究,国内外未见文献报道。前期研究表明南蛇藤提取物对人胃癌SGC-7901裸鼠移植瘤生长具有抑制作用[7],本实验在课题组前期研究成果基础上,深入研究COE通过调控MMPs和TIMPs抑制人胃癌SGC-7901细胞侵袭、转移的作用机制,为研发治疗胃癌术后预防复发和转移的新药奠定基础,COE有望成为新型的抗肿瘤转移中药。
1 材料 1.1 药物南蛇藤购自广州致信药业有限公司(批号070510),经中国药科大学中药资源研究室秦民坚教授鉴定为卫矛科南蛇藤属植物南蛇藤Celastrus orbiculatus Thunb.。将南蛇藤藤茎切段,粉碎成粉,95%乙醇加热回流提取3次,回收溶剂至干,加水分散后,用石油醚和醋酸乙酯分别萃取3次,回收溶剂后减压浓缩并进行真空冻干,得到醋酸乙酯部位,即COE,其中含总萜类化合物68.3%[8, 9]。
1.2 细胞株和试剂人胃癌细胞株SGC-7901(中国科学院上海细胞库)。RPMI 1640细胞培养基(Gibco公司),胎牛血清(Hyclone公司),胰蛋白酶、MTT粉剂、Matrigel、Transwell小室(BD公司),MMP-2、MMP-9、TIMP1和TIMP3单克隆抗体(Millipore公司),姜黄素(Sigma公司),β-actin(Cell Signaling公司),HRP标记的羊抗兔IgG(Bioworld 公司)。
1.3 仪器蛋白电泳槽、全自动酶标板分析仪、SDS-PAGE凝胶成像分析仪(美国Bio-Rad公司);正置荧光显微镜(日本Olympus公司);RT-PCR仪(Roch公司)。
2 方法 2.1 MTT法检测细胞增殖消化人胃癌SGC-7901细胞,重悬成单细胞悬液(3×104~4×104个/mL),均匀接种100 μL于96孔培养板中,使每孔细胞数在3 000~4 000个。细胞接种12 h后,设置对照组、COE(质量浓度分别为10、20、40、80、160、320 mg/L)组和姜黄素(20 μmol/L)阳性对照组,每孔加入100 μL含药培养液,对照组加无药培养基(等量的RPMI 1640培养基)。分别孵育24、48、72 h后,每孔加入5% MTT 20 μL,继续孵育4 h,弃上清,每孔加入DMSO 150 μL。全自动酶标仪中速振荡10 min,充分溶解结晶物。490 nm波长测定每孔的吸光度(A)值。计算细胞增殖率。
细胞增殖率=药物组A值/对照组A值
2.2 细胞侵袭实验Transwell小室膜底部用Matrigel稀释胶包被、水化。细胞在6孔板中培养,分别设对照组、COE(质量浓度分别为20、40、80 mg/L)组、姜黄素(20 μmol/L)组,培养24 h后,消化各组细胞,用无血清RPMI 1640培养液重悬成单细胞悬液,细胞浓度到5×105个/mL,Transwell上室加入200 μL单细胞悬液,下室加入含10% FBS的RPMI 1640培养液500 μL。不同组细胞均设复孔5个,继续培养24 h,取出Transwell小室用PBS轻轻洗2遍,用棉签擦去上室膜表面的细胞。甲醇固定30 min,0.1%结晶紫室温下染色20 min,PBS清洗3遍使结晶紫完全冲干净,在高倍镜下计数穿膜下室细胞数量,取四周和中间5个视野,计算平均值。
2.3 细胞迁移实验Transwell小室膜底部不用Matrigel稀释胶包被,其余步骤同“2.2”项实验。
2.4 MMP2、MMP9、TIMP1、TIMP3蛋白的检测接种人胃癌SGC-7901细胞于6孔板中,孵育12 h后。分组及给药同“2.2”项,继续孵育24 h。提取每组细胞总蛋白,用蛋白定量仪进行蛋白浓度测定后,经SDS-PAGE凝胶分离,60 V恒压30 min,110 V恒压电泳30 min后,将胶上分离开的蛋白质电转移到PVDF膜上,TBST洗膜3次×15 min 。5%脱脂奶粉TBST溶液室温封闭2 h,TBST洗膜3次×15 min。加一抗于4 ℃过夜,TBST洗膜3次×15 min。加入HRP标记的羊抗兔二抗室温下继续孵育2 h,TBST洗膜3次×15 min,采用凝胶成像分析系统检测MMP2、MMP9、TIMP1、TIMP3蛋白条带。
2.5 RT-PCR法检测MMP2、MMP9、TIMP1和TIMP3的mRNA水平人胃癌SGC-7901细胞接种于6孔板,孵育12 h,分组及给药同“2.2”项,继续孵育24 h,提取总RNA。MMP2、MMP9、TIMP1和TIMP3及β-actin引物由上海生工生物工程有限公司合成。MMP2:F5’-TACAGGATCATTGGCTACACACC-3’,R5’-GG- TCACATCGCTCCAGACT-3’,扩增长度为90 bp;MMP9:F5’-TGTACCGCTATGGTTACACTCG-3’,R5’-GGCAGGGACAGTTGCTTCT-3’,扩增长度为97 bp;TIMP1:F5’-CTTCTGCAATTCCGACCTCGT- 3’,R5’-ACGCTGGTATAAGGTGGTCTG-3’,扩增长度为79 bp;TIMP3:F5’-TGGGTTGTAACTGCA- AGATCAAG-3’,R5’-GGTCCAGAGACACTCGTT- CT-3’,扩增长度为77 bp;β-actin:F5’-CATGTACGT- TGCTATCCAGGC-3’,R5’-CTCCTTAATGTCACGC- ACGAT-3’,扩增长度为250 bp。MMP2反应条件:预变性温度95 ℃、6 min;解链温度95 ℃、10 s,65 ℃、60 s,97 ℃、1 s;扩增温度95 ℃、10 s,60 ℃、10 s,72 ℃、10 s进行45个循环。MMP9反应条件:预变性温度95 ℃、6 min;解链温度95 ℃、10 s,65 ℃、60 s,97 ℃、1 s;扩增温度95 ℃、10 s,60 ℃、10 s,72 ℃、10 s进行45个循环。TIMP1反应条件:预变性温度95 ℃、6 min;解链温度95 ℃、10 s,65 ℃、60 s,97 ℃、1 s;扩增温度95 ℃、10 s,60 ℃、10 s,72 ℃、10 s进行45个循环。TIMP3反应条件:预变性温度95 ℃、6 min;解链温度95 ℃、10 s,65 ℃、60 s,97 ℃、1 s;扩增温度 95 ℃、10 s,59 ℃、10 s,72 ℃、10 s进行45个循环。β-actin反应条件:预变性温度95 ℃、6 min;解链温度95 ℃、10 s,65 ℃、60 s,97 ℃、1 s;扩增温度95 ℃、10 s,59 ℃、10 s,72 ℃、10 s进行45个循环。
2.6 统计学分析采用SPSS 16.0统计软件处理,组间比较采用单因素方差分析,计量数据用表示。
3 结果 3.1 对SGC-7901细胞增殖的影响对照组SGC-7901细胞生长良好,经过10~320 mg/L COE分别处理24、48、72 h后,细胞生长呈现出不同程度的生长抑制,并且呈明显的浓度依赖性,但时间依赖性不明显,结果见表 1。根据COE对SGC-7901细胞生长抑制的情况,为排除COE对细胞的毒性作用影响对细胞侵袭和迁移的研究,后续实验选用COE质量浓度为20、40、80 mg/L的较低浓度作用24 h进一步研究。同时计算出COE的24 h半数抑制浓度(IC50)为83.5 mg/L。
|
|
表 1 COE对SGC-7901细胞增殖的影响 (x±s,n = 5) Table 1 Effect of COE on proliferation of SGC-7901 cells (x±s,n = 5) |
结果显示,COE(质量浓度分别为20、40、80 mg/L)和姜黄素(20 μmol/L)作用人胃癌SGC-7901细胞24 h后,细胞穿膜数目较对照组明显减少,结果见图 1和表 2。结果直接证明COE能有效抑制SGC-7901细胞的侵袭和迁移。
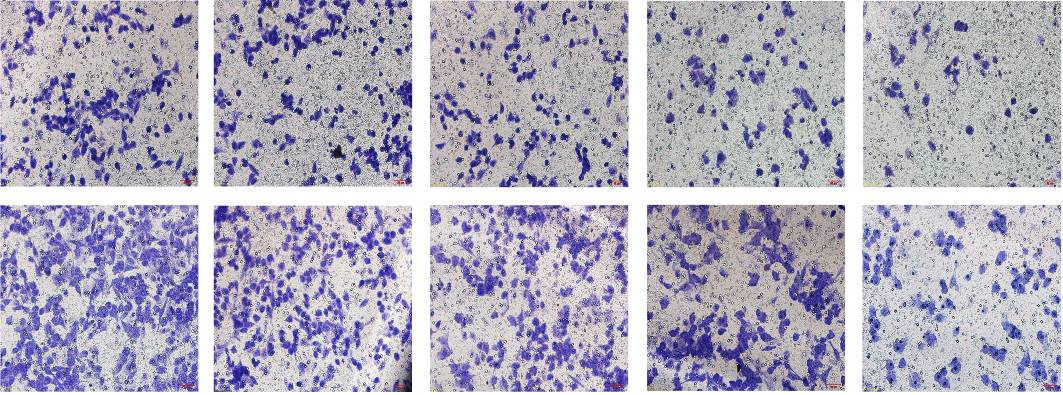
|
图 1 COE对SGC-7901细胞侵袭与迁移的影响 Fig. 1 Effect of COE on invasion and metastasis of SGC-7901 cells |
|
|
表 2 各组Transwell小室穿膜细胞数目 (x±s,n = 5) Table 2 Numbers of transmembrane cells in Transwell of each group (x±s,n = 5) |
人胃癌SGC-7901细胞经过不同浓度的COE(20、40、80 mg/L)和姜黄素20 μmol/L作用24 h,Western blotting结果分析表明,与对照组比较,随着COE质量浓度的增加,TIMP1、TIMP3蛋白的表达水平明显升高;MMP2、MMP9蛋白的表达明显降低并呈明显的浓度依赖性,见图 2。
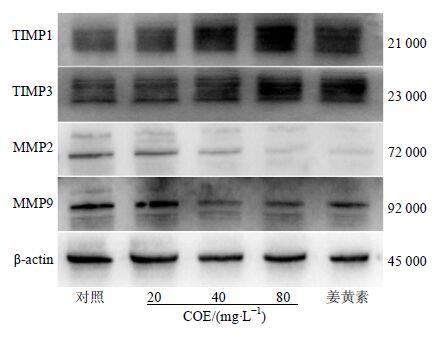
|
图 2 COE对SGC-7901细胞MMP2、MMP9、TIMP1和TIMP2蛋白表达的影响 Fig. 2 Effect of COE on protein expression of MMP2,MMP9,TIMP1,and TIMP2 in SGC-7901 cells |
经不同质量浓度COE(20、40、80 mg/L)处理24 h的人胃癌SGC-7901细胞,MMP2和MMP9的mRNA表达有轻微升高的趋势,但是TIMP1和TIMP3的mRNA表达显著增加,并随COE质量浓度的递增呈现出一定的浓度依赖性,见图 3。
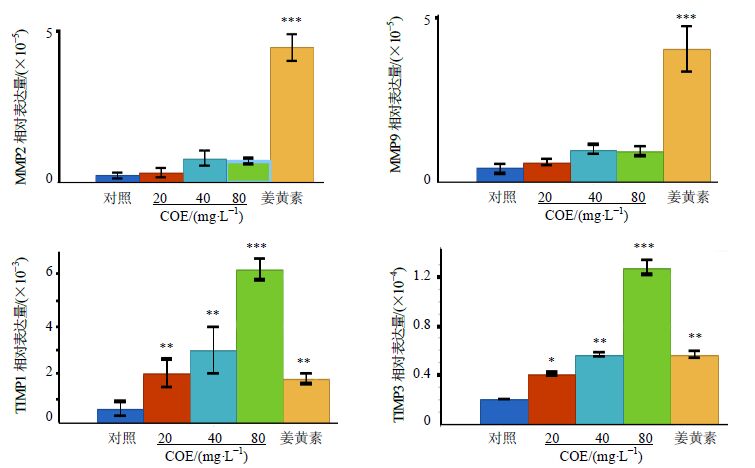
|
图 3 COE对SGC-7901细胞MMP2、MMP9、TIMP 1和TIMP 3 mRNA表达的影响 (x±s,n = 5) Fig. 3 Effect of COE on mRNA expression of MMP2,MMP9,TIMP1,and TIMP3 in SGC-7901 cells (x±s,n = 5) |
胃癌是我国消化道疾病中最主要的病症之一,无论是早期还是中期胃癌,手术是目前为止最为有效的治疗方法,配合放疗、化疗更能有效提高胃癌患者术后生存率。尤其是早期胃癌,手术治疗效果非常明显。然而胃癌的转移与复发却大大制约着胃癌中晚期手术治疗患者生存率的提高。侵袭和转移是恶性肿瘤细胞的重要生物学特征,其是一个动态的、复杂的、多步骤的过程,也是肿瘤患者死亡的主要原因[10, 11, 12]。侵袭和转移不仅是胃癌手术治疗的最大障碍,也是其他恶性肿瘤治疗中的一大难题。近年来,如何抑制肿瘤的侵袭和转移以及抗肿瘤侵袭、转移药物的研发已经成为热点内容[13, 14]。恶性肿瘤细胞侵袭和转移的关键过程之一就是破坏肿瘤细胞侵袭和转移的组织学屏障,才能向周围组织浸润或远端转移[15]。MMPs作为肿瘤细胞降解外基质(ECM)的主要酶原家族,通过降解破坏ECM促进肿瘤细胞突破基底膜和细胞外基质构成的组织屏障,从而侵袭周围组织、血道和淋巴道。MMPs可降解基底膜和细胞外基质的大多数组分,其中尤以MMP2和MMP9与胃癌的侵袭、转移关系最为密切[16]。MMPs受多条信号通路和细胞因子的调控,在肿瘤的发生和发展过程中PI3K/Akt、NF-κB信号通路起了重要的调节作用,活化该信号通路能上调MMP2蛋白的表达水平,促进肿瘤细胞的侵袭和转移[17]。NF-κBp65是PI3K/ Akt信号通路的下游分子,也是MMPs的上游调节因子,活化NF-κB也可以明显促进肿瘤细胞的侵袭和转移。另外,MMPs又受TIMPs的调控。TIMPs是MMPs活性的主要调节因子,大量研究证实,MMPs-TIMPs平衡在肿瘤进展中具有重要作用,因此近年人们试图应用TIMPs治疗肿瘤[18, 19],但相关实验并没有取得太大进展。通过TIMPs来抑制MMPs的水平已经成为研究热点内容之一。课题组前期研究结果显示,COE可能是通过PI3K/Akt、NF-κB p65信号通路来下调MMP2和MMP9蛋白的表达,从而抑制肿瘤细胞侵袭和转移的[20, 21]。然而并没有进行COE对MMPs天然的抑制因子TIMPs的影响及机制研究。本实验研究从MMPs的天然抑制因子着手,间接研究COE对人胃癌SGC-7901细胞侵袭、转移的影响。结果显示,COE能显著降低人胃癌SGC-7901细胞侵袭和转移能力,下调MMP2和MMP9蛋白的表达水平,上调TIMP1和TIMP3蛋白的表达水平。而MMP2和MMP9蛋白是人胃癌SGC-7901细胞侵袭、转移的重要因子,TIMPs又可以直接抑制MMP2和MMP9的活性。结果说明,COE很可能是通过下调MMP2和MMP9的水平来抑制肿瘤侵袭、转移的,但其作用机制很可能是通过上调TIMP1和TIMP3的表达水平来实现。进一步研究结果显示,COE可以直接上调TIMP1和TIMP3 mRNA的水平。也就是说COE能提高TIMP1和TIMP3的转录水平,进而上调TIMP1和TIMP3的蛋白表达水平。总之,COE能够明显抑制人胃癌SGC-7901细胞的侵袭和转移,其机制可能与上调TIMP1和TIMP3蛋白水平,直接下调MMP2和MMP9蛋白水平有关。其作用机制很可能是COE直接作用于TIMP1和TIMP3的mRNA,直接上调mRNA的转录水平。本实验揭示了COE抗胃癌侵袭、转移的新作用机制,找到了COE抗肿瘤侵袭转移的新的作用途径,为开发新型抗胃癌转移新药提供了中药的理论依据。但是COE如何上调TIMP1和TIMP3的mRNA水平,调节MMP2和MMP9蛋白的表达水平过程中是否还有其他信号通路的参与,还有待继续研究。
| [1] | Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 [J]. Int J Cancer, 2010, 127(12): 2893-2917. |
| [2] | Ebinger S M, Warschkow1 R, Tarantino I, et al. Modest overall survival improvements from 1998 to 2009 in metastatic gastric cancer patients: a population-based SEER analysis [J]. Gastric Cancer, 2015. doi:10.1007/s10120-015-0541-9. |
| [3] | Zhu Y D, Liu Y Q, Qian Y Y, et al. Research on the efficacy of Celastrus orbiculatus in suppressing TGF-β1-induced epithelial-mesenchymal transition by inhibiting HSP27 and TNF-α-induced NF-κB/Snail signaling pathway in human gastric adenocarcinoma [J]. BMC Compl Altern Med, 2014, 14(5): 433-445. |
| [4] | Qian YY, Zhang H, Hou Y, et al. Celastrus orbiculatus extract inhibits tumor angiogenesis by targeting vascular endothelial growth factor signaling pathway and shows potent antitumor activity in hepatocarcinomas in vitro and in vivo [J]. Chin J Integr Med, 2012, 18(10): 752-760. |
| [5] | Zhang H, Qian Y, Liu Y, et al. Celastrus orbiculatus extract induces mitochondrial-mediated apoptosis in human hepatocellular carcinoma cells [J]. J Tradit Chin Med, 2012, 32(4): 621-626. |
| [6] | 杨庆伟, 刘延庆, 刘 丽, 等, 南蛇藤总萜提取物对肝癌7721细胞侵袭转移能力的影响 [J]. 中草药, 2009, 40(3): 434-437. |
| [7] | 朱耀东, 刘延庆, 钱亚云, 等. 南蛇藤提取物对人胃癌SGC-7901裸鼠移植瘤生长及凋亡相关蛋白表达的影响 [J]. 中草药, 2015, 46(5): 697-702. |
| [8] | Li J J, Yang J, Lv F, et al. Chemical constituents from the stems of Celastrus orbiculatus [J]. Chin J Nat Med, 2012, 10(4): 279-283. |
| [9] | 昝 珂, 陈筱清, 王 强, 等. 南蛇藤茎的化学成分研究 [J]. 中草药, 2007, 38(10): 1455-1457. |
| [10] | Valastyan S, Weinberg R A. Tumor metastasis: molecular insights and evolving paradigms [J]. Cell, 2011, 147(2): 275-292. |
| [11] | Morra L, Moch H. Periostin expression and epithelial-mesenchymal transition in cancer: a review and an update [J]. Virchows Arch, 2011, 459(5): 465-475. |
| [12] | Brooks S A, Lomax-Browne H J, Carter T M, et al. Molecular interactions in cancer cell metastasis [J]. Acta Histochem, 2010, 112(1): 3-25. |
| [13] | McNally L R, Rosenthal E L, Zhang W, et al. Therapy of head and neck squamous cell carcinoma with replicative adenovirus expressing tissue inhibitor of metalloproteinase-2 and chemorad-I action [J]. Cancer Gene Ther, 2009, 16(3): 246-255. |
| [14] | Lee S Y, Chung S M. Neovastat (AE 941) inhibits the airway inflammation via VEGF and HIF-2A suppression [J]. Vascul Pharmacol, 2007, 47(5/6): 313-318. |
| [15] | 沈培亮, 刘兆国, 王 旭, 等, 肿瘤ECM纤维生成与肿瘤转移研究进展 [J]. 中国药理学通报, 2015, 31(11): 1485-1488. |
| [16] | Chu D, Zhang Z X, Li Y M, et al. Matrix metalloproteinase-9 is associated with disease-free survival and overall survival in patients with gastric cancer [J]. Int J Cancer, 2011, 129(4): 887-895. |
| [17] | 田红艳, 陈萍萍, 李 笑, 等. Gab2通过PI3K/Akt/ARK5/MMP途径影响乳腺癌的侵袭和转移 [J]. 中国药理学通报, 2015, 31(7): 1014-1018. |
| [18] | Clarke M R, Imhoff F M, Baird S K. Mesenchymal stem cells inhibit breast cancer cell migration and invasion through secretion of tissue inhibitor of metalloproteinase-1 and -2 [J]. Mol Carcinog, 2015, 54(10): 1214-1219. |
| [19] | Donizy P, Rudno-Rudzinska J, Kaczorowski M, et al. Disrupted balance of MMPs/TIMPs in gastric carcinogenesis-paradoxical low MMP-2 expression in tumor and stromal compartments as a potential marker of unfavorable outcome [J]. Cancer Invest, 2015, 33(7): 286-293. |
| [20] | 季 雪, 钱亚云, 张 华, 等. 南蛇藤对人肝癌HepG2细胞侵袭能力的影响 [J]. 中药药理与临床, 2012, 28(6): 87-90. |
| [21] | 朱耀东, 钱亚云, 马 慧, 等. 南蛇藤总萜对MGC-803细胞侵袭和迁移能力的影响 [J]. 中国实验方剂学杂志, 2012, 18(22): 180-183. |
 2016, Vol. 47
2016, Vol. 47


