缺血性脑卒中是全球最常见的死亡率和致残率均较高的脑血管疾病之一。细胞凋亡是涉及一系列基因的激活、表达以及调控等因素作用的一种主动死亡过程,其目的是为维持内环境稳定。海马CA1区的锥体神经元对全脑缺血引起的损伤非常敏感,再灌注2~4 d后该部位出现锥体神经元迟发性死亡,而海马其他区域包括齿状回和CA3区以及大部分皮质神经元、侧脑室的室管膜区所产生的细胞基本上未受损伤[1, 2]。临床研究也表明心脏骤停或心肺搭桥手术之后再灌注数天后海马CA1区神经元出现迟发性神经元坏死(细胞凋亡)[3]。
三七总皂苷(total saponins of Panax notoginseng,TSPN)是从三七中提取的多种皂苷活性物质,具有活血祛瘀、通脉活络的功效。体外实验表明TSPN能促进抑凋亡基因的表达,抑制促凋亡蛋白的表达而抑制缺氧后复氧诱导的神经元凋亡[4, 5],Li等[6]研究发现TSPN可明显减少脑缺血部位TUNEL标记的阳性细胞,降低凋亡基因Caspase-1和Caspase-3的表达。本实验通过四血管阻断法建立全脑缺血模型[7, 8],通过尼氏染色和大鼠的生存率确定TSPN的最佳剂量,然后进行神经功能评分,采用免疫组织化学方法观察全脑缺血后ip给予TSPN不同时间后大鼠海马CA1区Bcl-2、Bax以及Caspase-3的阳性细胞数变化,采用免疫印迹技术验证这3个凋亡相关蛋白在全脑缺血后第1、3、7、14天4个时间点海马的表达变化。与此同时,比较TSPN组和模型组Bcl-2/Bax值(细胞数目和蛋白水平)的变化,探讨TSPN在全脑缺血中发挥神经保护作用是否通过上调Bcl-2/Bax值抑制Caspase-3的活化而减少神经元的凋亡。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠,8周龄,体质量250~290 g,由中南大学湘雅医学院实验动物中心提供,许可证号SCXK(湘)2009-0012。所有动物适应环境5 d后开始实验。模型制作过程中最大程度减少动物的痛苦和动物使用的数量,整个实验程序都通过中南大学伦理委员会的批准。
1.2 主要仪器、药品和试剂珊顿冰冻切片机(Shan Don公司);Kopf脑立体定位仪(David KOPF Instruments公司);GX.SS.22-3手术显微镜(上海医疗器械股份有限公司);Olympus BX67荧光显微镜(奥林巴斯);Western仪器(Bio-Rad公司);TSPN(HPLC测得总皂苷质量分数≥98%,四川成都麦卡希化工有限公司,批号12052901);兔抗Bcl-2抗体(Santa Cruz Biotech公司);兔抗Bax抗体、兔抗Caspase-3抗体(Abcam公司);鼠抗β-actin抗体(GenScript公司)。
1.3 大鼠全脑缺血模型制备采用四动脉血管阻断法制备全脑缺血模型[8]。大鼠ip 1%戊巴比妥钠(50 mg/kg)麻醉,仰卧固定在Kopf脑立体定位仪台面;颈前正中切口,分离双侧颈总动脉;俯卧位电凝双侧椎动脉造成永久性闭塞;第2天乙醚吸入麻醉大鼠,拉出颈总动脉,微动脉夹阻塞血管30 min,松开微动脉夹后实行再灌注。
1.4 分组及给药大鼠随机分为假手术组、模型组、TSPN组,假手术组只分离两侧颈总动脉,不夹闭,其余大鼠均按“1.3”项方法制备模型。假手术组不给任何药物干预;模型组大鼠脑缺血30 min后ip等体积0.9% NaCl,每天1次;TSPN组大鼠脑缺血30 min后ip不同剂量(25、50、75、100 mg/kg)的TSPN(以0.9% NaCl溶解至质量浓度10 g/L),每天1次,连续14 d。模型制备14 d后,通过尼氏染色和大鼠的生存率确定TSPN发挥神经保护作用的最佳剂量。再灌注后1、3、7、14 d对假手术组、模型组以及最佳剂量的TSPN组大鼠进行神经功能评分,观察各组大鼠海马Bcl-2、Bax以及Caspase-3的阳性细胞及蛋白水平(假手术组在再灌注后14 d处死大鼠作为参照)。
1.5 神经功能评分当大鼠恢复意识能进行活动后在再灌注第1、3、7和14天分别进行神经功能评分,主要检测运动、感觉、反射和平衡能力。参考Shi等[9]及Lemay等[10]制定的25分制进行行为评分:评分<10分为轻度缺血损害,>10分为重度缺血损害。
1.6 组织样本处理和指标检测深度麻醉大鼠,灌注取出脑组织,4 ℃后固定过夜,梯度沉糖。冰冻切片机进行海马冠状位切片,采用邻切法,切片厚度30 μm,放入组织培养板中,待测。
尼氏染色:漂洗脑片;贴片、晾干组织;二甲苯脱脂;梯度复水;移液枪点滴1%的焦油紫,75%酒精定色,酒精脱水;二甲苯脱脂;中性树脂封片。
免疫组织化学染色:采用ABC-DAB法进行染色。脑片以3% H2O2处理30 min以消除内源性过氧化物酶;5%山羊血清+0.1% tritonX-100磷酸缓冲液孵育2 h;分别加入一抗Bcl-2(1∶1 000)、Bax(1∶500)、Caspase-3(1∶1 000),4 ℃孵育过夜;经山羊抗兔二抗(1∶400)处理,反应1 h后在提前30 min配好的抗生物素-卵白素-辣根过氧化物酶复合物(ABC)溶液孵育2 h;DAB显色。Bax的实验步骤需进行抗原修复:脑片经过3% H2O2处理30 min后抗原修复,将盛有柠檬酸钠(pH=6.0)的1 mL EP管中放入92 ℃水浴锅中,待EP管里的温度达到92 ℃时,放入组织,时间为3 min;组织恢复到室温(22±2)℃,漂洗;然后血清孵育,其他实验步骤相同。所有的免疫组织化学片子都经过苏木素复染。阴性对照:用正常马血清或者磷酸盐缓冲液代替一抗,以排除二抗的非特异性染色,结果为阴性。所有组织切片均在奥林巴斯(BX67)显微镜下完成,拍照时同一倍数下组织的曝光度和像素保持一致。在目镜×20视野下计数阳性细胞密度(计数每毫米的阳性细胞数),每个时间点取5个脑组织,每个脑组织挑选3个视野,计算平均值。
1.7 Western blotting 法检测相关蛋白表达麻醉大鼠,冰上操作迅速分离海马,按照组织与蛋白提取剂1∶10(g/mL)的比例稀释,用电动匀浆器碎解组织。4 ℃低温离心,12000 r/min离心20 min,收集上清液,测定蛋白浓度。用SDS-PAGE凝胶电泳,每个泳道上载50 μg总蛋白。电泳分离蛋白转移至PVDF膜(Bio-rad公司实验室)上,Caspase-3转膜约40 min,Bax、Bcl-2转膜约30 min。将含有目的蛋白的一抗(Bcl-2,1∶200;Bax,1∶200;Caspase-3,1∶1 000)孵育,4 ℃过夜。1×TBST溶液漂洗,然后和偶联HRP标记的羊抗兔IgG(1∶5 000,由Bio-rad公司提供)室温下作用2 h。1×TBST溶液漂洗,采用ECL化学发光法显影,以β-actin作为内参,使用NIH Image J分析目的条带,蛋白相对量表示为目的蛋白条带的平均吸光度值与内参β-actin的平均吸光度值的比值。
1.8 统计学方法数据以表示,采用统计学软件Prism GraphPad5.0进行统计分析,通过双因素方差分析或者配对t检验比较组间差异。
2 结果 2.1 TSPN 最佳剂量的确定造模后14 d统计各组大鼠生存率及尼氏染色检测各组大鼠脑组织海马CA1区锥体神经元密度。造模后14 d,假手术组以及50、75 mg/kg TSPN组大鼠生存率均为100%,高于模型组,见图 1。与假手术组相比,模型组大鼠海马CA1区锥体神经元密度显著下降,50、75 mg/kg TSPN组大鼠锥体神经元的密度均显著升高,其中75 mg/kg TSPN的作用较其他剂量TSPN最为显著(P<0.05),见图 2。海马CA1区尼氏染色典型图片见图 3。综合以上实验结果,在后续实验中选择TSPN剂量为75 mg/kg,继续观察其他各项指标变化。
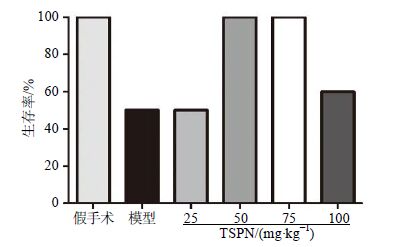
|
图 1 各组大鼠生存率 (n= 10) Fig. 1 Survival rate of rats in each group (n = 10) |
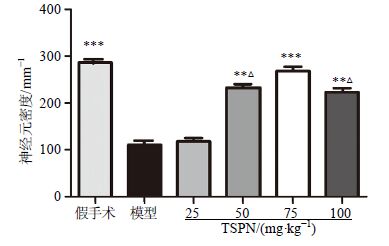
|
与模型组比较:P<0.05 **P<0.01 ***P<0.001;与TSPN (75 mg∙kg−1) 组比较:ΔP<0.05,下同 P < 0.05 **P < 0.01 ***P < 0.001 vs model group; ΔP < 0.05 vs TSPN (75 mg∙kg−1) group,same as below 图 2 TSPN对全脑缺血大鼠海马CA1区锥体神经元密度的影响 (x±s,n = 5) Fig. 2 Effect of TSPN on neurons density in hippocampal CA1 of rats with global cerebral ischemia injury (x±s,n = 5) |
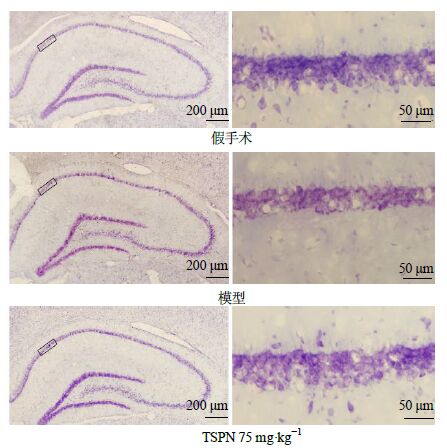
|
图 3 全脑缺血再灌注14 d大鼠海马CA1区尼氏染色 Fig. 3 Nissl staining of hippocampal CA1 subfield from 30 min post-ischemia of rats followed 14 days’ reperfusion |
在全脑缺血30 min再灌注第1、3、7、14天分别对假手术组、模型组和TSPN 75 mg/kg组大鼠进行神经功能评分,结果见图 4。假手术组各时间点大鼠神经功能评分为0分;再灌注第7、14天,TSPN组神经功能评分显著低于模型组(P<0.001),TSPN组大鼠四肢肌肉的收缩力明显提高、眼睛的闭合恢复正常、无转圈现象以及毛发恢复正常的光泽。
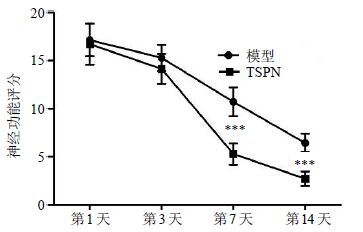
|
图 4 TSPN对大鼠神经功能评分的影响 (x±s,n = 9) Fig. 4 Effect of TSPN on neurological scores in rats (x±s,n = 9) |
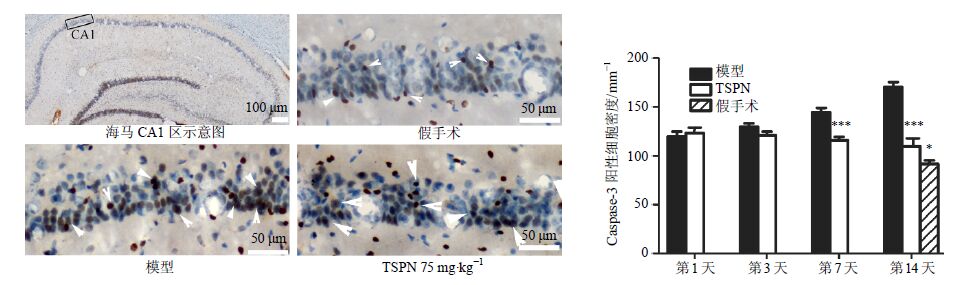
免疫组化结果表明,与假手术组相比,模型组大鼠海马CA1区Caspase-3阳性的细胞密度显著增加,给予TSPN治疗后,Caspase-3阳性的细胞密度显著下降(P<0.05);再灌注第7、14天,TSPN组与模型组比较,Caspase-3阳性的细胞密度差异显著(P<0.001)。见图 5。
|
图 5 各组大鼠海马CA1区Caspase-3免疫组化染色结果 (x±s,n = 5) Fig. 5 Immunohistochemical staining results of Caspase-3in hippocampal CA1 of rats in each group (x±s,n = 5) |
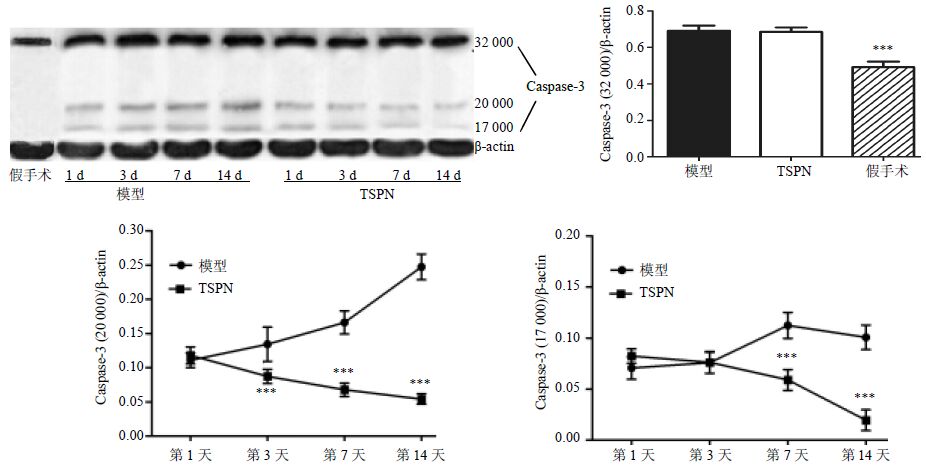
Western blotting法检测结果表明,与假手术组相比,模型组和TSPN组Caspase-3(32 000)蛋白水平显著上升(P<0.001),全脑缺血后激活的2个亚基(20 000、17 000)的统计结果显示:在再灌注第3、7、14天,与模型组比较,TSPN组20 000的亚基蛋白水平显著降低(P<0.001);在再灌注第7、14天,与模型组比较,TSPN组17 000的亚基蛋白水平显著降低(P<0.001)。见图 6。
|
图 6 TSPN对全脑缺血大鼠海马CA1区Caspase-3蛋白表达的影响 (Western blotting,x±s,n = 4 ) Fig. 6 Effect of TSPN on Caspase-3 protein expression in hippocampus CA1 of rats with global cerebral ischemia (Western blotting,x±s,n = 4 ) |
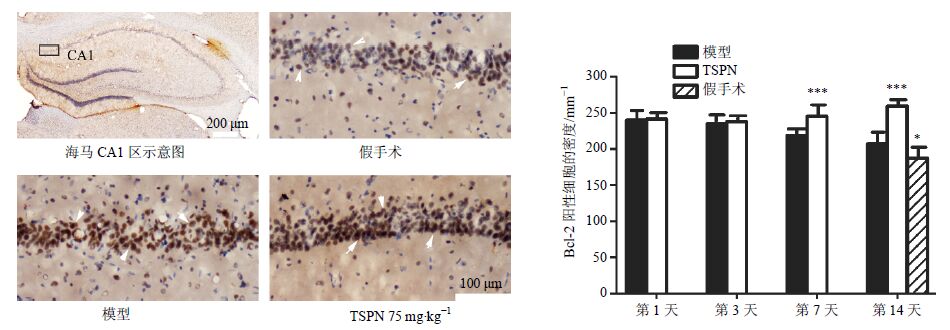
免疫组化结果表明,与假手术组比较,模型组大鼠海马CA1区Bcl-2阳性的细胞密度均显著上升(P<0.05),再灌注第7、14天,TSPN组与模型组比较,Bcl-2阳性的细胞密度显著升高(P<0.001)。见图 7。
|
图 7 各组大鼠海马CA1区Bcl-2免疫组化染色结果 (x±s,n = 5) Fig. 7 Immunohistochemical staining results of Bcl-2 in hippocampal CA1 of rats in each group (x±s,n = 5) |
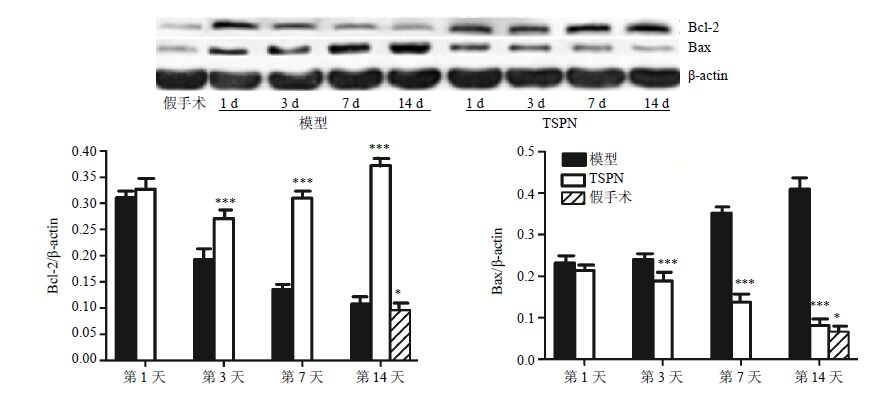
Western blotting法检测结果表明,与假手术组比较,模型组大鼠海马CA1区Bcl-2蛋白水平均显著增加(P<0.05);再灌注第3、7、14天,TSPN 组大鼠海马CA1区Bcl-2蛋白水平均显著高于模型组(P<0.001)。见图 8。
|
图 8 TSPN对全脑缺血大鼠海马CA1区Bcl-2和Bax蛋白表达的影响 (Western blotting,x±s,n = 5 ) Fig. 8 Effect of TSPN on Bcl-2 and Bax protein expression in hippocampus CA1 ofratswithglobalcerebral ischemia (Western blotting,x±s,n = 5) |
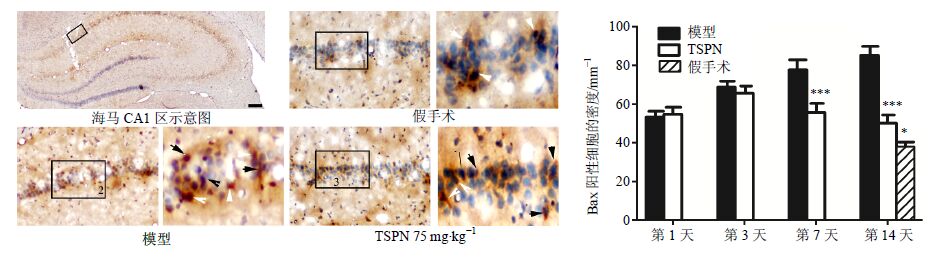
免疫组化结果表明,海马CA1区Bax阳性细胞主要表达在细胞的胞浆,并且发现细胞发出一些突起和微丝。与假手术组相比,模型组大鼠海马CA1区的Bax阳性细胞密度显著上升(P<0.05),而给予TSPN干预后,Bax阳性细胞密度较模型组显著下降;再灌注第7、14天,TSPN组与模型组比较,Bax阳性细胞密度显著下降(P<0.001)。见图 9。
|
图 9 各组大鼠海马CA1区Bax免疫组化染色结果(x±s,n = 5) Fig. 9 Immunohistochemical staining results of Bax in hippocampal CA1 of rats in each group (x±s,n = 5) |
Western blotting法检测结果表明,与假手术组比较,模型组大鼠海马CA1区Bax蛋白水平显著增加(P<0.05);再灌注第3、7、14天,TSPN组大鼠海马CA1区Bax蛋白水平均显著低于模型组(P<0.001)。见图 8。
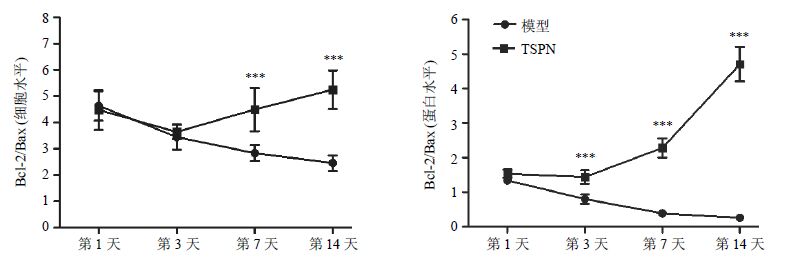
2.6 TSPN对Bcl-2和Bax阳性细胞密度及蛋白水平比值的影响TSPN组Bcl-2/Bax值(阳性细胞)在第7、14 d均显著高于模型组(P<0.001);Bcl-2/Bax值(蛋白水平)在第3、7、14天高于模型组(P<0.001)。见图 10。
|
图 10 TSPN对全脑缺血大鼠海马CA1区Bcl-2/Bax值的影响 (x±s,n = 5) Fig. 10 Effect of TSPN on Bcl-2/Bax ratio in hippocampal CA1 region of rats following global cerebral ischemia (x±s,n = 5) |
Caspase-3是Bcl-2家族下游的凋亡执行者,Caspase-3激活后可通过线粒体(主要涉及到Bcl-2和Bax)等途径介导细胞凋亡[11]。本实验免疫组织化学染色结果表明全脑缺血后大鼠海马CA1区活化的Caspase-3神经元增多,Western-blotting结果显示缺血后海马Caspase-3总蛋白激活,然后被分解成2个亚单位(20 000和17 000),并且随着缺血时间的延长这2个亚单位的蛋白水平明显增高。而给予TSPN治疗后,活化的Caspase-3细胞减少,其蛋白水平的表达也明显下降,实验结果与先前报道一致[12]。这表明TSPN可通过抑制Caspase-3的过度激活和表达而修复全脑缺血后受损的神经元和保护脑细胞。
Bcl-2和Bax蛋白是Bcl-2家族的重要成员,是Caspase通路的上游信号,二者在凋亡中起着重要作用,Bcl-2是一个生存因子,定位于线粒体外膜、内质网膜和核周膜[13],能阻碍细胞凋亡和坏死,Bcl-2的过度表达在脑缺血中发挥神经保护作用[14]。本实验结果显示全脑缺血后海马CA1区Bcl-2阳性细胞密度明显下降,而给予TSPN治疗之后Bcl-2阳性细胞密度明显增高;免疫印迹结果显示TSPN能显著增加全脑缺血大鼠海马Bcl-2蛋白水平,这表明TSPN可通过增加Bcl-2的表达而发挥抗凋亡作用。Bax蛋白位于胞质,在凋亡信号诱导后很快迁移到线粒体从而促进细胞凋亡[15]。实验结果显示全脑缺血后Bax阳性细胞密度增高,Bax蛋白水平表达增加,表达趋势与文献报道一致[16],而给予TSPN干预后,无论是Bax阳性细胞密度还是其蛋白水平都显著下降。这表明TSPN可以抑制Bax基因的表达,其作用机制可能是通过Bcl-2的过表达而阻止Bcl-2其他家族成员如Bax促凋亡蛋白的启动。一般来说,神经元能否抵抗凋亡与通过上调Bcl-2蛋白表达和下调Bax、Caspase-3蛋白表达有关[17, 18],确切地说Bcl-2/Bax值决定着细胞是否凋亡[19]。本实验结果显示,全脑缺血后海马CA1区Bcl-2阳性细胞数目与海马CA1区Bax阳性细胞数目的比值随着再灌注时间的延长而降低,而给予TSPN治疗之后,Bcl-2/Bax值明显升高,在第7、14天显著高于模型组,这表明TSPN可提高海马CA1区Bcl-2/Bax值而发挥抗凋亡的作用。免疫印迹技术检测大鼠海马Bcl-2/Bax值的蛋白水平进一步验证了上述结果。实验结果显示TSPN组在第3、7、14天Bcl-2/Bax值的蛋白水平均显著高于模型组,说明TSPN可能通过上调Bcl-2/Bax的比值而抑制Caspase-3的过度激活,从而避免更多的神经元凋亡。其机制可能是Bcl-2的过度表达形成异源二聚体而发挥抗凋亡作用,而Bax蛋白的减少,维护了神经元Ca2+体内平衡[20];或者是通过抑制JNK信号的激活和线粒体的凋亡途径[21]。在实验过程中,发现2组大鼠Bcl-2/Bax值阳性细胞在第7、14天有统计学差异,而Bcl-2/Bax蛋白水平的比值在第3、7、14天均有统计学意义,结果不具有一致性,这可能是由于阳性细胞的比值代表的是海马CA1区的某一个部位的某一个层面,而Bcl-2/Bax蛋白水平则代表的是整个海马部位的总蛋白量。
本研究从行为学角度观察了TSPN对全脑缺血后大鼠的神经功能评分的影响,从形态学观察了TSPN对全脑缺血后大鼠的生存率,海马CA1区神经元密度,Bcl-2、Bax和Caspase-3阳性细胞密度的影响,同时采用分子生物学技术探讨了TSPN对全脑缺血后海马Bcl-2、Bax和Caspase-3蛋白表达的影响。结果显示75 mg/kg的TSPN的神经保护作用最强,TSPN可逐渐上升Bcl-2阳性细胞密度,抑制Bax和活化的Caspase-3阳性细胞的表达。免疫印迹技术结果进一步佐证了免疫组化的结果,同时通过对Bcl-2和Bax细胞数目以及二者蛋白水平之间的比值阐述了TSPN组Bcl-2/Bax值的上调作用。实验结果表明全脑缺血后TSPN可通过上调Bcl-2/Bax值而调控神经元凋亡的下游Caspase家族,从而发挥神经保护作用。但TSPN神经保护作用的确切机制需要进一步深入研究。
| [1] | Ouyang Y B, Stary C M, Yang G Y, et al. MicroRNAs: innovative targets for cerebral ischemia and stroke [J]. Curr Drug Targets, 2013, 14(1): 90-101. |
| [2] | Schmidt-Kastner R, Freund T F. Selective vulnerability of the hippocampus in brain ischemia [J]. Neuroscience, 1991, 40(3): 599-636. |
| [3] | Petito C K, Feldmann E, Pulsinelli W A, et al. Delayed hippocampal damage in humans following cardiorespiratory arrest [J]. Neurology, 1987, 37(8): 1281-1286. |
| [4] | 康立源, 周志焕, 张 萌, 等. 三七总皂苷对缺氧复氧致皮质神经元损伤细胞凋亡相关基因及蛋白表达的影响 [J]. 天津中医药大学学报, 2010, 29(1): 22-25. |
| [5] | 王 薇. 三七总皂苷对脑出血患者血肿吸收及血浆基质金属蛋白酶-9的影响 [J]. 中草药, 2011, 42(5): 963-965. |
| [6] | Li H, Deng C, Chen B, et al. Total saponins of Panax notoginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia-reperfusion [J]. J Ethnopharmacol, 2009, 121(3): 412-418. |
| [7] | Liang G, Shi B, Luo W, et al. The protective effect of caffeic acid on global cerebral ischemia-reperfusion injury in rats [J]. Behav Brain Funct, 2015. doi: 10. 1186/s12993-015-0064-x. |
| [8] | Pulsinelli W A, Brierley J B. A new model of bilateral hemispheric ischemia in the unanesthetized rat [J]. Stroke, 1979, 10(3): 267-272. |
| [9] | Shi L L, Chen B N, Gao M, et al. The characteristics of therapeutic effect of pinocembrin in transient global brain ischemia/reperfusion rats [J]. Life Sci, 2011, 88(11/12): 521-528. |
| [10] | Lemay D R, Gehua L, Zelenock G B, et al. Insulin administration protects neurologic function in cerebral ischemia in rats [J]. Stroke, 1988, 19(11): 1411-1419. |
| [11] | Li J, Chen F, Chen Y, et al. Mitochondrial-and Fas-L-mediated pathways involved in quinestrol induced spermatogenic apoptosis in adult rat testes [J]. Toxicol Mech Methods, 2014, 24(9): 609-615. |
| [12] | 李 花, 邓常清, 陈北阳, 等. 三七总皂苷对大鼠脑缺血再灌注后Caspase表达的影响 [J]. 中国药理学通报, 2006, 22(2): 189-193. |
| [13] | Hockenbery D M, Oltvai Z N, Yin X M, et al. Bcl-2 functions in an antioxidant pathway to prevent apoptosis [J]. Cell, 1993, 75(2): 241-251. |
| [14] | Zhang H R, Peng J H, Zhu G Y, et al. Neuroprotective effects of Bcl-2 over expression on nerve cells of rats with acute cerebral infarction [J]. Genet Mol Res, 2015, 14(3): 7696-7703. |
| [15] | Oltvai Z N, Milliman C L, Korsmeyer S J. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death [J]. Cell, 1993, 74(4): 609-619. |
| [16] | Chen J, Zhu R L, Nakayama M, et al. Expression of the apoptosis-effector gene, Bax, is up-regulated in vulnerable hippocampal CA1 neurons following global ischemia [J]. J Neurochem, 1996, 67(1): 64-71. |
| [17] | Salakou S, Kardamakis D, Tsamandas A C, et al. Increased Bax/Bcl-2 ratio up-regulates caspase-3 and increases apoptosis in the thymus of patients with myasthenia gravis [J]. In Vivo, 2007, 21(1): 123-132. |
| [18] | Aboutaleb N, Shamsaei N, Khaksari M, et al. Pre-ischemic exercise reduces apoptosis in hippocampal CA3 cells after cerebral ischemia by modulation of the Bax/Bcl-2 proteins ratio and prevention of caspase-3 activation [J]. J Physiol Sci, 2015, 65(5): 435-443. |
| [19] | 王卫东, 陈正堂. Bcl-2/Bax比率与细胞“命运” [J]. 中国肿瘤生物治疗杂志, 2007, 14(4): 393-396. |
| [20] | D'Orsi B, Kilbride S M, Chen G, et al. Bax regulates neuronal Ca2+ homeostasis [J]. J Neurosci, 2015, 35(4): 1706-1722. |
| [21] | 唐映红, 黄小平, 谭 华, 等. 三七总皂苷对脑缺血再灌注后神经元凋亡及凋亡线粒体途径和c-Jun氨基末端激酶表达的影响 [J]. 中国实验方剂学杂志, 2010, 16(16): 129-132. |
 2016, Vol. 47
2016, Vol. 47


