苍术为菊科苍术属植物茅苍术Atractylodes lancea (Thunb.) DC. 或北苍术Atractylodes Chinensis Koidz. 的干燥根茎[1]。生苍术温燥而辛烈,麸炒可缓和苍术燥性,增强健脾和胃的作用[2, 3]。本课题组前期在对苍术麸炒炮制机制研究中发现[4, 5],苍术麸炒后比相应生品5-羟甲基糠醛(5-HMF)的量均增加10倍以上,生苍术中5-HMF的量为12.9~32.2 μg/g,而麸炒苍术的量均大于0.150 mg/g,两者的量差距大,且无交叉重叠,该结果对生苍术、麸炒苍术具指示性鉴别意义。文献研究表明[6, 7, 8],果糖和葡萄糖在干热条件下,可以发生反应转化为5-HMF,而苍术含有大量果糖和葡萄糖,在麸炒工艺条件下能否转化为5-HMF,值得深入研究。为明确苍术麸炒过程中5-HMF量明显增加的机制,本实验模拟了麸炒苍术炮制工艺,对果糖及葡萄糖进行加热处理,测定其5-HMF的量变化及其转化率,并对10批苍术样品麸炒前后果糖的量变化进行验证,最终确定5-HMF量增加的机制。
1 仪器与试药Agilent 1260高效液相色谱仪,美国Agilent公司;电热套、坩埚,天津市泰斯特仪器有限公司;万分之一天平、十万分之一天平,德国Sartorious公司;SK7200HP型超声波清洗器,上海科导超声仪器有限公司;0.45 μm微孔滤膜,50 mL锥形瓶,一次用注射器。
纯水、色谱纯乙腈,Tedia公司;果糖、葡萄糖,化学纯,天津市科密欧化学试剂有限公司;5-HMF对照品(批号wkq-00766,20 mg,HPLC测定质量分数≥98%),四川省维克奇生物科技有点公司;果糖对照品(批号PS151224-10,20 mg,质量分数98.0%),成都普思科技有点公司。苍术饮片经湖北中医药大学药学院陈科力教授鉴定为菊科苍术属植物茅苍术Atractylodes lancea (Thunb.) DC. 的干燥根茎;麸炒苍术按照《中国药典》2015年版炒制方法自制。苍术样品来源见表 1。
|
|
表 1 样品来源 Table 1 Sources of samples |
色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈-水(95∶5),体积流量1.0 mL/min;检测波长284 nm;柱温30 ℃;进样量20 μL。理论塔板数按5-HMF峰计算不低于3 000。色谱图见图 1。
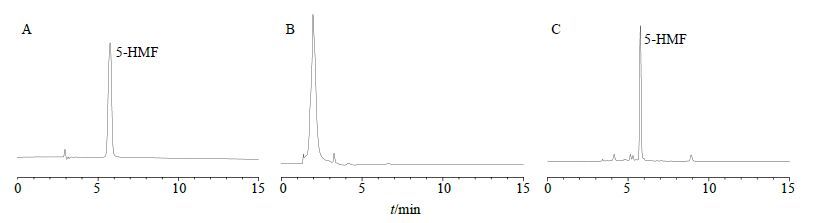
|
图 1 5-HMF对照品 (A)、葡萄糖8号供试品 (B) 及果糖8号供试品 (C) 的HPLC图 Fig. 1 HPLC of 5-HMF reference substances (A),glucose No. 8 (B),and fructose No. 8 (C) samples |
参照《中国药典》2015年版苍术麸炒工艺,电热套加热坩埚预热5 min,将果糖和葡萄糖分别取0.1 g按照表 2分组放入预热好的坩埚中加热,每组平行3次。
|
|
表 2 葡萄糖及果糖在不同工艺条件下转化为5-HMF的量 (x±s,n = 3) Table 2 Contents of 5-HMF in various glucose and fructose samples under different processing conditions (x±s,n = 3) |
精密称取5-HMF对照品1.00 mg配成100 μg/mL的水溶液。
2.1.4 供试品溶液的制备将“2.1.2”项样品自然冷却至室温,纯水溶解定容至50 mL量瓶中,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.5 线性关系考察精密称取5-HMF对照品适量,按“2.1.3”项下方法配制成质量浓度分别为100.0、50.0、20.0、10.0、5.0 μg/mL的溶液,按“2.1.1”色谱条件测定峰面积。以峰面积积分值为纵坐标(Y),进样质量浓度为横坐标(X),绘制标准曲线,得回归方程为Y=1.862 3 X-8.435,r=0.999 9,结果表明5-HMF在5~100 μg/mL线性关系良好。
2.1.6 精密度试验精密吸取对照品溶液20 μL,重复进样6次,测得5-HMF峰面积,RSD值为2.7%,表明仪器精密度良好。
2.1.7 重复性试验按“2.1.2”项8号样品制备方法将果糖制备成样品,并按“2.1.4”项下方法制备供试品溶液6份,按“2.1.1”项下色谱条件操作,取20 μL依次进样,测定峰面积,计算5-HMF的质量分数。结果其RSD为2.74%,表明本实验重复性良好。
2.1.8 稳定性试验精密吸取8号供试品溶液20 μL,分别在2、4、6、8、12 h进样测定,结果RSD为1.02%,在12 h内稳定性良好。
2.1.9 加样回收率试验取果糖50 mg,精密称定,放入180 ℃条件下坩埚中加热5 min(组别9),自然冷却至室温,纯水溶解至50 mL量瓶中,加入质量浓度为1.00 mg/mL的对照品溶液1 mL,定容,其余按“2.1.4”项下方法平行制备6份供试品溶液,按“2.1.1”项方法测定,计算得加样回收率分别为100.30%、99.88%、100.25%、98.98%、99.40%、99.72%,平均加样回收率为99.76%,RSD为0.51%,表明加样回收率较好。
2.1.10 定量测定[9]按“2.1.1”项色谱条件,测定葡萄糖、果糖在不同加热工艺条件下各组样品中5-HMF的量,计算其平均值及转化率。结果见表 2。
统计结果表明,葡萄糖样品在模拟苍术麸炒工艺条件下未能检测到5-HMF,推测葡萄糖在此条件下未能发生可以转化为5-HMF的化学反应或转化量极低达不到仪器检测限;果糖在相同条件下,均能检测到不同质量分数的5-HMF,提示果糖在此条件下可以转化为5-HMF,且随着加热的温度和时间等因素的改变,其转化率各不相同[10]。
2.2 苍术麸炒前后果糖的测定 2.2.1 色谱条件[11]以十八烷基硅烷键合硅胶为填充剂,Kromasil C18分离柱(250 mm×4.6 mm,5 μm);柱温30 ℃;以乙腈-水(2∶98)为流动相;体积流量0.6 mL/min;进样量1 μL。ELSD不分流模式检测,漂移管温度110 ℃,载气体积流量3.1 L/mL。色谱图见图 2。
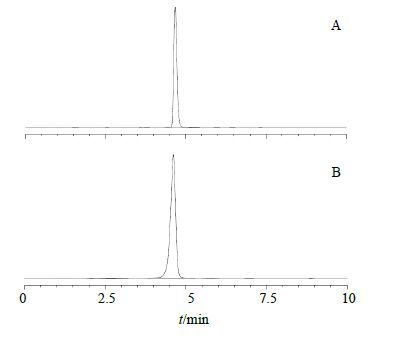
|
图 2 果糖对照品 (A) 及苍术饮片供试品 (B) 的HPLC图 Fig. 2 HPLC of fructose reference substance (A) and A. lancea samples (B) |
精密称取果糖对照品20 mg,溶于纯水中,定容至5 mL量瓶中制成4 mg/mL的溶液,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.3 供试品溶液的制备取10批生苍术饮片粉末及对应的麸炒苍术饮片(麸炒苍术按照《中国药典》2015年版炒制方法自制)粉末各1.00 g,精密称定,入锥形瓶中精密加纯水20 mL,称定质量。超声处理(功率250 W,频率40 kHz)1 h,冷却,补足减失的质量,摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.4 线性关系考察精密称取果糖对照品适量,按“2.2.2”项下方法配制成质量浓度分别为10.0、6.0、4.0、2.0、1.0 mg/mL的溶液,按“2.2.1”项色谱条件测定峰面积。以峰面积积分值为纵坐标(Y),进样质量浓度为横坐标(X),绘制标准曲线得回归方程为Y=2 365 579.52 X-2 689 934.1,r=0.999 9,结果表明果糖在1~10 mg/mL线性关系良好。
2.2.5 精密度试验精密吸取对照品溶液1 μL,重复进样6次,测得果糖峰面积,其RSD值分别为2.71%,表明仪器精密度良好。
2.2.6 重复性试验按“2.2.3”项下制备S1号生苍术供试品溶液6份,按“2.2.1”项下色谱条件操作,取20 μL依次进样进行峰面积的测定,计算果糖质量分数。结果其RSD为2.74%,表明本实验重复性良好。
2.2.7 稳定性试验精密吸取S1号生苍术供试品溶液20 μL,分别在2、4、6、8、12 h进样测定,结果果糖峰面积的RSD为1.02%,在12 h内稳定性良好。
2.2.8 加样回收率试验取已测定的同一批生苍术饮片(S6)粉末0.50 g,精密称定,加入锥形瓶中;向锥形瓶中加入质量浓度为2.00 mg/mL的果糖对照品溶液1 mL,精密加纯水19 mL溶解,其余按“2.2.3”项下方法平行制备6份供试品溶液,按“2.2.1”项方法测定,测得加样回收率分别为99.07%、98.41%、99.01%、101.13%、98.41%、101.52%,平均回收率为99.59%,RSD为1.38%,回收率符合要求。
2.2.9 定量测定按“2.2.1”项色谱条件,测定生苍术及麸炒苍术饮片中果糖的量,计算果糖变化量。结果见表 3。
|
|
表 3 生苍术及麸炒苍术饮片中果糖的量及其变化量 Table 3 Content and changes of fructose in A. lancea and bran-processed A. lancea before and after processing |
实验结果表明,生苍术饮片含有大量果糖,且在麸炒后果糖的量降低。从表 3结果可知,生苍术饮片在麸炒以后果糖的减少量均超过了1.7 mg/g,根据表 2中在模拟苍术麸炒工艺条件下果糖的最大转化率13.451 6%可以计算出:1 g苍术饮片在麸炒以后经过果糖(C6H12O6)转化得到的5-HMF(C6H6O3)的量至少为0.016%,这与前期研究中麸炒苍术饮片中5-HMF的量不少于0.015%一致[12],说明在炮制过程中消耗的果糖几乎100%转化为5-HMF。
3 讨论 3.1 葡萄糖、果糖转化5-HMF机制果糖为呋喃型结构,较容易脱水缩合成5-HMF。而葡萄糖具有稳定的吡喃型结构,其中的氢键需在负离子的作用下发生质子转移,使α-葡萄糖旋光异构为β-葡萄糖,再生成烯醇式中间物,从而导致葡萄糖异构化为果糖,再由果糖脱水生成5-HMF,由此说明葡萄糖生成5-HMF的路径长、需要能量高,相比果糖更为困难[13, 14, 15]。本实验中葡萄糖样品经加热之后产物没有检测到5-HMF,可能是炮制工艺达不到葡萄糖转化5-HMF的条件或转化量极低达不到仪器检测限,因此推断苍术在麸炒后5-HMF的量增加与葡萄糖转化关系不大,主要由果糖转化而得。表 2和表 3结果表明,果糖转化为5-HMF转化率最高的工艺条件与苍术麸炒工艺相吻合。
3.2 苍术中的其他成分对5-HMF的产生过程无明显的协同或拮抗作用苍术含有大量果糖、葡萄糖以及少量还原糖和糖苷类物质,都可能在实验条件下发生反应,生成5-HMF;但是结合本实验结果:葡萄糖样品在模拟苍术炮制工艺条件下未能检测到5-HMF,而果糖在相同条件下检测到5-HMF,且苍术炮制后5-HMF增加量与果糖减少而生成的5-HMF量十分吻合,于是推测5-HMF量增加的主要原因是果糖的转化,其他成分对5-HMF的产生无明显拮抗或协同作用。
3.3 麸炒工艺与果糖转化条件关系《中国药典》2015年版炒制方法中并未明确规定麸炒温度,相关炮制通则对苍术的麸炒条件也仅提到使用中火加热,中火温度范围为170~190 ℃;课题组前期的苍术麸炒工艺研究表明,最佳投药温度为150 ℃[2, 5],与本实验模拟条件最佳温度一致。分析认为苍术中的果糖成分被包合在药材和麦麸之中,炒制过程中其实际接触温度应该低于170 ℃,这与果糖150 ℃时转化率最高相吻合。
3.4 麦麸所含果糖与5-HMF量变化关系麦麸中也含有果糖,但在苍术麸炒过程中温度达到170~190 ℃,在此温度下麦麸基本炭化,其化学成分已被破坏[16],同时炒制过后麦麸被筛出,因此认为麦麸所含果糖对5-HMF量增加没有贡献。
实验结果表明,苍术所含果糖在麸炒过程中转化为5-HMF,是麸炒过程中5-HMF产生的主要方式,也是麸炒苍术中5-HMF量显著增加的主要原因。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 龚千锋. 中药炮制学[M]. 北京: 中国中医药出版社, 2012. |
| [3] | 庞 雪, 刘玉强, 刘小丹, 等. 麸炒苍术不同部位对大鼠脾虚的影响[J]. 现代药物与临床, 2015, 30(7): 763-767. |
| [4] | 陈雯雯. 苍术麸炒前后氯仿和挥发油部位药效学及化学成分对比研究[D]. 武汉: 湖北中医药大学药学院, 2013. |
| [5] | 刘艳菊, 许腊英, 李水清. 麸炒苍术炮制工艺研究[J]. 中国医院药学杂志, 2009, 29(15): 1267-1269. |
| [6] | 张红伟, 张振凌. 中药炮制对5-羟甲基糠醛成分的影响[J]. 中国实用医药, 2009, 4(15): 149-151. |
| [7] | Ajandouz E H, Tchiakpe L S, Ore F D, et al. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. J Food Sci, 2006, 66(7): 926-931. |
| [8] | 吴惠玲, 王志强, 韩 春, 等. 影响美拉德反应的几种因素研究[J]. 现代食品科技, 2010, 26(5): 441-444. |
| [9] | 鲜洁晨, 张 宁, 冯 怡, 等. 中药蜜丸炼蜜过程中果糖、葡萄糖、5-羟甲基糠醛的热稳定性研究[J]. 中药材, 2011, 34(9): 1434-1437. |
| [10] | 曾林燕, 宋志前, 魏 征, 等. 黄精炮制过程中新产生成分分离及含量变化[J]. 中草药, 2013, 44(12): 1584-1588. |
| [11] | 李先端, 钟银燕, 顾雪竹, 等. 中药炮制辅料蜂蜜中葡萄糖、果糖、蔗糖的含量测定[J]. 中成药, 2008, 30(6): 885-888. |
| [12] | 季光琼, 刘艳菊, 王 萍, 等. HPLC法测定苍术及麸炒苍术中5-羟甲基糠醛的含量[J]. 湖北中医杂志, 2014, 36(2): 73-74. |
| [13] | Li C Z, Zhang Z H, Zhao Z B K. Direct conversion of glucose and cellulose to 5-hydroxymethyl furfural in ionic liquid under microwave irradiation[J]. Tetrahedron Lett, 2009, 50(38): 5403-5405. |
| [14] | Cheriot S, Billaud C, Pöchtrager S, et al. A comparison study between antioxidant and mutagenic properties of cysteine glucose-derived Maillard reaction products and neoformed products from heated cysteine and hydroxyl-methylfurfural[J]. Food Chem, 2009, 114(1): 132-138. |
| [15] | Lan X H, Liu P, Xia S Q, et al. Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system: Further insights into thermal degradation and cross-linking[J]. Food Chem, 2010, 120(4): 967-972. |
| [16] | 刘艳菊, 曾 敏, 陈雯雯, 等. 气-质联用法分析苍术、麸炒苍术及其辅料麦麸的挥发性成分[J]. 中国医院药学杂志, 2012, 32(11): 847-849. |
 2016, Vol. 47
2016, Vol. 47


