慢性溃疡性结肠炎又称肠道非特异性慢性炎性疾病(nonspecific ulcerative colitis,UC),其病因复杂,且与多种因素有关,病变为浅表性、非特异性炎症病变,病灶主要在结肠,且乙状结肠最为常见。大黄药用历史悠久,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经等功效;大黄中多种成分具有抑菌抗炎的作用,可保护消化道黏膜,抗消化道黏膜损伤。有研究表明[1],大黄多糖对大鼠应激性胃溃疡有明显保护作用,对溃疡性结肠炎也有良好治疗作用;大黄蒽醌可通过改善肠道微循环、抑制机体炎症反应和肠黏膜上皮细胞损伤来修复肠道黏膜损伤。由于蒽醌类化合物是大黄中的主要有效成分[2],且检测方法也十分成熟、可靠,因此,本实验选择蒽醌类化合物作为考察指标,对微丸的载药量、包封率和释放度进行测定。中药治疗UC的主要给药方法为灌肠和栓剂给药,多数患者不易接受和依从,因此,开发一种口服治疗UC的制剂意义重大。
口服结肠靶向给药系统(oral colon-specific targeting drug delivery system,OCTDDS)是指药物制剂经口服给药后,在上消化道不释放,到达回盲部或结肠部位才定位释放药物从而发挥局部或全身治疗作用的一种新型给药系统。多糖类化合物现已广泛应用于结肠靶向给药系统中,其种类繁多,特性优良,只被结肠菌群特有的糖苷酶所降解,从而具有定位准确、安全可靠和特异性好等优点。已有文献报道[3, 4],多种辅料联合应用后可达到更好的结肠释放效果。本实验以海藻酸钠、果胶为主要辅料,联合壳聚糖、CaCl2制备大黄结肠靶向微丸,考察微丸的释药影响因素,并优化微丸处方,为UC的治疗提供新思路和新选择。
1 仪器与材料BT100-2J蠕动泵驱动器,保定兰格恒流泵有限公司;PHSJ-4A实验室pH计,上海仪电科学仪器股份有限公司;UV9100紫外可见分光光度计,北京莱伯泰科技仪器有限公司;Waters e2695高效液相色谱仪,美国Waters公司;RC8MD溶出试验仪、RZQ-8D取样收集系统,天津市天大天发科技有限公司;THZ88-1型多用恒温台式振荡仪,江苏省太仓鹿河电讯器材厂制造;WG-B6电热鼓风干燥箱,天津市泰斯特仪器有限公司;BY-300薄膜包衣机,长沙市岳麓区中南制药机械厂;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司。
对照品芦荟大黄素(批号110795-201308,质量分数97.8%)、大黄酚(批号110796-201319,质量分数99.6%)、1,8-二羟基蒽醌(批号110829-9702,质量分数98.7%),中国食品药品检定研究院;对照品大黄素(批号P02N6F5299,质量分数≥98%),上海源叶生物科技有限公司;掌叶大黄(批号20141223011),西安润泽生物技术有限公司,规格:1 kg,经河北北方学院中医学院赵恒成教授鉴定为蓼科大黄属植物掌叶大黄Rheum palmatum L. 的干燥根;海藻酸钠(批号20150626006),青岛明月海藻集团有限公司,药用级;果胶酶(批号0210258780),河南正兴食品添加剂有限公司,食品级;果胶,Sigma-Aldrich公司,规格:100 g,批号76282;壳聚糖,浙江金壳药业有限公司,医药级,批号PK-1410302;药用薄膜肠溶包衣预混剂,批号苏药准字F10428102,江苏昕宇药业有限公司;无水氯化钙(CaCl2)、氢氧化钠(NaOH)、磷酸二氢钾(KH2PO4)、醋酸镁(C4H6O4Mg·4H2O)、浓盐酸(HCl)、无水乙醇(C2H6O)等均为分析纯。
Wistar大鼠,雄性,体质量230~260 g,购自北京华阜康生物科技股份有限公司,合格证号SCXK(京)2014-0004。
2 方法与结果 2.1 丸芯制备方法 2.1.1 含药海藻酸钠-果胶溶液的配制称取适当比例的海藻酸钠-果胶粉于装有适量蒸馏水的烧杯中,搅拌后放置12 h使其充分溶胀。取过200目筛大黄生药粉适量,分次加入到溶胀完全并恒温至30 ℃的海藻酸钠-果胶溶液中,充分搅拌,直至形成均一的分散相,停止加热,静置3 h除气泡并冷却至室温。
2.1.2 1%醋酸壳聚糖-CaCl2溶液的配制首先称取适量壳聚糖于烧杯中,然后加入99份的蒸馏水使其分散,再加入另外1份的冰醋酸,边滴边振荡,待壳聚糖充分溶解后,用6 mol/L NaOH调节pH值,并即时测量壳聚糖溶液的pH值,使之调节到合适的pH值。此时,加入称量好的无水CaCl2,搅拌后超声使其溶解,再用NaOH微调,使pH值到达确定值。
2.1.3 大黄微丸丸芯的滴制将含药海藻酸钠-果胶溶液通过蠕动泵滴加到1%醋酸壳聚糖-CaCl2溶液中,选用7号针头,在距液面8 cm处滴下,磁力搅拌,转速200 r/min,成丸后继续搅拌30 min,然后用纱布滤过,蒸馏水洗涤3遍,滤纸吸干微丸表面的水后将其放入振荡仪中,37 ℃恒温振荡2 h,再置于37 ℃恒温干燥箱中干燥12 h,制得大黄微丸丸芯。
2.2 大黄游离蒽醌定量测定方法[5] 2.2.1 测定波长的选择取1,8-二羟基蒽醌对照品适量,置50 mL量瓶中,用无水乙醇配成20.0 mg/L的对照品溶液。取2 mL对照品溶液于5 mL量瓶中,水浴挥干乙醇,残渣加0.8%醋酸镁-乙醇溶液至刻度,摇匀,并放置反应30 min。以0.8%醋酸镁-乙醇溶液为空白,于200~700 nm处扫描。同时,取实验中所用到的辅料成分进行扫描,看有无干扰吸收。从扫描的光谱(图 1)中可以看出,对照品在508 nm处有较强吸收,辅料成分在此波长下均无吸收,因此选择508 nm为测定波长。

|
图 1 1,8-二羟基蒽醌反应液的紫外-可见光区吸收光谱 Fig. 1 Ultraviolet-visible absorption spectrum of reaction liquid of 1,8-dihydroxy anthraquinone |
精密吸取20.0 mg/L 1,8-二羟基蒽醌对照品溶液0.125、0.250、0.500、1.000、2.000、4.000 mL至5 mL量瓶中,水浴挥干乙醇,残渣加0.8%醋酸镁-乙醇溶液至刻度,摇匀,反应30 min。以0.8%醋酸镁-乙醇溶液为空白,在508 nm波长下测定溶液吸光度(A),以A值对1,8-二羟基蒽醌质量浓度(C)进行线性回归,得线性回归方程A=0.037 5 C+0.099 5,r2=0.999 7,表明1,8-二羟基蒽醌在0.5~16.0 mg/L线性关系良好。
2.2.3 供试品溶液的制备取过200目筛大黄生药粉0.025 g,用45%乙醇10 mL在20 kHz频率下超声提取2次,每次10 min,每次提取后的提取液离心10 min,转速3 000 r/min,合并上清液,即为供试品溶液。
2.2.4 大黄游离蒽醌的测定精密吸取供试品溶液5 mL,置10 mL量瓶中,挥干乙醇,加0.8%醋酸镁-乙醇溶液至刻度,摇匀,反应30 min,同样以0.8%醋酸镁-乙醇溶液为空白,508 nm处测定A值。经计算得此方法下提取的游离蒽醌约占大黄生药的2.3%,并以此作为测定微丸中大黄量的依据。
2.3 载药量和包封率的测定取适量干燥后的大黄丸芯,用研钵研成细粉后称取0.025 g的粉末,按照“2.2.3”项下的方法制备供试品溶液,精密吸取供试品8 mL,置10 mL量瓶中,挥干乙醇,加0.8%醋酸镁-乙醇溶液至刻度,摇匀,反应30 min,以0.8%醋酸镁-乙醇溶液为空白,508 nm处测定A值。首先计算出所含游离蒽醌的量,再根据游离蒽醌的量计算大黄的生药量,按下列公式计算微丸丸芯载药量和包封率[6]。
载药量=微丸中所含大黄生药量/丸芯的质量
包封率=微丸中所含大黄生药量/投药量
2.4 体外释放度的评价 2.4.1 模拟胃液和小肠液释放度的测定方法[7]按照《中国药典》2015年版第四部通则中释放度测定法第一法的步骤进行实验,采用转篮法进行测定。模拟胃液为pH 1.2的盐酸溶液,模拟小肠液为pH 6.8的磷酸盐缓冲液(PBS),且各溶出介质在进行实验前均需进行20 min超声脱气处理。各取约0.3 g的微丸进行释放度的测定。首先将待测微丸分别称量并放入各自的转篮中,溶出杯中各加入模拟胃液900 mL,待溶出介质达到规定温度(37.0±0.5)℃后,放入转篮,开动仪器,转速50 r/min,于0.5、1.0、2.0 h时分别取样5 mL(同时补加相应释放介质5 mL),待测。然后取出转篮,将介质更换为900 mL的模拟小肠液,达到规定温度(37.0±0.5)℃后放入转篮,开动仪器,转速50 r/min,于1.0、2.0、3.0 h时分别取样5 mL(同时补加相应释放介质5 mL),待测。
2.4.2 模拟结肠液释放度的测定方法[8]取Wistar雄性大鼠4只,体质量230~260 g,每日ig 0.02 g/mL海藻酸钠-果胶溶液2 mL,连续ig 7 d,正常饲养。将适量已做过胃及小肠释放度实验的微丸放入盛有300 mL含4%大鼠盲肠内容物溶液(实验前45 min内剖腹取结扎后的大鼠盲肠,将盲肠内容物用pH 7.0的PBS稀释,整个过程均需保持无氧环境)的具塞三口烧瓶中,瓶中始终充有氮气。将三口烧瓶固定于恒温磁力搅拌器上,转速100 r/min,温度(37.0±0.5)℃,微丸放入4 h后取样2 mL,离心取上清待测。
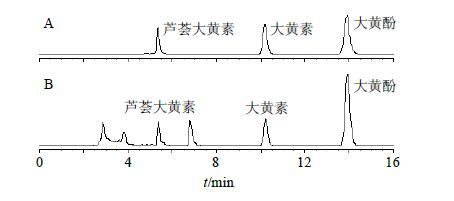
2.4.3 体外释放度定量测定方法采用HPLC测定溶出液中芦荟大黄素、大黄素和大黄酚的量。色谱条件为Hypersil GOLD aQ色谱柱(250 mm×4.6 mm,5 μm),流动相甲醇-0.1%磷酸(80∶20),检测波长254 nm,体积流量1.0 mL/min,柱温(30.0±0.5)℃,进样量10 μL。以各梯度对照品溶液的质量浓度为横坐标(C),各对照品峰面积积分值为纵坐标(Y)绘制标准曲线,得到3种对照品的线性回归方程分别为芦荟大黄素:Y=0.113 2 C+0.009 1,r2=0.999 4,线性范围0.25~16.20 mg/L;大黄素:Y=0.040 9 C-0.012 6,r2=0.999 9,线性范围0.51~32.40 mg/L;大黄酚:Y=0.110 0 C+0.008 2,r2=0.999 6,线性范围0.51~32.40 mg/L。图 2是3种对照品和微丸溶出液的HPLC谱图,3种对照品和微丸溶出液中的3种成分在该色谱条件下分离良好,不受其他成分干扰。
|
图 2 混合对照品溶液 (A) 和微丸溶出液 (B) 的HPLC图 Fig. 2 HPLC of mixed reference solution (A) and pellets dissolution liquid (B) |
用1 mL注射器吸取各溶出液,过0.45 μm针头滤器,去初滤液,取续滤液于进样瓶中,在该色谱条件下测定峰面积,根据如下公式计算其累积释放率(RR)。
$$RR = {{V{C_n} + \sum\limits_{i = 1}^n {V'{C_{n - 1}}} } \over W}$$
Cn为第n次取样时释放介质中芦荟大黄素、大黄素和大黄酚的浓度之和;V为释放介质的体积;V′为第n次取样前的取样体积;W为大黄生药粉(释放微丸中所含大黄生药粉的当量)所能释放的芦荟大黄素、大黄素和大黄酚的质量总和。 2.5 正交设计优化丸芯处方
从前期的单因素试验结果中可以得到,壳聚糖溶液质量分数、CaCl2溶液质量分数、壳聚糖-CaCl2溶液pH值和投药量是影响微丸载药量、包封率以及在模拟胃液和小肠液中累积释放率的重要因素。随着壳聚糖质量分数的升高,微丸载药量和包封率呈现先增后减的趋势,CaCl2溶液的质量分数和壳聚糖-CaCl2溶液pH值对微丸载药量和包封率的影响也是如此;而随着投药量的增加,微丸的载药量、包封率和释放度均成递增趋势。在此基础上通过正交试验进一步优化处方,以壳聚糖溶液质量分数(A)、CaCl2溶液质量分数(B)、壳聚糖-CaCl2溶液pH值(C)和投药量(以大黄-辅料质量比计,D)为考察因素,以微丸的载药量、包封率和释放率为指标,采用总评归一值法,将每个指标均标准化为0~1,再求算各指标归一值的几何平均数,得到总评归一值(OD):OD=(d1d2…dk)1/k,d为各指标归一值,k为指标数[9]。
对于取值越小越好的因素(微丸在模拟胃液和小肠液中的累积释放率)和取值越大越好的因素(载药量和包封率)采用Hassan方法分别进行数学转换求归一值dmin[dmin=(Ymax-Yi)/(Ymax-Ymin)]和dmax[dmax=(Yi-Ymin)/(Ymax-Ymin)],Y为每组实验下所得各指标参数值。
运用L9(34) 正交表进行试验,并对结果进行直观分析和方差分析,确定最优处方。正交试验因素水平见表 1。正交试验结果及方差分析见表 1和表 2。通过表 1中R值可知,各考察因素对微丸的影响大小顺序为D>B>A>C。由方差分析(表 2)可知,因素D具有显著影响(P<0.05),其他因素均无显著影响。选择表 1中平均数大的水平A2、B1、C3、D2,组合成最优水平组合A2B1C3D2,即壳聚糖质量分数0.7%,CaCl2质量分数1%,pH 6.0,投药量为4∶1。
|
|
表 1 L9(34) 正交试验设计及结果 Table 1 Design and results of L9(34) orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
为进一步验证上述制备工艺的可行性和稳定性,以此工艺制备3批样品,进行验证试验,结果如表 3所示。以优化后的处方所制备的3批微丸的OD值均比优化前各组微丸的OD值高,说明3批样品已达到预期效果,且该制备工艺合理、稳定、可行。所制得的大黄微丸丸芯在扫描电镜下的形态如图 3所示,微丸丸芯放大750倍后可以观察到表面有些许微小孔径,丸芯整体直径在1.0~1.2 mm,且球形度良好。
|
|
表 3 3批丸芯制备的验证结果 (n = 3) Table 3 Verification result of three batches of core pellets (n = 3) |

|
A-放大750倍图像 B-放大35倍图像 A-image magnified 750 times B-image magnified 35 times 图 3 大黄微丸丸芯在扫描电镜下的形态 Fig. 3 Form of Rheum Pellets pill-core by scanning electron microscope |
以包衣后的丸芯在模拟胃液、小肠液和结肠液中的累积释放率为指标,对微丸的包衣增重进行筛选。将包衣预混剂用80%乙醇溶液配制质量分数为6%的包衣液,将丸芯置于包衣锅中,转速控制在45 r/min,温度37 ℃,在滚动下喷入包衣液,并使微丸分别增重15%、20%、30%、35%、45%。微丸干燥后按照“2.4.1”和“2.4.2”项下方法进行释放度考察,其体外释药情况如表 4所示。结果表明,以增重到30%的包衣微丸能有效减少微丸在模拟胃及小肠液中的释放,而在模拟结肠液中快速释放药物。
|
|
表 4 不同包衣增重下微丸的释药情况 (n = 3) Table 4 Drug release of different pellets on different weightening of film coating (n = 3) |
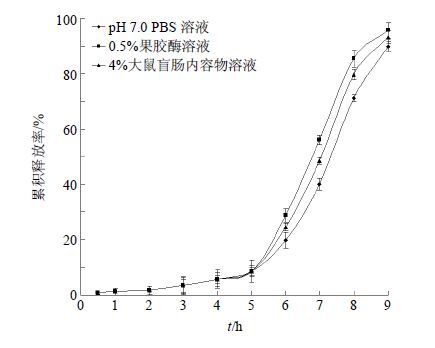
取同一批包衣增重为30%的大黄微丸按照“2.4.2”项下的方法进行体外释放度的考察。前2 h释放介质为pH 1.2的盐酸溶液,之后更换为pH 6.8的磷酸盐缓冲液,最后分别置于以下3种介质:pH 7.0的PBS、0.5%果胶酶柠檬酸盐缓冲液、4%大鼠盲肠内容物溶液中4 h。按照“2.4.3”项下的方法测定,并计算累积释放率。图 4所示为大黄包衣微丸体外模拟结肠液的释放曲线,与pH 7.0的PBS相比,4%大鼠盲肠内容物溶液和0.5%果胶酶柠檬酸盐缓冲液均可促进大黄微丸的降解,说明其具有良好的酶降解作用。
|
图 4 大黄微丸体外模拟结肠释药考察 (n = 3) Fig. 4 Modeling of colonic drug release in vitro of Rheum Pellets (n = 3) |
海藻酸钠、果胶、壳聚糖均属于多糖类化合物,能特异性地被结肠细菌产生的糖苷酶所降解,具有制备酶触型结肠靶向给药制剂的潜力。其中海藻酸钠和果胶分子含有自由的羧基和羟基,均能与2价金属离子形成类似“蛋盒”的三维网状结构的凝胶物质,通过调节海藻酸钠、果胶以及金属离子的浓度可控制药物的释放;此外,海藻酸钠和果胶为阴离子型聚合物,能与带正电的阳离子聚合物壳聚糖发生静电离子吸引作用,形成聚电解质复合物(polyelectrolyte complex,PEC)。由于壳聚糖是疏水性材料,合用后能增加凝胶骨架的密度,使药物释放减慢。
本实验研究发现,海藻酸钠与壳聚糖联合应用要优于海藻酸钠直接与Ca2+作用,前者所得的微丸没有出现“突释”现象,这与马树强等[11]的研究结果一致。单独使用果胶的缺点是果胶疏水性差,在水中易溶胀,导致药物提前释放,而果胶与壳聚糖相联合可在一定程度上避免这种现象。本实验在前人研究的基础上,将海藻酸钠和果胶同时与壳聚糖联用,并用Ca2+交联制备大黄结肠靶向制剂,从原理上来讲,是合理可行的;同时,从实验结果来看,这种联合应用在一定程度上解决了“蛋盒”结构的不足,克服了微丸在水中易溶胀的现象。但也发现了一些问题,在实验初期探究了海藻酸钠与果胶的比例问题,如果加入的果胶比例太大会使微丸的黏性增大,给干燥过程带来极大不便,因此最终确定了海藻酸钠与果胶比例为7∶1。对于滴制法制备该类微丸出现的此种现象的原因以及滴制法对于2种辅料的合用是否存在缺陷还有待于深入研究。
制备出合适的酶触型丸芯后再包以肠溶衣则得到目的制剂,包衣增重30%的微丸在体外释放实验中能得到较为理想的结肠释放的效果。但体外释放结果表明,该微丸在结肠模拟液中4 h已基本释放完全,与实验最初想要得到的的结肠缓释制剂还有一定差距,并且还需考察该制剂在体内释放的情况,以辅助对其制备工艺更进一步的完善和改进。
本实验从中药大黄的整体角度出发,制备其结肠靶向制剂,并考察该制剂的体外释放度,因此,在制备大黄口服结肠靶向给药微丸时并未使用大黄提取物亦或是某一种或几种单体成分。在测定微丸的载药量时,需要对微丸中的大黄蒽醌类成分进行提取,从而间接地测定微丸中大黄的量。有研究表明[12],超声法对大黄游离蒽醌的提取效率要明显优于常规煎煮法和乙醇加热回流提取法,且以乙醇作为提取溶剂对大黄蒽醌的提取效果最好,这说明超声提取法对中药活性成分的提取效率较高,并且超声法更加简便、快捷,因此本实验在测定微丸载药量时选择超声法对大黄游离蒽醌进行提取。通过正交试验最终确定最优提取工艺为过200目筛大黄药粉0.025 g用45%乙醇10 mL,20 kHz频率的超声下提取2次,每次10 min。
本实验制备的大黄微丸其释药原理包括2种,一种是骨架溶蚀作用,一种是酶降解作用。多糖虽然能特异性地被结肠细菌产生的糖苷酶所降解,但也具有亲水性和膨胀性[13],如果不加以增加其疏水性或保护的话很容易在上消化道因吸水膨胀而使整个骨架溶蚀,变得松散,药物便会提前释放,不能发挥结肠靶向的目的。将酶降解和pH敏感材料相联合,能很好地解决这个问题。本实验所制备的pH依赖-酶触型大黄微丸能有效减少药物在模拟胃液和小肠液中的释放,而在溶蚀作用和酶降解作用下迅速在模拟结肠液中溶蚀降解,体外模拟尚且如此,但考虑到结肠是水分吸收的主要部位,结肠内的溶液自然不会太多,微丸在结肠内的溶蚀作用便会减弱,酶降解则成为了微丸释药的主要作用,这是否对微丸在结肠的释药有一定的影响以及微丸在大鼠体内的释放与体外释放是否存在不同,还有待于进一步的研究。
| [1] | 谢 燕, 李国文, 马越鸣. 大黄多糖研究进展[J]. 中国新药杂志, 2010, 19(9): 755-758. |
| [2] | 刘喜纲, 刘 沛, 陈大为, 等. 优选大黄总蒽醌结肠定位壳聚糖微球的制备工艺[J]. 中草药, 2015, 46(1): 38-42. |
| [3] | Hiorth M, Versland T, Heikkila J, et al. Immersion coating of pellets with calcium pectinate and chitosan[J]. Int J Pharm, 2006, 308(1/2): 25-32. |
| [4] | Mladenovska K, Raicki R S, Janevik E I, et al. Colon-specific delivery of 5-aminosalicylic acid from chitosan-Ca-alginate microparti cles[J]. Int J Pharm, 2007, 342(1/2): 124-136. |
| [5] | 王佩琪, 郭伟英, 王轶晶, 等. 超声提取大黄游离蒽醌的研究[J]. 中成药, 2004, 26(7): 78-79. |
| [6] | 钦富华, 朱玉竹, 许娇娇. 吲哚美辛结肠定位凝胶微丸的研究[J]. 安徽医药, 2013, 17(3): 380-382. |
| [7] | 中国药典 [S]. 二部. 2015. |
| [8] | Sinha V R, Kumria R. Polysaccharide matrices for microbially triggered drug delivery to the colon[J]. Marcel Dekker Inc, 2004, 30(2): 143-150. |
| [9] | 吴 伟, 崔光华, 陆 彬. 实验设计中多指标的优化: 星点设计和总评“归一值”的应用[J]. 中国药学杂志, 2000, 35(8): 530-533. |
| [10] | 张玉霞, 辜鹏程, 田 睿, 等. 酶降解-时滞型载姜黄素结肠定位胶囊的体外释药研究[J]. 第三军医大学学报, 2014, 36(16): 1670-1673. |
| [11] | 马树强, 彭建强, 李中檀, 等. 成骨生长肽壳聚糖-海藻酸钠微球的制备及体外检测[J]. 中国组织工程研究, 2012, 16(25): 4663-4666. |
| [12] | 张海晖, 裘爱泳, 刘军海, 等. 超声技术提取大黄蒽醌类成分[J]. 中成药, 2005, 27(9): 1075-1078. |
| [13] | 方勇兵, 崔升淼. 口服结肠定位给药系统中辅料的应用[J]. 中国医药工业杂志, 2014, 45(1): 83-87. |
 2016, Vol. 47
2016, Vol. 47

