天然产物及其衍生物在人类健康与医药发展方面扮演着越来越重要的作用,藤黄是藤黄科植物藤黄树干经切伤后所分泌的干燥树脂,藤黄酸(GA)作为藤黄的主要成分具有多种生物活性,包括维持机体稳态、抗炎、解毒[1],近年来发现藤黄酸对多种肿瘤具有显著的抑制作用,如肝癌[2]、胃癌、乳腺癌[3]、肺癌、鼻癌和胰腺癌,藤黄酸通过抑制细胞蛋白酶体活性,抑制核因子-κB(NF-κB)信号通路[2],抑制肿瘤血管内皮细胞增生[4]等机制抑制肿瘤生长。然而藤黄酸在水中溶解度很小,仅为10 μg/mL[5, 6],藤黄酸对高温、稀碱、有机溶剂等环境条件敏感,在其常用溶解溶剂乙醇中8 h也会降解20%。藤黄酸口服生物利用度极低,静脉给药藤黄酸在大鼠体内消除半衰期为15 min,藤黄酸的血浆蛋白结合率为31.1%,血浆清除速率快,组织分布广泛,iv给药后藤黄酸主要通过胆汁排泄,在大鼠的胆汁中检测到藤黄酸的4个代谢物,给药后16 h内藤黄酸在胆汁中的平均累积排泄百分率为36.5%[7];藤黄酸静脉直接注射时存在血管刺激性[8],病人顺应性差。
虽然目前已经有文献报道藤黄酸胶束、磁性Fe3O4粒子、混悬制剂、口服乳铁蛋白等剂型[9, 10, 11, 12],但它们与脂质体相比存在不能静脉给药、粒径大、血液循环时间短、制剂稳定性差、药物包封率低等缺点,因此本实验制备长循环脂质体制剂[13]以改善藤黄酸原料药的制剂学缺点,同时进行了处方优化和大鼠体内药动学评价。
1 仪器与材料TQ-S三重四级杆质谱仪、Acquity UPLC超高效液相色谱仪,美国Waters公司;恒温水浴,江苏金坛医疗仪器厂;Mini spin型高速离心机,德国Eppendorf公司;MD-200-2型氮气吹干仪,杭州奥盛仪器有限公司;BS224S型电子分析天平,德国赛多利斯公司;Nicomp 380DLS激光粒度分析仪,美国PSS公司;JSM-6700F扫描电子显微镜(SEM),日本JEOL公司;高效液相色谱仪,日本岛津LC-solution;切向流超滤系统,Sartorius Stedim Biotech;Optima MAX-XP超速离心机,Beckman Coulter Inc.,Pasadena,CA,美国。
藤黄酸对照品(批号ZL20150713,质量分数98%)、雷公藤红素对照品(批号ZL20150615,质量分数98%),藤黄酸原料药(95%,批号20150409)、雷公藤红素原料药(95%,批号20150326),深圳市牌牌科技有限公司;蛋黄磷脂酰胆碱(PC),质量分数80%以上,广州汉方现代中药研究开发有限公司;胆固醇,上海宝曼生物科技有限公司;二硬脂酰基磷脂酰乙醇胺聚乙二醇2000(DSPE-PEG 2000),西安瑞禧生物科技有限公司;聚乙二醇400(PEG 400),辽宁奥克医药辅料有限公司;羧甲基纤维素钠(CMC-Na),国药集团化学试剂有限公司;醋酸乙酯(质量分数99.9%)、乙腈(色谱级)、甲醇(色谱级)、甲酸(质量分数99.9%),美国Sigma公司;盐酸、乙醇等化学试剂均为分析纯,化学试剂国药控股有限公司。健康成年雄性Wistar大鼠,(250±5)g,购自吉林大学实验动物中心,许可证号SCXK-(辽)2013-0003。
2 方法与结果 2.1 藤黄酸长循环脂质体制备称取不同处方量的胆固醇、PC、DSPE-PEG 2000等成膜材料和藤黄酸300 mg,溶于160 mL有机溶剂乙醇中作为有机相;在35 ℃水浴下,将上述有机相注入到磷酸缓冲溶液(PBS,水相)中,按1∶10油水比进行混合,混合后继续搅拌30 min,除去残留乙醇,超滤法将体积浓缩至300 mL,得到藤黄酸长循环脂质体混悬液[14, 15]。
2.2 粒径及表面形态测定采用Nicomp电位/粒度仪来测量藤黄酸长循环脂质体粒径大小。测定温度23 ℃,黏度设置1.333 cP,采用高斯分布测定粒径值。激光粒度分析结果显示其平均粒径为(121.7±11.2)nm,多分散系数(PDI)为0.153±0.017,脂质体粒径分布较窄。粒径分布如图 1所示。
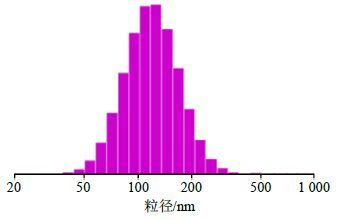
|
图 1 藤黄酸脂质体粒径分布 Fig. 1 Particle size distribution of GA liposomes |
将脂质体溶液滴加到大小适中的硅片上,室温干燥。在硅片样品表面镀金增强导电性,贴上导电胶后置于样品室,选择加速电压为3.0 kV,采用扫描电镜观察前体脂质体的表面形态。SEM观察结果如图 2所示,藤黄酸脂质体近似于球形,大小均一,表面光滑。

|
图 2 藤黄酸脂质体SEM图 (×10 000) Fig. 2 SEM of GA liposomes (× 10 000) |
采用超速离心法分离脂质体与游离药物,测定药物包封率[15],先将藤黄酸长循环脂质体混悬液用盐酸调至pH值约1.2,使脂质体凝聚,然后4 ℃、200 000×g超速离心30 min,上清液为游离药物,沉淀为脂质体。按“2.4”项色谱条件测定上清液中游离藤黄酸的质量浓度(C1)。
取脂质体溶液1 mL加入0.5 mL乙腈,涡旋1 min使脂质体完全破乳,按“2.4”项色谱条件测定溶液中藤黄酸的总质量浓度(C0)。超滤后藤黄酸脂质体体积为V0,脂质体组方中加入的脂质体质量为W0。
包封率=1-C1/C0
载药量=(C0-C1)V0/W0
2.4 藤黄酸的测定方法色谱柱为Agilent Zorbax Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm);以甲醇-0.1%冰醋酸溶液(93∶7)为流动相;检测波长为360 nm,柱温35 ℃,总运行时间10 min,进样量为20 μL,理论塔板数按藤黄酸计算应不低于3 000[16]。以50%乙腈溶液作为溶剂制备供试品,以藤黄酸峰面积为纵坐标(Y),藤黄酸质量浓度为横坐标(X),通过外标法绘制标准曲线,藤黄酸在质量浓度为5~100 μg/mL线性良好,线性回归方程为Y=182 534 X+86 228,R2=0.999 1;在已知量的藤黄酸溶液(45 μg/mL)中加入100%的藤黄酸对照品,计算加样回收率为101.60%,RSD值为0.57%;45 μg/mL的供试品溶液连续6次测定精密度RSD值为0.62%;45 μg/mL的供试品溶液分别配制6次测定重复性RSD值为0.76%;分别于供试品(45 μg/mL)制备后0、0.5、1、1.5、2、4 h测定其稳定性,RSD值为0.79%。
2.5 脂质体处方优化在单因素试验的基础上,固定藤黄酸加入量300 mg,对3个影响藤黄酸包封率(Y)的主要因素进行优化,即胆固醇用量(X1)、PC用量(X2)、DSPE-PEG 2000用量(X3)。采用Box-Behnken设计(BBD)3因素3水平共15组试验,如表 1所示。测定不同实验条件对包封率影响,然后建立数学模型优化影响包封率的实验因素得到最优组方。利用响应面方法(RSM)分析3个因素之间的相互影响关系,最后验证试验得到的最优组合。BBD方案及试验结果采用SAS 9.2软件计算。
|
|
表 1 BBD方案及试验结果 Table 1 Matrix of BBD and corresponding test results |
BBD方案的15组试验结果见表 1,回归分析结果见表 2。模型P值小于0.01,R2=97.48%,表明模型具有一定的准确性和可行性,该模型拟合程度良好,实验误差很小,可以用此模型进行分析和预测。得到多元二次回归方程为Y=92.45-3.85 X1+2.20 X2-0.12 X3-4.61 X12+1.77 X1X2-4.00 X1X3-8.59 X22-1.09 X2X3-3.61 X32。
|
|
表 2 回归分析结果 Table 2 Statistical results of regression analysis |
由表 2可知,模型的1次项X1、X2,交互项X1X3,2次项X12、X22、X32显著(P<0.05、0.01),表明各个自变量与因变量之间不是简单的线性关系,具有一定的交互作用,可以优化得到最优的Y;失拟项检验不显著,表明该回归模型没有过拟合,能够准确地预测不同条件下藤黄酸长循环脂质体的Y。
回归分析结果的响应曲面图如图 3所示。从图 3中可以在检测范围内观测到3个响应曲面均为开口向下的凸形曲面,在优化参数范围内响应值(Y)存在极高值,说明脂质体包封率的最优条件存在于所设计的因素水平范围之内。图 3-B中等高线呈椭圆形,且坐标轴与椭圆形的轴线之间存在着显著的夹角,表明这2个因素(X1X3)之间存在显著的交互作用。计算得到最优提取条件的编码值为X1=−0.520 79,X2=0.057 861,X3=0.262 86,即最佳处方为胆固醇444 mg、PC 1 823 mg和DSPE-PEG 2000 705 mg,同时由回归方程得到包封率的预测值为93.5%。为进一步检验BBD试验模型预测的准确性与可行性,采用最优处方配比制备藤黄酸长循环脂质体,进行3次平行的验证试验,包封率分别为92.8%、91.9%、92.2%,平均包封率为92.3%,与预测值的相对误差为1.28%。藤黄酸质量浓度分别为0.97、0.95、0.98 mg/mL,载药量分别为8.81%、8.58%、8.82%。

|
图 3 响应面和等高线图 Fig. 3 Response surfaces and contours |
采用透析法研究脂质体体外释放情况,用NaHCO3和EDTA溶液洗去透析袋(相对分子质量截留量12 000~14 000)上残留的甘油和杂质,取2 mL脂质体悬浮液置于透析袋中并加入0.2%的CMC-Na,释放介质为5%牛血清的磷酸盐缓冲液(PBS,pH 7.4)500 mL,37 ℃恒温,搅拌速度300 r/min。在固定的时间点吸取1 mL透析溶液,同等数量的新鲜释放介质补充到缓冲溶液中。
2.6.1 供试品溶液制备脂质体溶液制备:在质量浓度为1 mg/mL的藤黄酸脂质体中加入0.2%的CMC-Na配制成供试品溶液,在“2.6”项条件下测定其释放率。对照品溶液制备:对照样品采用0.2%的CMC-Na配制成1 mg/mL藤黄酸溶液,并在与脂质体相同条件下测定其释放率。
2.6.2 UPLC-MS/MS方法测定藤黄酸[17, 18](1)质谱条件:ESI电离源,正离子扫描,喷雾电压3.0 kV,碰撞电压30 V,源温度150 ℃,源温度500 ℃,锥孔气体体积流量150 L/h,碰撞气体体积流量0.15 mL/min,扫描方式为多反应监测(MRM),用于检测的离子为m/z 451.3→201.1(雷公藤红素,内标)[19],m/z 629.1→573.2(藤黄酸)[18]。
(2)液相条件:流动相为甲醇-0.1%甲酸水溶液,用0.22 μm滤膜滤过;流动相以0.35 mL/min的体积流量通过Acquity UPLC® BEH C18柱(50 mm×2.1 mm,1.7 μm,美国Waters公司),柱温为30 ℃。0~1 min,10%~90%甲醇;1~4 min,90%甲醇;4~5 min,90%~10%甲醇;自动进样器温度为10 ℃,进样量为5 μL。
(3)线性关系及方法学考察:以藤黄酸峰面积积分值/雷公藤红素峰面积积分值为纵坐标(Y),藤黄酸质量浓度为横坐标(X),采用内标法绘制标准曲线,藤黄酸在5~5 000 ng/mL线性关系良好,回归方程为Y=0.004 9 X+0.005 2,R2=0.999 3;在已知量的藤黄酸溶液(2 000 ng/mL)中加入100%的藤黄酸对照品,计算加样回收率为98.30%,RSD值为1.62%;低、中、高质量浓度(10、1 000、4 800 ng/mL)样品的准确度(分别制备了6个供试品,然后测定其质量浓度,计算测定值与理论值间的差异)分别为97.65%、98.47%、100.10%(n=6),精密度RSD为1.48%、1.25%、0.63%(n=6)。
2.6.3 体外释放测定结果脂质体与原料药在PBS中释放如图 4所示,脂质体48 h累积释放率大于95%,4 h累积释放率约为50%,与原料药相比释放平缓、长效。0~5 h内脂质体释放较快,5~12 h释放速度减慢,初始释放较快可能是因为脂质体制剂中存在一定量的游离药物所致。
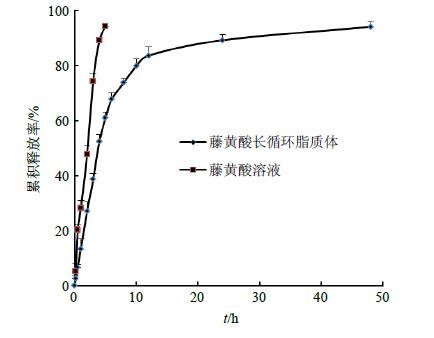
|
图 4 藤黄酸脂质体体外累积释放率 (x±s,n = 6) Fig. 4 Release of GA liposomes in vitro (x±s,n = 6) |
将3批藤黄酸长循环脂质体封于西林瓶中,在温度4 ℃条件下保存,连续考察15 d,每5天取样测定包封率、平均粒径、藤黄酸质量浓度。结果如表 3所示。3批藤黄酸长循环脂质体在温度4 ℃条件下保存15 d后,外观无明显变化,粒径无明显变大,脂质体渗漏、藤黄酸降解均小于5%,说明脂质体可以提高藤黄酸的稳定性。
|
|
表 3 藤黄酸脂质体稳定性 Table 3 Stability of GA liposomes |
将藤黄酸溶于乙醇中制成质量浓度100 mg/mL溶液,再用PEG 400稀释至1 mg/kg[18],将12只雄性Wistar大鼠随机分成2组,一组尾iv藤黄酸溶液1 mg/kg,另一组尾iv藤黄酸长循环脂质体溶液1 mg/kg,给药后5、10、20、30 min及1、2、4、6、8、10、12、24 h大鼠眼眶采血0.2 mL,加入肝素钠抗凝,2 827×g离心10 min,分离血浆,备用。
取血浆50 μL,加入300 ng/mL雷公藤红素内标溶液10 μL,漩涡混合2 min,加入醋酸乙酯1 mL,漩涡混合1 min,6 000 r/min离心10 min,吸取上层有机相,37 ℃氮气吹干,加入50%甲醇100 μL复溶,6 000 r/min离心10 min,取80 μL样品待测。
采用“2.6.2”项UPLC-MS/MS方法测定血浆中藤黄酸。对UPLC-MS/MS方法可行性进行验证,方法专属性良好,无内源性干扰;最低定量限5 ng/mL;以藤黄酸峰面积积分值/雷公藤红素峰面积积分值为纵坐标(Y),藤黄酸质量浓度为横坐标(X),绘制标准曲线,藤黄酸在5~1 000 ng/mL线性关系良好,回归方程为Y=0.003 4 X+0.013 7,R2=0.999 6;低、中、高质量浓度(10、40、800 ng/mL)样品的准确度分别为91.54%、104.58%、101.05%(n=6),精密度RSD分别为3.87%、6.19%、6.02%(n=6);平均回收率分别为71.79%、69.93%、68.88%(n=6);基质效应(对照品峰面积为A,相同质量浓度的对照品加入到处理过的血浆中测得的峰面积为B,B与A的比值为基质效应,通过基质效应评价血浆中内源性物质对检测的影响)结果分别为95.31%、90.48%、94.31%(n=6);内标(300 ng/mL)的平均回收率和基质效应分别为76.78%和96.77%(n=6)。
大鼠尾iv藤黄酸溶液和与藤黄酸长循环脂质体的药时曲线见图 5。采用Winnonlin 5.2药动学分析软件计算药动学参数,主要药动学参数以非房室模型计算结果见表 4。结果表明,藤黄酸长循环脂质体血药浓度明显高于普通制剂,半衰期为9.97 h,是藤黄酸的4.43倍;脂质体中藤黄酸的AUC0~24 h为22.55 μg∙h/mL,是藤黄酸的4.73倍。
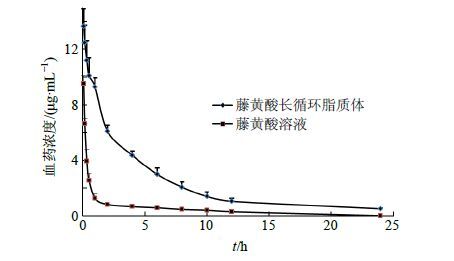
|
图 5 大鼠iv藤黄酸溶液和藤黄酸长循环脂质体药时曲线 (n = 6) Fig. 5 Concentration-time curves of rats after administration with GA long-circulating liposomes or GA in rats (n = 6) |
|
|
表 4 藤黄酸及藤黄酸长循环脂质体在大鼠体内主要药动学参数 (x±s,n = 6) Table 4 Main pharmacokinetic parameters after administration with GA long-circulating liposomes or GA in rats (x±s,n = 6) |
藤黄酸在抗炎、抗肿瘤、自身免疫疾病等领域具有良好的效果,但其水溶性差、稳定性低、血浆清除快、组织分布广和血管刺激性劣势限制其临床应用。本实验通过乙醇注入法将藤黄酸制成长循环脂质体制剂,以改进其治疗效果。采用BDD和RSM用来分析3个对脂质体包封率影响较大的因素,得到最优的藤黄酸脂质体组方,包封率为92.3%。脂质体平均粒径为121.7 nm,呈正态分布且分布较窄,电镜扫描结果表明,脂质体形态较好呈圆形或椭圆形微粒,体外释放研究表明,脂质体释放稳定、平缓。
藤黄酸脂质体采用聚乙二醇修饰,制成“隐形”脂质体,在体内减少被吞噬细胞识别的几率,相对于藤黄酸具有较长的半衰期、较高的血药浓度和较低的清除率。藤黄酸长循环脂质体水溶性较好,与藤黄酸相比在外周室分布的药物较少,初始血药浓度较高。本实验制备的藤黄酸长循环脂质体包封率高、体外释放稳定、体内循环时间长,具有良好的临床应用前景。
| [1] | 杨企铮, 贾淑杰, 李德华. 中药藤黄的近代研究 [J]. 中国肿瘤临床, 1994(6): 464-466. |
| [2] | Park M S, Kim N H, Kang C W, et al. Antimetastatic effects of gambogic acid are mediated via the actin cytoskeleton and NF-κB pathways in SK-HEP1 cells [J]. Drug Develop Res, 2015, 76(3): 132-142. |
| [3] | Wang S P, Wang L, Chen M W, et al. Gambogic acid sensitizes resistant breast cancer cells to doxorubicin through inhibiting P-glycoprotein and suppressing survivin expression [J]. Chem-Biol Interact, 2015, 235: 76-84. |
| [4] | Lu N, Hui H, Yang H, et al. Gambogic acid inhibits angiogenesis through inhibiting PHD2-VHL-HIF-1α pathway [J]. Eur J Pharm Sci, 2013, 49(2): 220-226. |
| [5] | Yin D K, Yang Y, Cai H X, et al. Gambogic acid-loaded electrosprayed particles for site-specific treatment of hepatocellular carcinoma [J]. Mol Pharm, 2014, 11(11): 4107-4117. |
| [6] | 侯文洁, 陈保来, 赵祎武, 等. 藤黄酸稳定性研究 [J]. 中草药, 2011, 42(9): 1755-1758. |
| [7] | 郝 琨, 柳晓泉, 王广基. 藤黄酸在大鼠体内的药代动力学 [J]. 中国药科大学学报, 2005, 36(4): 338-341. |
| [8] | Yao J, Li Y K, Sun X J, et al. Nanoparticle delivery and combination therapy of gambogic acid and all-trans retinoic acid [J]. Int J Nanomed, 2014, 9(1): 3313-3324. |
| [9] | 张文君, 吴 凡, 王 鑫, 等. 星点设计-效应面法优化藤黄酸纳米混悬剂处方 [J]. 中国药剂学杂志: 网络版, 2014, 12(2): 43-51. |
| [10] | 王 盈. 用于口服给药的藤黄酸-乳铁蛋白纳米粒 [J]. 中国医药工业杂志, 2013, 44(4): 332. |
| [11] | Zhu X, Zhang C, Wu X L, et al. Preparation, physical properties, and stability of gambogic acid-loaded micelles based on chitosan derivatives [J]. Drug Dev Ind Pharm, 2008, 34(1): 2-9. |
| [12] | Wang C L, Zhang H J, Chen Y, et al. Gambogic acid-loaded magnetic Fe3O4 nanoparticles inhibit Panc-1 pancreatic cancer cell proliferation and migration by inactivating transcription factor ETS1 [J]. Int J Nanomed, 2012, 7: 781-787. |
| [13] | 程 怡, 吴 琼, 余秋强, 等. Box-Behnken效应面法优化多西他赛长循环脂质体处方 [J]. 中草药, 2012, 43(10): 1946-1950. |
| [14] | 方 玲, 孟 楣, 夏伦祝, 等. 新藤黄酸脂质体冻干粉的制备及其包封率测定 [J]. 安徽医药, 2009, 13(6): 596-598. |
| [15] | 王淑娟. 雷公藤甲素脂质体的制备及质量的初步研究 [D]. 扬州: 扬州大学, 2010. |
| [16] | 张文君, 寇永强, 朱鹏举. 藤黄有效成分——藤黄酸的研究进展 [J]. 中国药剂学杂志, 2013, 11(6): 121-129. |
| [17] | Zheng B, Teng L R, Xing G Y, et al. Proliposomes containing a bile salt for oral delivery of Ginkgo biloba extract: Formulation optimization, characterization, oral bioavailability and tissue distribution in rats [J]. Eur J Pharm Sci, 2015, 77: 254-264. |
| [18] | Hua X D, Liang C, Dong L, et al. Simultaneous determination and pharmacokinetic study of gambogic acid and gambogenic acid in rat plasma after oral administration of Garcinia hanburyi extracts by LC-MS/MS [J]. Biomed Chromatogr, 2015, 29(4): 545-551. |
| [19] | Zhang J, Li C Y, Xu M J, et al. Oral bioavailability and gender-related pharmacokinetics of celastrol following administration of pure celastrol and its related tablets in rats [J]. J Ethnopharmacol, 2012, 144(1): 195-200. |
 2016, Vol. 47
2016, Vol. 47


