白藜芦醇(resveratrol,Res)是一种多酚类化合物,具有调血脂、保护心血管、抗风湿、抗肿瘤、抗氧化等药理作用[1, 2, 3, 4]。但由于Res水溶性较差、半衰期短、光不稳定等,导致其口服吸收生物利用度很低,大大限制了其在保健品及药品方面的应用。因此,开发新型的Res给药系统显得非常必要。
固体脂质纳米粒(solid lipid nanoparticles,SLN)作为一种新型的载药系统,以固态天然或合成的类脂如卵磷脂、单硬脂酸甘油酯、三酰甘油等为载体,将药物包裹或夹嵌于类脂中而制备的固体胶粒给药系统,粒径范围在10~1 000 nm,是提高难溶性药物口服吸收生物利用度的有效方法。但同时容易导致血药浓度的剧烈波动,损伤人体器官,增加副作用[5, 6, 7]。
亲水凝胶骨架缓释片(hidrophilic hydrogel matrix sustained-release tablets)是缓释制剂研究的热点之一。骨架材料为亲水性的高分子材料,口服后遇水形成凝胶屏障,从而可以控制药物缓慢释放,其中羟丙基甲基纤维素(hydroxypropylmethyl- cellulose,HPMC)是该体系最常用的缓、控释材料之一。将SLN进一步制备成凝胶缓释骨架片可有效地控制SLN在体内的缓慢释放,从而降低血药浓度剧烈波动,减少副作用。关于白藜芦醇固体脂质纳米粒(resveratrol-solid lipid nanoparticles,Res-SLN)的研究较多[8, 9, 10],但其纳米粒的凝胶骨架缓释片的研究未见报道。本实验将为Res缓释制剂及其他难溶性药物缓释制剂相关研究提供有价值的参考。
1 仪器与材料V5型小型实验室粉体混匀机,广州康诺医药机械公司;LC-10A型高效液相色谱仪,日本岛津公司;101-2AB型电热鼓风干燥箱,天津泰斯特仪器有限公司;TDP型单冲压片机,上海第一制药机械厂;ZRS-8型智能溶出试验仪,天津大学无线电厂;Malvern Zetasizer动态激光散射仪,英国马尔文仪器有限公司;旋转蒸发仪,艾卡仪器设备有限公司;HWS-12型智能水浴锅,上海一恒科技有限公司;BP 210D型电子天平,赛多利斯科学仪器有限公司;Nanosep®超滤离心管,截留相对分子质量10 000,美国PALL公司。
Res原料药,批号130925,质量分数>98%,南京泽朗医药科技有限公司;Res对照品,中国食品药品检定研究院,批号111535-200502,质量分数≥99.5%;硬脂酸镁,辽宁奥达制药有限公司;乳糖,北京凤礼精求商贸有限责任公司;甘露醇,青岛明月海藻集团有限公司;蔗糖,西安悦来医药科技有限公司;泊洛沙姆(F68),上海力明工贸有限公司;聚乙二醇(PEG)、胆酸钠、单硬脂酸甘油酯,国药集团化学试剂有限公司;卵磷脂,上海艾韦特医药科技有限公司;HPMC,上海卡乐康包衣技术有限公司;乙腈、甲醇为色谱纯;其余试剂均为分析纯。
2 方法与结果 2.1 Res-SLN的制备[10]将1.5 g的卵磷脂与1.0 g的Res溶解于无水乙醇。取单硬脂酸甘油酯1.5 g,熔融(60 ℃)后加入到上述溶液作为油相,置于茄型瓶中。在60 ℃条件下,用旋转蒸发仪除去有机溶剂,得到油膜。以质量分数为1.0%的F68与胆酸钠混合物(1∶1)作为水相,将水相注入到茄型瓶中,水化,于室温超声40 min,即得Res-SLN混悬液。4 ℃冰箱保存备用,空白SLN采取同样的方法制备。
2.2 Res分析方法的建立[8, 9, 10] 2.2.1 色谱条件色谱柱为Waters C18(250 mm×4.6 mm,5 μm);流动相为乙腈-水(60∶40);体积流量1.0 mL/min;柱温25 ℃;检测波长307 nm;进样量10 μL。在此色谱条件下,HPLC法专属性较高,见图 1。
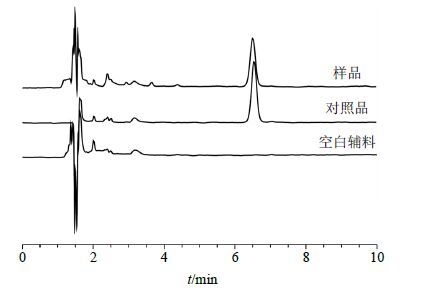
|
图 1 Res定量测定色谱图 Fig. 1 HPLC of quantitative determination of Res |
精密量取Res-SLN溶液0.5 mL,加入乙醇进行破乳,定容至合适体积的容量瓶即得,备测。
2.2.3 线性关系考察精确称取Res对照品10 mg溶于无水乙醇,用40 mL无水乙醇超声溶解,放置15 min后定容至50 mL。精密吸取不同体积的储备液,用乙腈稀释成Res质量浓度分别为0.5、5.0、10、20、50、100 μg/mL的对照品溶液。进样,记录药物峰面积,以Res质量浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,得线性回归方程A=17.792 C+2.118 3,r=0.999 8,结果显示,Res在0.5~100 μg/mL线性关系良好。
2.2.4 精密度试验分别取质量浓度为0.5、10、100 μg/mL的对照品溶液,按照上述色谱条件1 d内测定5次并连续测定3 d,计算日内精密度和日间精密度。结果显示,低、中、高3个质量浓度溶液的日内与日间精密度分别为0.29%、0.33%、0.41%和0.83%、1.04%、1.19%。
2.2.5 稳定性试验取Res-SLN溶液按“2.2.2”项方法制备供试液,分别于0、6、12、24、48 h进行HPLC测定,记录各时间点对应的峰面积,计算Res峰面积的RSD。结果表明,各时间点峰面积的RSD为1.84%,因此供试品溶液在48 h内稳定。
2.2.6 重复性试验取Res-SLN溶液按“2.2.2”项方法制备6份供试品溶液,进行HPLC测定,记录峰面积。结果显示Res质量浓度的RSD为1.38%。
2.2.7 加样回收率试验取空白SLN混悬液,分别加入0.5、10、100 μg的Res对照品,乙醇定容,过0.22 μm滤膜,取续滤液HPLC测定,计算回收率。结果显示,低、中、高添加量Res的回收率分别为97.11%、100.49%、99.83%,RSD分别为1.89%、0.76%、1.02%。
2.3 Res-SLN包封率、载药量及粒径的测定[8, 9, 10]取1 mL空白SLN混悬液于超滤离心管中,分别加入质量浓度为0.5、10、100 μg/mL的Res对照品溶液各1 mL,12 000 r/min离心50 min样测定,计算回收率。结果显示,高、中、低质量浓度加样回收率分别为98.14%、97.86%、95.12%,RSD均小于2.5%。表明超滤离心管对游离Res无吸附作用,可用于包封率及载药量的测定。
将Res-SLN混悬液置于超滤离心管中,12 000 r/min离心50 min,取滤液,稀释后进行HPLC测定游离Res的量,计算包封率及载药量。
包封率=(投药量-游离药物量)/投药量
载药量=(投药量-游离药物量)/(脂质用量+投药量-游离药物量)
取Res-SLN混悬液适当稀释后加入到比色皿中,用Malvern Zetasizer动态激光散射仪测定其粒径。测定结果显示,Res-SLN包封率为(91.18±2.00)%,Res-SLN载药量为(22.65±1.48)%,Res-SLN粒径为(166.26±8.46)nm(图 2)。
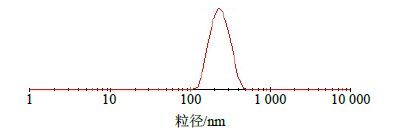
|
图 2 Res-SLN粒径测定结果 Fig. 2 Particle size of Res-SLN |
取骨架片,依照《中国药典》2010年版二部附录XC第一法,以pH 7.2磷酸盐缓冲液900 mL为释放介质,转速100 r/min,温度(37.0±0.5)℃,分别于0、1、2、4、6、8、10、12 h取5 mL,并同时补同温度、同体积的释放介质,样品溶液经0.45 μm微孔滤膜滤过后,取续滤液,计算凝胶骨架片在不同时间的累积释放率。
2.5 缓释固体脂质纳米粒凝胶骨架片的制备量取Res-SLN混悬液8.4 mL(含药量为4.77 mg/mL),加入吸附剂350 mg(乳糖、蔗糖或甘露醇),冷冻干燥。加入HPMC(K4M、K15M、K100M)、PEG(PEG 400、PEG 4000、PEG 10000)等辅料混匀。加入30%乙醇适量,制软材,过18目筛制粒,55 ℃条件下干燥6 h,加入片质量1%的硬脂酸镁作为润滑剂,混合后压片,即得。片质量约为0.5 g。
2.6 单因素考察 2.6.1 吸附剂种类对体外释药行为的影响保持Res-SLN用量不变,设定吸附剂350 mg,HPMC K15M 50 mg,PEG 4000 20 mg,考察不同吸附剂(乳糖、蔗糖及甘露醇)对凝胶骨架片释药行为的影响,结果见图 3。可以看出,用蔗糖和乳糖作为Res-SLN的吸附剂时,释药曲线相近,但释药速率较慢;而用甘露醇作为Res-SLN的吸附剂时,药物释放速率较快。但是从压片的外观来看,乳糖优于甘露醇和蔗糖。
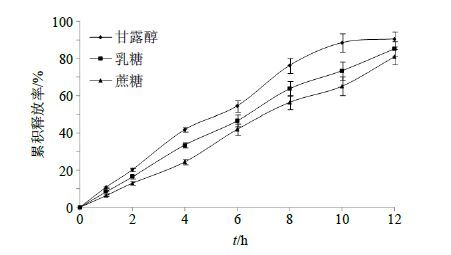
|
图 3 不同吸附剂对体外释药行为的影响 (n = 3) Fig. 3 Effects of different adsorbents on in vitro release (n = 3) |
保持Res- SLN用量不变,设定乳糖350 mg,HPMC K15M 50 mg,PEG 20 mg,考察不同PEG种类(PEG 400、PEG 4000、PEG 10000)对体外释药行为的影响,结果见图 4。可知,释药速率依次为PEG 400>PEG 4000>PEG 10000,其中,PEG 4000释药行为较为理想。
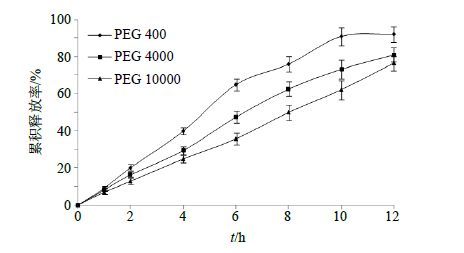
|
图 4 不同PEG种类对体外释药行为的影响 (n = 3) Fig. 4 Effects of PEG categories on in vitro release (n = 3) |
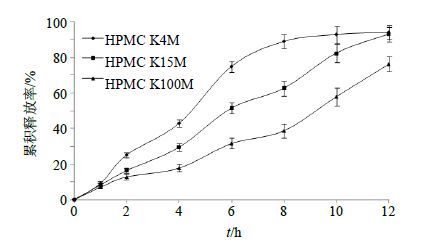
保持Res-SLN用量不变,设定乳糖350 mg,HPMC 50 mg,PEG 4000 20 mg,考察不同HPMC类型(K4M、K15M、K100M)对体外释药行为的影响,结果见图 5。可以看出,随着HPMC相对分子质量的增加,释药速率逐渐下降。HPMC 15M对控制药物释放效果较好,故选用HPMC 15M作为骨架材料。
|
图 5 不同缓释材料对体外释药行为的影响 (n = 3) Fig. 5 Effects of different excipients on in vitro release (n = 3) |
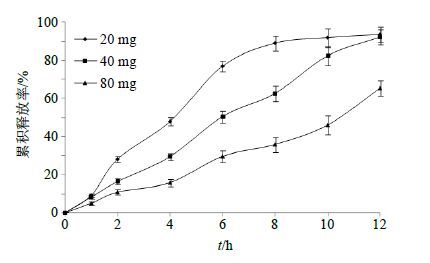
15M用量对体外释药行为的影响 保持Res-SLN用量不变,设定乳糖350 mg,PEG 4000 20 mg,考察不同HPMC 15M用量对体外释药行为的影响,结果见图 6。由结果可以看出,随着HPMC 15M用量的增加,释药速率呈下降趋势。当HPMCK 15M用量为40 mg/片时,释药速率适中,且12 h后的累积释放率也相对较高。
|
图 6 不同HPMC K15M用量对体外释药行为的影响 (n = 3) Fig. 6 Effects of different amounts of HPMC K15M on in vitro release (n = 3) |
在单因素考察的基础上,进一步选择填充剂种类(A)、PEG种类(B)和HPMC K15用量(C)3个因素,采用L9(33) 正交表进行试验,进一步优化处方。正交设计见表 1。
|
|
表 1 L9(33) 正交试验设计与结果 Table 1 Design and results of L9(33) orthogonal test |
参考《中国药典》2015年版四部附录XIXD缓控释制剂指导原则的规定,采用综合评分法,对2、6、12 h累积药物释放率进行评分,考察凝胶骨架片在2 h的释放率(L1)有无时滞现象、6 h的累积释放率(L2)以及12 h(L3)是否释放完全(权重系数为2),以L值最低者为最优。将评分结果进行加权相加后得出综合得分,并采用方差分析方法,对结果进行分析(表 2),最终得出最佳处方。计算公式为L=|L1-0.2|×100×1+|L2-0.5|×100×1+|L3-0.95|×100×2。评价总分L越小,说明药物释放特征与所制定标准越接近。
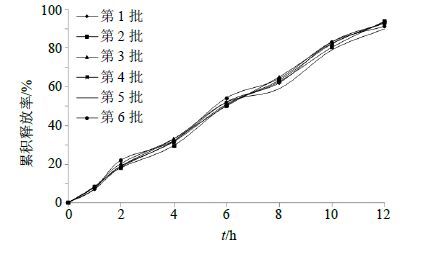
通过正交表格的设计进行实验并作方差分析,结果见表 1和2。由极差(R)分析可知,各因素对药物释放影响的大小顺序为A>B>C;方差分析结果表明,填充剂种类(A)和PEG种类(B)对释药有显著性影响(P<0.01、0.05)。实验确定各因素最佳水平组合为A2B2C2。量取Res-SLN混悬液8.4 mL(含药量为4.77 mg/mL),加入乳糖350 mg/片,冷冻干燥。加入HPMC K15M 40 mg/片、PEG 4000 20 mg/片等辅料混匀。加入30%乙醇适量,制软材,过18目筛制粒,55 ℃条件下干燥6 h,加入片质量1%的硬脂酸镁作为润滑剂,混合后压片,即得。按照得出的最佳处方制备Res-SLN骨架片6批,测定体外释放率,结果见图 7。取各时间点的平均值对骨架片体外释药情况进行综合评价。结果显示,6批骨架片评价结果为L=2.1+3.2+6.2=11.5。
|
|
表 2 方差分析 Table 2 Variance analysis |
|
图 7 6批凝胶骨架缓释片释药曲线 (n = 6) Fig. 7 Drug release profiles for six batches of hydrogel matrix sustained-release tablets (n = 6) |
为进一步研究Res-SLN缓释凝胶骨架片的释药行为,将按照最佳处方工艺制备的缓释骨架片体外释放结果分别采用零级方程(Mt/M∞=kt+c)、一级方程[ln(1-Mt/M∞)=−kt+c]、Higuchi方程(Mt/M∞=kt1/2+c)3种模型对Res-SLN缓释骨架片体外释放数据进行拟合,并用相关系数(r)判断其拟合方程,以r值最大者为最优;采用Ritger-Peppas方程探讨其释药机制,结果见表 3。可见所制备的Res- SLN凝胶骨架片按零级释药模型释放,r=0.998 0。
|
|
表 3 药物释放模型和r Table 3 Fitting release model and coefficients of association |
药物从骨架片中的释放机制可通过Ritger- Peppas经验式来描述。对于圆柱形制剂,当n<0.45时,为Fick扩散;当0.45<n<0.89时,药物释放扩散与溶蚀协同作用;当n>0.89时,为溶蚀作用[11]。Res-SLN凝胶骨架片的Ritger-Peppas体外释放模型拟合参数n=0.984 0>0.89,提示该凝胶骨架缓释片释药以溶蚀为主。
3 讨论研究制备难溶性药物纳米制剂是解决难溶性药物吸收差、口服吸收生物利用度低的有效手段。但纳米级Res达峰时间短,血药浓度波动较大,容易产生一系列副作用[5]。将纳米技术与缓释技术联合使用不仅克服了纳米级Res血药浓度波动较大的缺点,也有利于提高药物的体内外相关性。
HPMC作为缓释材料,遇水后具有较大黏度,随着相对分子质量的增加,纳米粒扩散阻力越大,经试验考察最终选用HPMC K15作为缓释材料。采用乳糖作为Res-SLN的吸附剂时,其释药速率稍慢。在骨架片中加入一定量的PEG,利用其致孔作用,遇水后可以形成释药通道,有利于提高释药速率[11, 12, 13]。另外,PEG的加入也有助于压片的成型性[14]。优化后的Res-SLN缓释凝胶骨架片,药物释放遵循Ritger-Peppas体外释放模型,其中n=0.984 0>0.89,提示该缓释凝胶骨架片释药以溶蚀机制为主。溶出杯底部未见药物沉淀,推测药物是以纳米粒状态悬浮于溶出介质中。
本研究所研制的Res-SLN缓释凝胶骨架片,利用凝胶骨架片遇水后形成的凝胶层,有效地控制了纳米粒的缓慢释放,可以明显改善Res-SLN血药浓度波动较大的缺点,同时也可以提高Res体内外相关性,为难溶性药物缓释制剂的研究提供了有价值的参考[14, 15, 16]。
| [1] | Filip V, Plockova M, Smidrkal J, et al. Resveratrol and its antioxidant and antimicrobial effectiveness [J]. Food Chem, 2003, 83(4): 585-593. |
| [2] | 张秀娟, 包钰涵, 贾绍华, 等. 白藜芦醇对人胃癌SGC-7901细胞形态、线粒体膜电位、活性氧及钙离子浓度的影响 [J]. 药物评价研究, 2012, 35(3): 161-164. |
| [3] | 程 霜, 郭长江. 白藜芦醇抗肿瘤作用机制研究进展 [J]. 疾病控制杂志, 2005, 9(3): 257-260. |
| [4] | 高 欣, 谢文利, 朱 江, 等. 纳米级白藜芦醇和白藜芦醇β-环糊精包合物生物利用度的比较研究 [J]. 中草药, 2011, 42(5): 966-968. |
| [5] | 孟祥平, 周 群, 王治平, 等. 口服葛根总黄酮固体脂质纳米粒冻干粉的制备及其4种成分释放度考察 [J]. 中草药, 2014, 45(17): 2467-2474. |
| [6] | 严春临, 张 季, 刘 敏, 等. 星点设计-效应面法优化吴茱萸次碱固体脂质纳米粒处方 [J]. 中草药, 2015, 46(9): 1307-1313. |
| [7] | 王新春. 白藜芦醇三个不同载体材料纳米口服给药系统的研究 [D]. 成都: 四川大学, 2007. |
| [8] | 张强华, 熊清平, 石莹莹, 等. 白藜芦醇固体脂质纳米粒的制备表征与体外抗肿瘤作用研究 [J]. 中药材, 2010, 33(12): 1929-1932. |
| [9] | 朱可馨, 王志成, 王 冰, 等. 白藜芦醇固体脂质纳米粒的处方和制备工艺优化 [J]. 中成药, 2015, 37(2): 409-413. |
| [10] | 吴先闯, 郝海军, 宋晓勇, 等. 槲皮素包合物微孔渗透泵片制备工艺 [J]. 中成药, 2015, 37(6): 1205-1209. |
| [11] | 邓向涛, 郝海军, 韩 茹, 等. 黄芩素包合物单层渗透泵片制备工艺研究 [J]. 第二军医大学学报, 2015, 36(5): 513-517. |
| [12] | Hao H J, Jia Y Z, Zhang H Q, et al. Preparation of monolithic osmotic tablet of quercetin loaded by solid dispersions [J]. J Chin Pharm Sci, 2015, 24(6): 383-392. |
| [13] | 索绪斌, 张 涵, 王文青, 等. 丹参酮ⅡA固体脂质纳米粒缓释凝胶骨架片的制备 [J]. 中国新药杂志, 2015, 24(5): 576-580. |
| [14] | Khatun S, Sutradhar K B. Water hyacinth: a possible alternative rate retarding natural polymer used in sustained release tablet design [J]. Front Pharmacol, 2014, 137(5): 1-8. |
| [15] | 郝海军, 贾幼智, 韩 茹, 等. 坎地沙坦酯固体分散体单层渗透泵片的制备 [J]. 中国新药杂志, 2015, 24(5): 570-575. |
 2016, Vol. 47
2016, Vol. 47


