桑菊饮为吴鞠通所创,首载于《温病条辨》,由桑叶、菊花、杏仁、连翘、薄荷、苦桔梗、生甘草、芦根8味中药组成,具有辛凉解表、疏风清热、宣肺止咳之功效。传统用于风温初起所致的咳嗽、口微渴、身热不甚、脉浮数等表热轻证[1],西医学急性上呼吸道感染、急性支气管炎等疾病均属本方应用范畴[2]。本方在现代临床呼吸系统等疾病中应用广泛,诸多方剂均由本方加减而成。现代药理研究表明,桑菊饮对免疫系统有较好的调节作用,具有抗炎、止咳、祛痰、平喘、抑菌等诸多药理活性[3]。
炎症在急性上呼吸道感染、急性支气管炎中起着关键性的作用。发病过程中炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素- 6(IL-6)及白细胞介素-8(IL-8)均在患者体内显著性升高[4, 5]。核因子-κB(NF-κB)作为多种炎症介质表达所必需的转录调节因子,在调节免疫、炎症反应具有非常关键的作用[6, 7, 8]。NF-κB转录因子调节着大量基因的表达,例如TNF-α、IL-1、IL-6和IL-8等细胞因子的表达均受其调节[9]。
根据文献记载,桑菊饮中8味中药均具有较好的抗炎活性。Han等[10]通过建立小鼠肺部急性感染模型,表明菊花给药后能显著降低TNF-α、IL-6和IL-8等炎症因子的表达。目前临床报道芦根可以用来治疗感冒、急慢性支气管炎等呼吸系统疾病。毛伟松[11]采用芦根贝母汤加减治疗急性支气管炎,取得较好的治疗效果;陈福君等[12]通过巴豆油所致小鼠耳廓肿胀实验,表明桑叶具有较强的抗炎作用;周幼龙[13]采用薄荷大黄汤治疗急性扁桃体炎有较好的疗效;杏仁具有驱风的功效,传统上用于治疗胃炎、皮炎等疾病[14];甘草中的成分甘草酸,桔梗中的成分桔梗皂苷D[15],连翘中的连翘酯苷A[16]可以通过抑制NF-κB的表达调控炎症因子的分泌。诸药合用组成的桑菊饮也具有较好的抗炎活性[3],但其作为复方联合应用的抗炎物质基础研究未见报道。如能明确其物质基础,对于科学阐释中药配伍理论,进一步探讨中医治法均有重要意义。
为了快速准确地筛选出桑菊饮中抗炎活性成分,本实验使用超高效液相色谱-四级杆/飞行时间质谱(UPLC-Q/TOF)结合荧光素酶报告基因检测系统筛选抑制NF-κB活性成分的方法,从抗炎角度明确桑菊饮药效物质基础,筛选出16种具有NF-κB抑制活性的成分,其中胡萝卜酸、22β-乙酰基-甘草酸、甘草皂苷G2抑制NF-κB活性为首次报道。
1 材料 1.1 试药桑叶、菊花、杏仁、连翘、薄荷、桔梗、甘草、芦根购自河北安国中药材批发市场,经天津药物研究院张铁军研究员鉴定为桑Morus alba L. 的干燥叶、菊花Chrysanthemum morifolium Ramat. 的干燥头状花序、杏仁Prunus armeniaca L. 的干燥成熟种子、连翘Forsythia suspensa (Thunb.) Vahl的干燥果实、薄荷Mentha haplocalyx Brip的干燥地上部分、桔梗Platycodon grandiflorum (Jacq.) A. DC. 的干燥根、甘草Glycyrrhiza uralensis Fisch. 的干燥根、芦苇Phragmites communis Trin. 的干燥根茎。
桑菊饮提取物的制备:根据《温病条辨》记载,将桑叶(7.5 g)、菊花(3 g)、杏仁(6 g)、连翘(5 g)、薄荷(2.5 g)、桔梗(6 g)、甘草(2.5 g)、芦根(6 g),加水2 L,煮取1.3 L,真空泵滤过,浓缩,旋蒸得浸膏,称得浸膏质量为8.372 7 g,至于4 ℃冰箱中保存。
1.2 主要试剂胰蛋白酶(Gibco,美国);TNF-a(Peprotech,美国);地塞米松(Dex,Sigma,美国);PGL4.32质粒和内参质粒Prl-TK(Promega,美国);细胞裂解液(Promega,美国);双荧光酶报告基因试剂盒(Promega,美国);脂质体2000转染试剂(PEI,Invitrogen,美国);酶联免疫ELISA试剂盒(上海西唐生物科技公司)。
色谱纯甲醇、乙腈(Fisher,美国);色谱纯甲酸(Acros,比利时);亮氨酸-脑啡肽醋酸盐(Sigma- Aldrich,美国);超纯水由Milli-Q制备(Millipore Laboratory,Bedford,美国)。
对照品咖啡酸(批号ABO97C,质量分数99.5%)、绿原酸(批号AZ001C,质量分数98.46%)、甘草酸(批号AB291G,质量分数98%)、马钱子苷(批号200604,质量分数98%)购于天津一方科技公司,胡萝卜酸(批号M813040,质量分数99.5%)购于上海麦恪林公司(中国)。
1.3 实验细胞人胚肾上皮细胞293(HEK 293)、人支气管上皮细胞(BEAS-2B)购于美国Type Culture Collection,Rockville,MD公司。HEK 293培养于DMEM高糖培养基(HyClone,美国),包含10%牛血清白蛋白(FBS,Gibco,美国)和1%双抗(100 U/mL青霉素和0.1 mg/mL链霉素 ,Gibco,美国);BEAS-2B培养于10% FBS和1%双抗的RPMI 1640完全培养基,均在5% CO2、37 ℃培养箱中培养。
1.4 主要仪器Waters Acquity UPLC-Q/TOF Premier:配置自动进样器、柱温箱、PDA检测器、Masslynx 4.1工作站(Waters,美国);色谱柱:Waters Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm);Velocity 14R高速冷冻离心机(Dynamic,澳大利亚);Milli-Q超纯水仪(MILLIPORE,美国);DZF-6020真空干燥箱(河南予化仪器有限公司);HF151UV CO2细胞培养箱(上海Heal Force公司);XD-101倒置显微镜(南京东海光电子股份有限公司);酶标仪(美国Bio-Rad公司);AB104-N电子天平(Mettler Toledo公司);BIOELLEA Reader ELX800(Bio-Tek,美国);Modulus荧光检测仪(美国Turner Designs公司);超净工作台(苏州净化设备有限公司)。
2 方法 2.1 桑菊饮抗炎活性评价 2.1.1 双荧光素酶报告基因质粒瞬时共转染HEK293细胞HEK293细胞于96孔板中培养,待细胞汇合度在50%~70%时与NF-κB荧光素酶报告PGL4.32(100 ng/孔)及内参质粒Renilla(9.6 ng/孔)共转染,转染时使用脂质体2000作为辅助转染试剂。将适当比例的质粒和转染试剂置于无FBS的培养基中,混匀后静置15 min,以确保质粒与转染试剂充分结合。最后将转染液加入预培养的细胞96孔板中,于CO2培养箱中共孵育24 h以上。
2.1.2 细胞实验分组及给药细胞实验分为6组,分别为空白组,模型组,阳性药地塞米松组,桑菊饮高、中、低剂量(1、0.1、0.01 mg/mL)组。细胞各组预给药6 h,阳性药组给予1×10−5 mol/L的地塞米松;空白组、模型组给予新鲜培养基,加入TNF-α(终质量浓度为10 ng/mL)造模6 h,收集的裂解液用于NF-κB荧光检验。
2.1.3 NF-κB双荧光素酶报告基因活性检测给药完成后,弃去细胞培养液,用PBS(100 μL/孔)洗涤细胞2次,弃去PBS液,加入配制好的细胞裂解液(20 μL/孔),室温振荡30 min后,每孔吸出15 μL细胞裂解液用于NF-κB双荧光素酶报告基因活性检测。
向15 μL细胞裂解液中加入20 μL NF-κB荧光素酶报告基因质粒pGL4.32(100 ng/孔)检测试剂,轻轻混匀后,检测NF-κB荧光值(Modulus荧光检测仪),再加入20 μL内参荧光素酶检测试剂,轻轻混匀后,检测Renilla荧光值。按公式计算NF-κB荧光素酶活性,以相对荧光比率表示NF-κB抑制率。
相对荧光比率=NF-κB荧光值/Renilla荧光值
2.2 桑菊饮抗炎活性成分的筛选 2.2.1 UPLC色谱条件色谱柱:Waters Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm);柱温30 ℃;体积流量0.4 mL/min;PDA检测190~400 nm扫描;进样量2.0 μL;流动相:乙腈(A)-0.1%甲酸水溶液(B);二元梯度洗脱条件:0~2 min,2% A;2~20 min,2%~20% A;20~40 min,20%~40% A;40~44 min,40%~85% A;44~45 min,85%~2% A。
2.2.2 Q-TOF质谱条件使用正、负离子2种模式扫描测定,仪器参数如下:电喷雾离子源(ESI);V模式;毛细管电压3.0 kV(正模式),2.5 kV(负模式);锥孔电压30 V;离子源温度100 ℃;脱溶剂气温度350 ℃;脱溶剂氮气流量600 L/h;锥孔气流量50 L/h;检测器电压1 900 V;采样频率0.1 s;间隔0.02 s;质量数扫描范围100~1 500;内参校正液Lockmass采用亮氨酸脑啡肽盐LEA([M+H]+= 555.293 1;[M-H]−=553.277 5)。数据采集工作站为Masslynx 4.1。
2.2.3 UPLC分段样品的制备精密称取桑菊饮浸膏10 mg,加入1 mL纯净水,配制成10 mg/mL水溶液于1.5 mL EP管中,12 000 r/min离心15 min后取上清液,用于UPLC的馏份收集实验。样品经UPLC分离后,将流出液按每1分钟一段收集于96深孔板(规格:2.2 mL/孔)中,50 ℃真空干燥,挥去溶剂,再向每孔加入100 μL细胞培养基复溶,放于振荡器中振荡20 min,待物质完全溶解后,加入到预先转染好的细胞中分析每段馏份对NF-κB表达的影响。
2.2.4 抗炎活性物质结构鉴定方法通过分析Q-TOF提供的一级、二级质谱信息并结合文献的方法鉴定具有抗炎活性的化合物。经正、负模式下的一级质谱分析,得到化合物的准分子离子峰信息。通过精确质量数推断化合物的相对分子质量和元素组成。通过二级碎片信息,推断化合物的裂解规律,通过查阅大量文献以及数据库搜索,如chemspider,将裂解信息与文献或数据库中数据库进行比对,再参考化合物的紫外吸收和相对保留时间等信息,确定相关活性化合物的结构信息。
2.2.5 数据标准化处理方法采用SPSS13.0软件进行数据统计,实验结果以x表示,组间比较采用单因素方差分析(One-way ANOVA)。
2.3 单体验证 2.3.1 双荧光素酶报告系统验证NF-κB抑制活性将咖啡酸、绿原酸、甘草酸、马钱子苷对照品用HEK293细胞培基稀释成1×10−4、1×10−5、1×10−6 mol/L进行细胞验证。操作方法同“2.1”项。
2.3.2 BEAS-2B细胞炎症因子IL-6和IL-8水平测定将BEAS-2B细胞培养于96孔板中24 h,完全贴壁后,细胞各组(将咖啡酸、绿原酸、甘草酸、马钱子苷和胡萝卜酸对照品用细胞培基稀释成1×10−4、1×10−5、1×10−6 mol/L进行细胞验证)预给药6 h后,用TNF-α(终质量浓度为10 ng/mL)刺激6 h后收集上清,测定IL-6、IL-8水平。
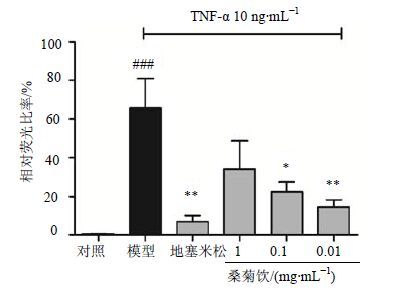
3 结果 3.1 桑菊饮在细胞水平的抗炎活性评价由图 1可见,TNF-α刺激后,模型组NF-κB的表达与对照组比较显著升高(P<0.001),而与模型组相比,阳性药组NF-κB的表达明显降低(P<0.01)。桑菊饮各剂量组均可降低NF-κB表达,且具有剂量依赖性。
|
与对照组比较:###P<0.001;与模型组比较:P<0.05 **P<0.01 ###P< 0.001 vs control group; P < 0.05 **P < 0.01 vs model group 图 1 桑菊饮对NF-κB的抑制作用 (x±s,n = 3) Fig. 1 Inhibition of Sang Ju Yin on NF-κB levels (x±s,n = 3) |
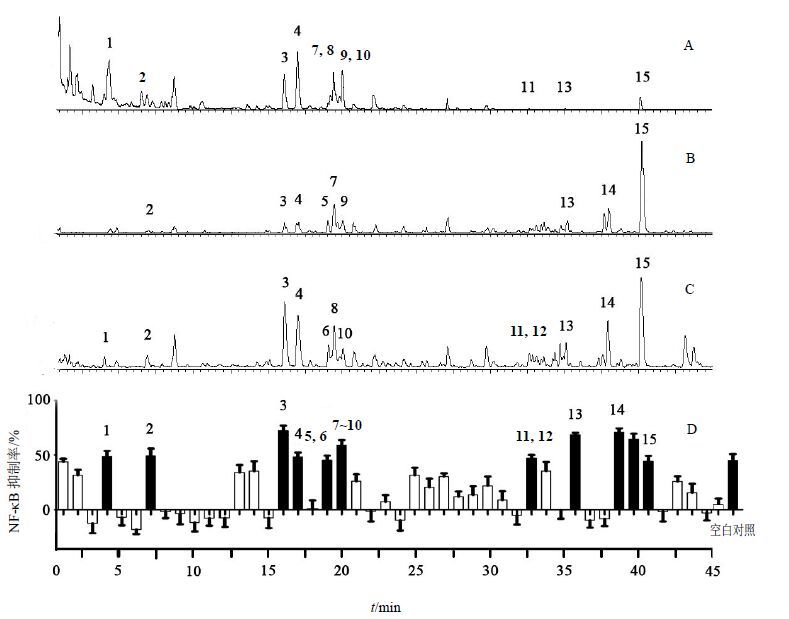
本实验通过UPLC/Q-TOF-MS的方法得到了桑菊饮的离子流图,紫外图及正、负离子流图分别见图 2-A~C。对桑菊饮45段馏份进行细胞活性筛选分析,发现其中16种样品(其中9号峰由2个化合物组成)具有抑制NF-κB活性(图 2-D)。
|
A-紫外图 B-负离子模式离子流图 C-正离子模式离子流图 D-NF-κB抑制率活性图,黑色柱为有效馏份,上面的数字所对应的化合物的信息见表 1 A-UV chromatogram B-BPI chromatogram in negative mode C-BPI chromatogram in positive mode D-bioactivity chromatogram of inhibitory rate on NF-κB,Black columns represent active ingredients,the peak numbers are consistent with those in Table 1 图 2 UPLC-Q/TOF结合荧光素酶报告基因检测系统筛选桑菊饮中抑制NF-κB活性的单体成分 (x±s,n = 5) Fig. 2 Screening on inhibitory activity of NF-κB in Sang Ju Yin using UPLC-Q/TOF coupled with luciferase reporter assay system (x±s,n = 5) |
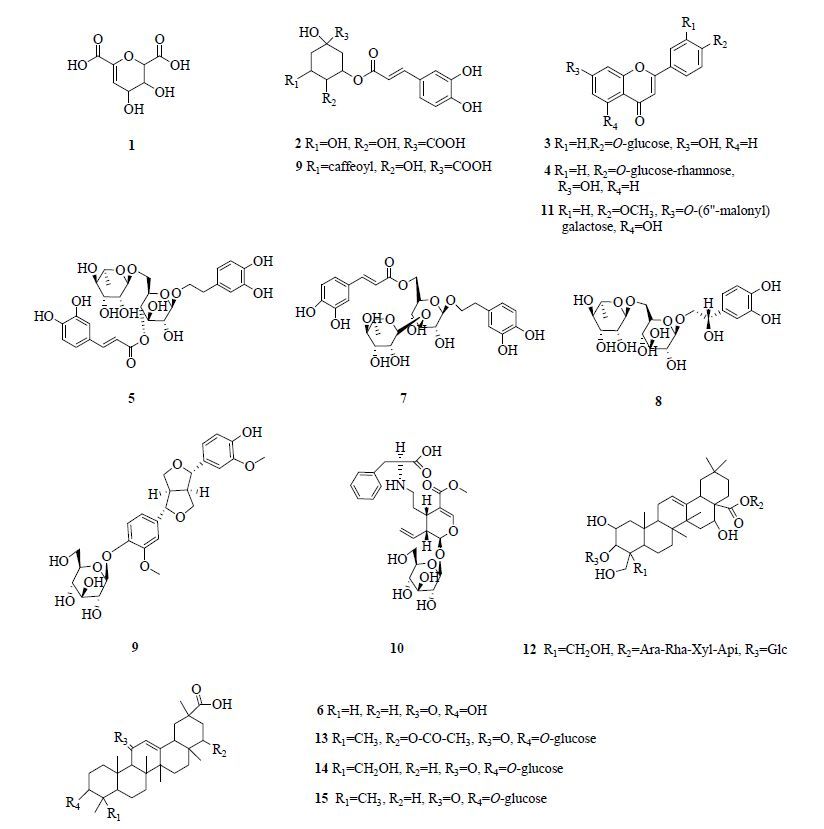
按照“2.2.4”项方法对细胞实验筛选出的16种样品中包含的对NF-κB具有显著抑制活性成分进行结构鉴定。鉴定结果见表 1,结构见图 3。经质谱信息分析,文献检索及相关书籍《中药原植物化学成分集》等的查阅,得到这16种化合物,6个来源于甘草,4个来源于连翘,5个来源于菊花,1个来源于桔梗。
|
|
表 1 桑菊饮样品中抗炎活性成分结构信息 Table 1 Information of bioactive compounds with anti-inflammation in SangJu Yin |
|
图 3 桑菊饮中活性单体的化学结构 Fig. 3 Chemical structures of active monomers in Sang Ju Yin |
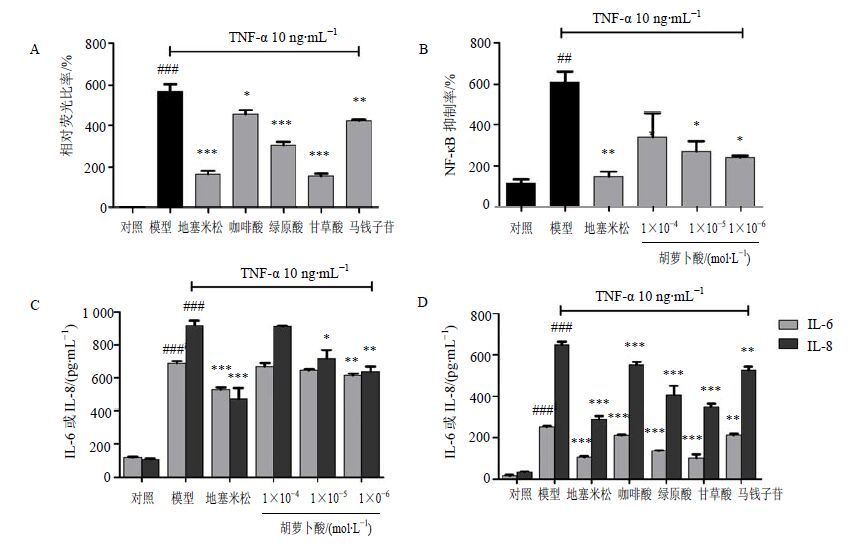
选取咖啡酸、绿原酸、甘草酸、马钱子苷、胡萝卜酸按“2.3.1”项方法进行细胞验证。咖啡酸、绿原酸、甘草酸、马钱子苷等成分在浓度1×10−5 mol/L时抗炎活性较好已有报道[17],实验设计中把1×10−5 mol/L作为阳性验证的浓度,来说明双荧光素酶报告系统可以成功地进行植物提取液NF-κB的筛选。并且由于活性成分22β-乙酰基-甘草酸、甘草皂苷G2、胡萝卜酸为首次报道,故在实验中做了胡萝卜酸的梯度验证,发现胡萝卜酸(1×10−5 mol/L)能够抑制NF-κB的表达。由图 4可见,5个化合物咖啡酸、绿原酸、甘草酸、马钱子苷、胡萝卜酸也可以降低细胞炎症因子IL-6和IL-8的表达水平(P<0.05、0.01、0.001)。
|
与对照组比较:###P<0.001;与模型组比较:P<0.05 **P<0.01 ***P<0.001 ###P < 0.001 vs control group; P < 0.05 **P < 0.01 ***P < 0.001 vs model group 图 4 桑菊饮整方及活性成分单体验证 (A和B:双荧光素酶报告系统验证活性单体NF-κB的抑制量;C和D:活性单体及桑菊饮整方降低细胞炎症因子IL-6和IL-8的表达量,x±s,n = 3) Fig. 4 Confirmation of bioactive compounds from holistic Sang Ju Yin and active monomers(A and B: inhibition of NF-κB verified by luciferase reporter assay; C and D: IL-6 and IL-8 expression in TNF-α reduced by holistic Sang Ju Yin,x±s,n = 3) |
因为具有低毒、高效的特点,传统中药越来越受到人们的重视,而复方制剂因为多种成分的配伍使用,常常发挥比单味饮片更佳的治疗效果,如文献中记载复方黄连解毒汤,其主要成分包括黄酮和生物碱等,这些主、次成分彼此协同,从而达到比较好的抗炎效果[18]。但同时中药具有成分复杂,质量可控性差等缺点。简单选取几种药效成分并不能对中药进行有效质量控制。如《中国药典》在菊花的质量控制中,只选取绿原酸,木犀草苷和异绿原酸A为指标成分,但这并不能满足菊花药材质量控制需求[10]。另一方面阐明桑菊饮的抗炎物质基础,不但能为其建立可靠质量标准提供依据,还有助于下一步了解桑菊饮的抗炎机制,明确药物作用的靶点,而为后续精简复方,去除有害成分,找到具有较少的副作用,更好疗效的抗炎药物做准备。
本实验采用UPLC/Q-TOF结合NF-κB双荧光素酶报告基因系统,筛选出桑菊饮中15段共16种活性成分。其中5个活性成分来源于菊花,6个来源于甘草,4个来源于连翘,1个来源于桔梗。绿原酸、甘草酸、桔梗皂苷D、咖啡酸、马钱子苷、连翘脂苷A、甘草苷等成分抗炎活性已有报道[19, 20, 21],胡萝卜酸、22β-乙酰基-甘草酸、甘草皂苷G2等调控NF-κB活性为首次报道。
上皮细胞是气道与外界的屏障,是细菌感染的直接接触部位,更是炎症反应和药物作用的主要位点,在细胞因子及各种免疫调节介质的产生过程中起着十分重要的作用。在本研究中,首先选用人支气管上皮细胞建立炎症模型,在体外细胞水平上评价筛选出的5个单体,即咖啡酸、绿原酸、甘草酸、马钱子苷和胡萝卜酸,实验结果显示这5个化合物都能够明显抑制NF-κB的表达,也可以降低细胞炎症因子IL-6和IL-8的表达水平,与筛选结果相一致。
通过本实验筛选出桑菊饮中比较好的抗炎活性成分,初步明确了其抗炎物质基础,为进一步阐明其抗炎作用机制提供了条件,也为以后建立其质量标准提供依据。但由于桑菊饮中化学成分复杂,本实验筛选出的一些比较好的活性峰并不是单一成分,如图 2-D中第5个活性柱,经鉴定有效成分有5、6;第6个活性柱,有效成分有7、8、9、10;第7个活性柱,有效成分有11、12。并且对于复方中的主、次成分是否存在协同抗炎及这些成分与桑菊饮其他药理活性,比如抗菌、解热、发汗、抑制肠蠕动亢进和增强免疫是否存在联系也需要进一步的研究[3]。
| [1] | 苏 扬. 桑菊饮加减治疗支气管炎临床效果评价 [J]. 亚太传统医药, 2015, 11(11): 138-139. |
| [2] | 曲敬来, 高 雪, 韩 钺, 等. 止嗽散加减治疗甲型季节性流感病毒性支气管炎的临床研究 86 例 [J]. 中国中医药现代远程教育, 2010, 8(17): 191-193. |
| [3] | 张保国, 梁晓夏, 刘庆芳, 等. 桑菊饮药效学研究及其现代临床应用 [J]. 中成药, 2007, 29(12): 1813-1816. |
| [4] | Guabiraba R, Besnard A G, Marques R E, et al. IL-22 modulates IL-17A production and controls inflammation and tissue damage in experimental dengue infection [J]. Eur J Immunol, 2013, 43(6): 1529-1544. |
| [5] | Zarpelon A C, Cunha T M, Aives J C, et al. IL-33/ST2 signalling contributes to carrageenin induced innate inflammation and inflammatory panic: role of cytokines, endothelin-1 and prostaglandin E-2 [J]. Br J Pharmacol, 2013, 169(1): 90-101. |
| [6] | Karin M, Chen L W, Greten F, et al. Signaling inflammation through IKK and the NF-kappa B transcription factors [J]. Shock, 2004, 21(3): 112-121. |
| [7] | Kang S C, Lim S Y, Song Y J. Lupeol is one of active components in the extract of Chrysanthemum indicum Linn. that inhibits LMP1-induced NF-κB activation [J]. PLoS One, 2013, 8(11): 826-888. |
| [8] | Liu X H, Bauman W A, Cardozo C. ANKRD1 modulates inflammatory responses in C2C12 myoblasts through feedback inhibition of NF-κB signaling activity [J]. Biochem Biophys Res Commun, 2015, 464(1): 208-213. |
| [9] | Zhou M G, Jiang M, Bai G, et al. Identification and comparison of anti-inflammatory ingredients from different organs of lotus nelumbo by UPLC/Q-TOF and PCA coupled with a NF-κB reporter gene assay [J]. PLoS One, 2013, 8(11): e81971. |
| [10] | Han Y Q, Zhou M G, Wang L Q, et al. Comparative evaluation of different cultivars of Flos Chrysanthemi by an anti-inflammatory-based NF-κB reporter gene assay coupled to UPLC-Q/TOF MS with PCA and ANN [J]. J Ethnopharmacology, 2015, 174: 387-395. |
| [11] | 毛伟松. 芦根贝母汤治疗小儿急性支气管炎 [J]. 现代中西医结合杂志, 2014, 13(11): 1442.. |
| [12] | 陈福君, 林一星, 许春泉, 等. 桑的药理研究(Ⅱ)——桑叶、桑枝、桑白皮抗炎药理作用的初步比较研究 [J]. 沈阳药科大学学报, 1995, 12(3): 222-224. |
| [13] | 周幼龙. 大黄薄荷汤治疗急性扁桃体炎 69 例[J]. 浙江中医杂志, 2002, 37(8): 340. |
| [14] | 王富花, 张占军. 杏仁研究进展 [J]. 安徽农业科学, 2010, 38(29): 16239-16240. |
| [15] | 赵秀玲. 桔梗的化学成分、药理作用及资源开发的研究进展 [J]. 中国调味品, 2012(2): 5-8. |
| [16] | Jiang W L, Fu F H, Xu B M, et al. Cardioprotection with forsythoside B in rat myocardial ischemia-reperfusion injury: relation to inflammation response [J]. Phytomedicine, 2010, 17(8/9): 635-639. |
| [17] | Cui Q X, Fu M, Zhou M G, et al. Bioactivity-based ultra-performance liquid chromatography-coupled quadrupole time-of-flight mass spectrometry for NF-κB inhibitors identification in Chinese medicinal preparation Bufei Granule [J]. Biomedical Chromatography, 2015, doi: 10.1002/bmc.3664. |
| [18] | Wang Q, Kuang H X, Su Y, et al. Naturally derived anti-inflammatory compounds from Chinese medicinal plants [J]. J Ethnopharmacol, 2013, 146(1): 9-39. |
| [19] | Cheng B F, Hou Y Y, Wang L Q. Dual-bioactivity based liquid chromatography coupled quadrupole time of flight mass spectrometry for NF-κB inhibitors and β2AR agonists identification in Chinese medicinal preparation Qingfei Xiaoyan Wan [J]. Anal Bioanal Chem, 2012, 404(8): 2445-2452. |
| [20] | Jiang M, Han Y Q, Zhou M G. The screening research of anti-inflammatory bioactive markers from different flowering phases of Flos Lonicerae Japonicae [J]. PLoS One, 2014, 9(5): e96214. |
| [21] | Kim Y P, Kim S Y, Li D, et al. Inhibition of prostaglandin E2 production by platycodin D isolated from the root of Platycodon grandiflorum [J]. Planta Med, 2001, 67(4): 37-39. |
 2016, Vol. 47
2016, Vol. 47


