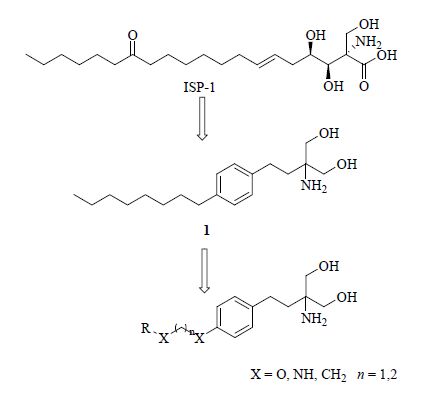
冬虫夏草Cordyceps是中国特产名贵中药,它是冬虫夏草菌Cordyceps sinensis (BerK.) Sacc. 寄生在蝙蝠蛾科昆虫幼虫上形成的子座及幼虫尸体的干燥复合体,为真菌门(Eumycota)核菌纲(Pyrenometes)麦角菌目(Claricipiyales)麦角菌科(Clavicinitaccae)虫草属Cordyceps (Fr.) Link的虫生真菌。它的主要产地是我国青海、西藏、云南、四川。自古以来便被视为名贵的强壮滋补药材,具有益精气、补虚损、止咳化痰的功效,可用于治疗肺结核、盗汗、腰酸背痛、遗精等病症,具有免疫调节、抗肿瘤、降血糖等作用[1]。20世纪80年代,日本科学家从冬虫夏草分离出多球壳菌素(ISP-1,图 1)。ISP-1具有较强的免疫抑制作用,但存在毒性大、溶解性差、成药性差的缺点。因此,藤田小组以ISP-1为先导化合物,经过进一步的结构优化,获得了成药性更好、更安全的化合物芬戈莫德(1,图 1),并于2010年被FDA批准成为首个口服的用于治疗复发-缓解型多发性硬化症 [MS(EI)] 的药物[2, 3]。作为免疫抑制剂,芬戈莫德可以在体内经过鞘氨醇激酶2(SK2)磷酸化生成 (S)-FTY720-P,后者作用于G偶联蛋白鞘氨醇磷酸酯受体S1P1,3,4,5[4],从而诱导淋巴细胞归巢或凋亡,最终起到免疫抑制作用[5]。最近研究表明,芬戈莫德在体外可以抑制各种肿瘤细胞的生长转移,比如结肠癌细胞、前列腺癌细胞、乳腺癌细胞等[6, 7, 8]。芬戈莫德的抗癌机制并不十分明确,其可能的作用机制是阻断1-磷酸鞘氨醇(S1P)信号转导通路。芬戈莫德对S1P信号转导通路的作用表现在两方面:一方面芬戈莫德对S1P受体的拮抗作用,引起S1P受体的内化从而使细胞膜表面上S1P受体水平下降[4];另一方面芬戈莫德可以抑制鞘氨醇激酶的活性[9, 10],从而抑制S1P的生成。S1P信号转导通路与细胞增殖、转移密切相关,因此芬戈莫德可通过阻断S1P信号转导通路抑制癌细胞的生长转移。
|
图 1 芬戈莫德 (1) 和多球壳菌素 (ISP-1) 结构 Fig. 1 Structures of fingolimod (1) and ISP-1 |
研究发现,当药物浓度在5~20 μmol/L时,芬戈莫德才表现出抗肿瘤作用。因此,本实验研究目的为通过结构改造的方法,以期得到抗肿瘤效果更好的芬戈莫德类似物。基于S1P受体晶体结构[11],芬戈莫德与S1P受体的结合方式:配体的氨基部分作为头,与受体口袋的一部分氨基酸残基形成氢键产生氢键作用;配体的苯环部分和烷基侧链与受体口袋的一部分氨基酸残基产生较弱的疏水键作用。因此通过改造烷基侧链部分结构,如引入适当的杂原子,可以增加药物与受体之间的氢键作用,从而提高化合物对受体的作用强度以及选择性。
以不同的取代基苯为原料,通过傅克酰基化反应、SN2取代反应、羰基还原、双亨利反应,最终经过催化氢化制得芬戈莫德类似物。本研究制得芬戈莫德(1)及其18个类似物(2~19),其中化合物2~10及12~19为未见文献报道的新化合物。根据侧链不同化合物分为3类,A类(2~8):此类化合物在烷基疏水侧链引入了酯/酰胺键以增加极性杂原子;B类(9~12):此类化合物以烷氧基或苯氧基侧链代替正辛基疏水侧链。化合物10~12具有与芬戈莫德相当的抗肿瘤活性,化合物9没有达到预期的活性效果;C类(13~19):此类化合物在烷基疏水侧链引入了酯键的同时在苄位引入了氧原子以增加侧链极性。A和C类化合物均没有达到预期的活性效果。
1 仪器与材料XT4A型显微熔点仪,天津市天光光学仪器有限公司;Bruker ACF-400型核磁共振仪,瑞士Bruker 公司;柱色谱和薄层色谱所用硅胶由青岛海洋化工有限公司生产;其他溶剂和试剂均为市售工业纯或化学纯。实验所用的肿瘤细胞全部购买于中国医学科学院基础医学研究所细胞中心。
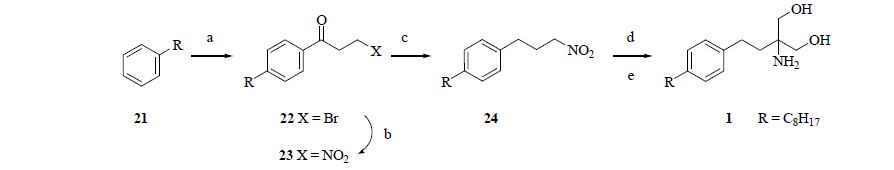
2 目标化合物合成课题组前期开发芬戈莫德合成路线[12](图 2),以正辛基苯为原料,通过傅克酰基化反应、SN2取代反应、羰基还原、双亨利反应,最终经过催化氢化制得芬戈莫德(1)。
|
a: DCM,AlCl3,3-bromopropionyl chloride,5~10 ℃,15 ℃~rt; b: DMF,NaNO2,5~10 ℃; c: DCM,triethylsilane,TiCl4/AlCl3,0~5 ℃,rt; d: (CH2O)n,1,4-dioxane,triethylamine,70 ℃; e: Pd/C,H2,55 ℃ 图 2 目标化合物的合成路线 Fig. 2 Synthesis route of target compound |
参考此合成路线,合成A、B、C 3类芬戈莫德类似物。
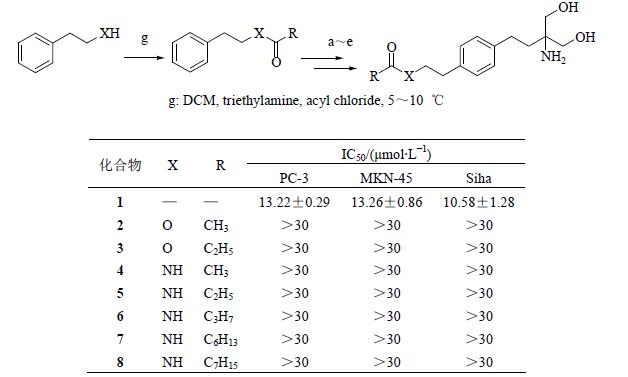
2.1 苯乙醇酯或苯乙胺酰胺类(A类)芬戈莫德类似物的合成以苯乙醇或苯乙胺为原料,通过酰化反应、傅克酰基化反应、SN2取代反应、羰基还原、双亨利反应,最后经过催化氢化制得苯乙醇酯或苯乙胺酰胺类芬戈莫德类似物2~8。合成路线见图 3。
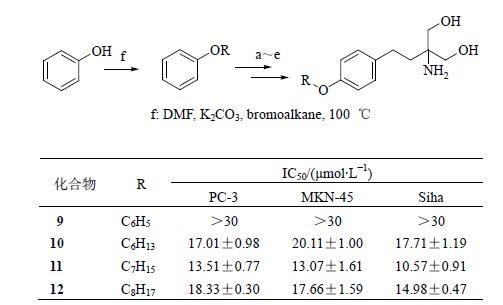
2.2 苯醚类(B类)芬戈莫德类似物的合成以苯酚为原料,通过威廉姆森成醚反应、傅克酰基化反应、SN2取代反应、羰基还原、双亨利反应,最后经过催化氢化制得苯醚类芬戈莫德类似物9~12。合成路线如图 4所示。
|
图 3 苯乙醇酯或苯乙胺酰胺类芬戈莫德类似物的合成 Fig. 3 Synthesis of fingolimod analogues of phenylethyl ether and phenylethylamine amide |
|
图 4 苯醚类芬戈莫德类似物的合成 Fig. 4 Synthesis of fingolimod analogues of phenyl ether |
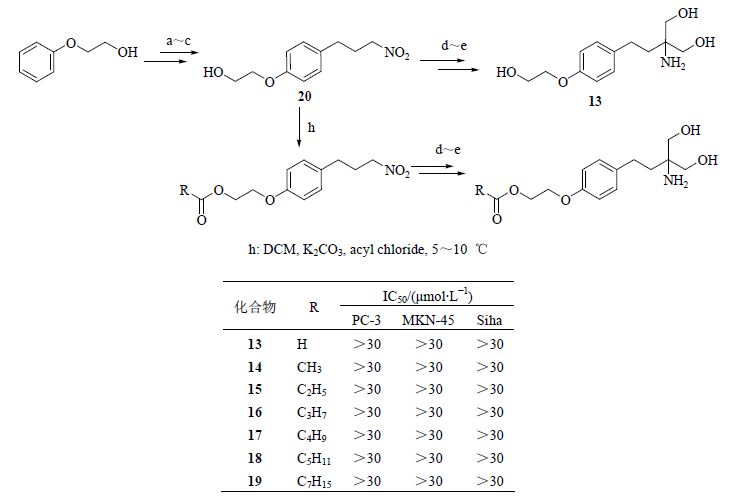
以2-苯氧基乙醇为原料,通过傅克酰基化反应、SN2取代反应、羰基还原、双亨利反应,最后经过催化氢化制得化合物13。
以2-苯氧基乙醇为原料,通过傅克酰基化反应、SN2取代反应、羰基还原得到关键中间体20,继而经过与烷基酸的酯化反应、双亨利反应,最后经过催化氢化制得2-苯氧基乙醇类芬戈莫德类似物13~19。合成路线见图 5。
3 目标化合物的活性评价采用MTT法,将对数生长期的Siha、PC-3和MKN-45细胞用培养基稀释至4×104/mL,分别接种于96孔培养板,每孔100 μL,孵育过夜后除去培养液,每孔加入样品100 μL,每组均设3个复孔。同时设空白组,空白组设3个复孔,且每孔加入含0.1% DMSO的RPMI 1640 100 μL。所有组在37 ℃、5%的二氧化碳培养箱中培养72 h后,每孔加入5 mg/mL的MTT 100 μL,继续置于培养箱中培养4 h后,小心吸弃每孔中液体,再加入DMSO 150 μL,将培养板置于水平摇床上振摇10 min,于酶标 仪上检测吸光度(A)值,检测波长为570 nm。计算得出细胞抑制率后经软件计算IC50值,结果见图 3~5。
4 结构鉴定与讨论 4.1 结构鉴定化合物1(芬戈莫德):白色粉末,产率9.2%,EI-MS m/z: 308.27 [M+H]+。1H-NMR (400 MHz,CDCl3) δ: 7.08 (4H,s,Ar-H),3.62 (2H,s,-CH2OH),3.54 (2H,s,-CH2OH),2.52~2.60 (4H,m,2×Ar-CH2-),1.69~1.70 (2H,m,Ar-CH2CH2-C-NH2),1.57 (2H,m,ArCH2CH2C5H10),1.20~1.25 (10H,m,-C5H10CH3),0.87 (3H,t,J = 6.0 Hz,-CH2CH3);13C- NMR (100 MHz,CDCl3) δ: 139.6,131.1,71.5,54.8,36.9,35.8,32.5,32.4,30.3,30.0,29.8,28.5,23.1,14.0。
|
图 5 2-苯氧基乙醇类芬戈莫德类似物的合成 Fig. 5 Synthesis of fingolimod analogues of 2-phenoxyethanol |
化合物2:微黄色固体,产率8.9%,EI-MS m/z: 281.39 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.24~7.02 (4H,m,Ar-H),4.24 (2H,t,J = 7.0 Hz,ArCH2CH2-O-),3.70~3.44 (4H,m,2×NH2-C- CH2OH),2.89 (2H,t,J = 7.0 Hz,ArCH2CH2-O-),2.63 (2H,m,ArCH2CH2-C-NH2),2.1 (3H,s,O=C-CH3),1.80~1.65 (2H,m,ArCH2CH2-C-NH2);13C-NMR (100 MHz,MeOD) δ: 171.6,140.2,136.3,130.5,129.2,69.7,64.9,56.5,36.1,29.3,28.8,20.6。
化合物3:白色固体,产率8.6%,EI-MS m/z: 296.29 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.20~7.03 (4H,m,Ar-H),4.25 (2H,t,J = 7.0 Hz,ArCH2CH2-O-),3.65~3.44 (4H,m,NH2-C-CH2OH),2.90 (2H,t,J = 7.0 Hz,ArCH2CH2-O-),2.63 (2H,m,ArCH2CH2-C-NH2),2.41 (2H,s,O=C-CH2CH3),1.89 (2H,m,ArCH2CH2-C-NH2),1.25 (3H,t,J = 7.5 Hz,O=C-CH2CH3);13C-NMR (100 MHz,MeOD) δ: 171.5,140.2,136.3,130.5,129.2,69.7,64.9,56.5,36.1,29.3,28.8,27.2,8.9。
化合物4:白色油状物,产率6.4%,EI-MS m/z: 281.26 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.17 (4H,m,Ar-H),3.70 (4H,s,2×NH2-C-CH2OH),3.37 (2H,m,ArCH2CH2-NH-),2.79 (2H,t,J = 6.9 Hz,ArCH2CH2-NH-),2.69~2.60 (2H,m,ArCH2CH2- C-NH2),1.99~1.88 (5H,m,O=C-CH3,ArCH2CH2- C-NH2);13C-NMR (100 MHz,MeOD) δ: 172.2,141.3,138.4,130.7,128.7,69.7,55.6,41.8,35.8,29.4,28.8,22.4。
化合物5:白色油状物,产率7.9%,EI-MS m/z: 295.26 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.19 (4H,m,Ar-H),3.70 (4H,s,2×NH2-C-CH2OH),3.38 (2H,m,ArCH2CH2-NH-),2.79 (2H,m,ArCH2CH2- NH-),2.70~2.60 (2H,m,ArCH2CH2-C-NH2),2.25 (2H,m,O=CCH2),2.00~1.89 (2H,m,ArCH2CH2- C-NH2),1.04 (3H,t,J = 7.4 Hz,O=CCH2CH3);13C-NMR (100 MHz,MeOD) δ: 172.2,141.3,138.4,130.7,128.8,69.7,55.6,41.9,35.8,29.7,29.3,28.8,10.1。
化合物6:白色油状物,产率10.9%,EI-MSm/z: 310.46 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.19 (4H,m,Ar-H),3.70 (4H,s,2×NH2-C-CH2OH),3.38 (2H,m,ArCH2CH2-NH),2.79 (2H,m,ArCH2CH2- NH-),2.70~2.60 (2H,m,ArCH2CH2-C-NH2),2.15 (2H,m,O=CCH2),2.00~1.89 (2H,m,ArCH2CH2- C-NH2),1.34 (2H,m,O=CCH2CH2CH3),0.91 (3H,t,J = 7.0 Hz,O=CCH2CH2CH3);13C-NMR (100 MHz,MeOD) δ: 172.2,141.3,138.4,130.7,128.7,69.7,55.6,41.8,38.7,35.8,29.7,29.3,28.8,19.1,13.1。
化合物7:白色油状物,产率8.9%,EI-MS m/z: 351.44 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.23~7.11 (4H,m,Ar-H),3.77~3.64 (4H,m,2×NH2-C-CH2OH),3.39 (2H,m,ArCH2CH2-NH),2.79 (2H,m,ArCH2CH2-NH-),2.70~2.60 (2H,m,ArCH2CH2-C-NH2),2.15 (2H,t,J = 7.5 Hz,O=C-CH2),2.00~1.89 (2H,m,ArCH2CH2-C-NH2),1.67~1.49 (2H,m,O=CCH2CH2),1.41~1.22 (6H,m,O=CCH2CH2C3H6CH3),0.91 (3H,t,J = 6.7 Hz,O=CCH2CH2C3H6CH3);13C-NMR (100 MHz,MeOD) δ: 172.2,141.2,138.4,130.7,128.8,69.7,55.6,41.8,38.7,36.3,35.8,31.1,29.7,28.5,28.3,25.6,22.7,14.1。
化合物8:白色油状物,产率13.9%,EI-MSm/z: 365.38 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.16 (4H,m,Ar-H),3.77~3.54 (4H,m,2×NH2-C- CH2OH),3.39~3.35 (2H,m,ArCH2CH2-NH),2.77 (2H,m,ArCH2CH2-NH-),2.65 (2H,s,ArCH2CH2-C- NH2),2.15 (2H,m,O=C-CH2) 1.92 (2H,s,ArCH2CH2-C-NH2),1.59 (2H,m,O=CCH2CH2),1.31 (8H,m,O=CCH2CH2C4H8CH3),0.90 (3H,t,J = 6.1 Hz,O=CCH2CH2C4H8CH3);13C-NMR (100 MHz,MeOD) δ: 172.2,141.2,138.4,130.7,128.8,69.7,55.6,41.9,38.7,36.3,35.8,31.18,29.7,28.6,28.4,25.6,22.7,14.2。
化合物9:白色油状物,产率9.6%,EI-MS m/z: 288.34 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.36~7.29 (2H,m,H-ArCH2CH2-C-NH2),7.26 (2H,t,J = 7.1 Hz,Ar-H),7.09 (1H,t,J = 7.4 Hz,Ar-H),6.98~6.86 (4H,m,O-Ar-H),3.81~3.65 (4H,m,2×NH2-C-CH2OH),2.76~2.59 (2H,m,ArCH2CH2- C-NH2),2.05~1.88 (2H,m,ArCH2CH2-C-NH2);13C-NMR (100 MHz,MeOD) δ: 156.9,154.7,136.0,128.9,128.4,123.4,120.8,119.1,66.6,55.6,29.7,28.8。
化合物10:白色固体,产率9.1%,EI-MS m/z: 296.41 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.08 (2H,d,J = 8.3 Hz,Ar-H),6.86 (2H,d,J = 8.3 Hz,O-Ar-H),3.89 (2H,t,J = 6.6 Hz,OCH2),3.54 (4H,s,2×NH2-C-CH2OH),2.53 (2H,m,ArCH2CH2- C-NH2),2.16 (2H,m,ArCH2CH2-C-NH2),1.76 (2H,m,OCH2CH2),1.42 (2H,m,OCH2CH2CH2),1.30 (4H,m,OCH2CH2CH2C2H4CH3),0.89 (3H,t,J = 6.4 Hz,OCH2CH2CH2C2H4CH3);13C-NMR (100 MHz,CD3OD) δ: 157.6,134.2,129.9,116.1,69.6,66.7,55.5,31.7,29.7,28.8,26.9,23.1,14.0。
化合物11:白色固体,产率9.4%,EI-MS m/z: 310.43 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.08 (2H,d,J = 8.3 Hz,Ar-H),6.86 (2H,d,J = 8.3 Hz,O-Ar-H),3.89 (2H,t,J = 6.6 Hz,OCH2),3.54 (4H,s,2×NH2-C-CH2OH),2.53 (2H,m,ArCH2CH2-C- NH2),2.16 (2H,m,ArCH2CH2-C-NH2),1.76 (2H,m,OCH2CH2),1.42 (2H,m,OCH2CH2CH2),1.30 (6H,m,OCH2CH2CH2C3H6CH3),0.89 (3H,t,J = 6.4 Hz,OCH2CH2CH2C2H4CH3);13C-NMR (100 MHz,MeOD) δ: 157.6,134.1,130.1,116.1,69.5,66.7,55.6,31.7,29.7,29.1,28.8,23.1,14.0。
化合物12:白色固体,产率9.8%,EI-MS m/z: 324.45 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.08 (2H,d,J = 8.3 Hz,Ar-H),6.86 (2H,d,J = 8.3 Hz,O- Ar-H),3.89 (2H,t,J = 6.6 Hz,OCH2),3.54 (4H,s,2×NH2-C-CH2OH),2.53 (2H,m,ArCH2CH2-C-NH2),2.16 (2H,m,ArCH2CH2-C-NH2),1.76 (2H,m,OCH2CH2),1.42 (2H,m,OCH2CH2CH2),1.30 (8H,m,OCH2CH2CH2C4H8CH3),0.89 (3H,t,J = 6.4 Hz,OCH2CH2CH2C4H8CH3);13C-NMR (100 MHz,MeOD) δ: 157.6,134.1,130.2,116.2,69.5,66.7,55.6,31.7,29.7,29.1,28.8,26.5,23.1,14.1。
化合物13:微黄色固体,产率9.1%,EI-MS m/z: 256.25 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.17 (2H,d,J = 8.6 Hz,Ar-H),6.88 (2H,d,J = 8.6 Hz,O-Ar-H),4.06~3.98 (2H,m,Ar-OCH2CH2OH),3.89~3.83 (2H,m,Ar-OCH2CH2OH),3.77~3.69 (4H,m,2×NH2-C-CH2OH),2.66~2.56 (2H,m,ArCH2CH2-C-NH2),1.98~1.88 (2H,m,ArCH2CH2- C-NH2);13C-NMR (100 MHz,MeOD) δ: 157.6,134.0,130.2,116.2,69.8,66.7,60.8,55.5,29.7,28.8。
化合物14:微黄色固体,产率9.1%,EI-MS m/z: 298.27 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.17 (2H,d,J = 8.6 Hz,Ar-H),6.88 (2H,d,J = 8.6 Hz,O-Ar-H),4.41 (2H,m,Ar-O-CH2CH2O),4.21 (2H,m,Ar-OCH2CH2O),3.74~3.64 (4H,m,2×NH2-C- CH2OH),2.66~2.56 (2H,m,ArCH2CH2-C-NH2),2.15 (3H,s,O=C-CH3) 1.98~1.88 (2H,m,ArCH2 CH2-C-NH2);13C-NMR (100 MHz,MeOD) δ: 171.7,157.6,134.2,130.2,116.1,67.4,66.7,60.2,55.5,29.7,28.8,20.6。
化合物15:微黄色固体,产率9.4%,EI-MS m/z: 312.27 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.23~7.07 (2H,m,Ar-H),6.89~6.79 (2H,m,O-Ar- H),4.39 (2H,m,Ar-OCH2CH2O),4.16 (2H,m,Ar-OCH2CH2O),3.81~3.59 (4H,m,2×NH2-C- CH2OH),2.68~2.55 (2H,m,ArCH2CH2-C-NH2),2.37 (2H,q,J = 7.6 Hz,O=C-CH2CH3),2.00~1.87 (2H,m,ArCH2CH2-C-NH2),1.11 (3H,t,J = 7.6 Hz,O=C-CH2CH3);13C-NMR (100 MHz,MeOD) δ: 175.9,157.6,134.0,130.2,116.1,67.3,66.7,60.8,55.6,29.7,28.8,27.1,8.9。
化合物16:微黄色固体,产率9.1%,EI-MS m/z: 326.21 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.22~7.10 (2H,m,Ar-H),6.95~6.69 (2H,m,O-Ar-H),4.46~4.23 (2H,m,Ar-OCH2CH2O),4.22~4.02 (2H,m,Ar-OCH2CH2O),3.80~3.57 (4H,m,2×NH2-C-CH2OH),2.61 (2H,m,ArCH2CH2-C-NH2),2.34 (2H,t,J = 7.3 Hz,O=C-CH2CH2),1.96~1.80 (4H,m,O=C-CH2CH2,ArCH2CH2-C-NH2),0.99 (3H,t,J = 7.2 Hz,O=C-CH2CH2CH3);13C-NMR (100 MHz,MeOD) δ: 174.0,157.6,134.1,130.2,116.1,67.3,66.7,60.8,55.5,34.92,29.7,28.8,18.7,13.5。
化合物17:微黄色固体,产率8.9%,EI-MS m/z: 340.27 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.22~7.10 (2H,m,Ar-H),6.95~6.69 (2H,m,O-Ar- H),4.46~4.23 (2H,m,Ar-OCH2CH2O),4.22~4.02 (2H,m,Ar-OCH2CH2O),3.80~3.57 (4H,m,2×NH2-C-CH2OH),2.61 (2H,m,ArCH2CH2-C-NH2),2.34 (2H,t,J = 7.3 Hz,COCH2),1.96~1.80 (2H,m,ArCH2CH2-C-NH2),1.60 (2H,m,O=CCH2CH2),1.30 (2H,m,O=CCH2CH2CH2CH3) 0.89 (3H,t,J = 6.9 Hz,O=CCH2CH2CH2CH3);13C-NMR (100 MHz,MeOD) δ: 174.2,157.6,134.1,130.2,116.1,67.3,66.7,60.8, 55.5,34.1,29.7,28.8,26.4,22.4,14.0。
化合物18:微黄色固体,产率8.4%,EI-MSm/z: 355.27 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.22~7.10 (2H,m,Ar-H),6.95~6.69 (2H,m,O-Ar- H),4.46~4.23 (2H,m,Ar-OCH2CH2O),4.22~4.02 (2H,m,Ar-OCH2CH2O),3.80~3.57 (4H,m,2×NH2-C-CH2OH),2.61 (2H,m ArCH2CH2-C-NH2),2.34 (2H,t,J = 7.3 Hz,O=C-CH2CH2),1.96~1.80 (2H,m,ArCH2CH2-C-NH2),1.60 (2H,m,O=CCH2CH2),1.43~1.18 (4H,m,O=CCH2CH2 C2H4CH3),0.89 (3H,t,J = 6.9 Hz,O=CCH2CH2 C2H4CH3);13C-NMR (100 MHz,MeOD) δ: 174.2,157.6,134.1,130.2,116.1,67.3,66.7,60.8,55.5,33.9,30.9,29.7,28.8,26.2,23.1,14.0。
化合物19:微黄色固体,产率8.7%,EI-MS m/z: 382.37 [M+H]+。1H-NMR (400 MHz,MeOD) δ: 7.22~7.10 (2H,m,Ar-H),6.95~6.69 (2H,m,O-Ar- H),4.46~4.23 (2H,m,ArOCH2CH2O),4.22~4.02 (2H,m,ArOCH2CH2O),3.80~3.57 (4H,m,2×NH2-C-CH2OH),2.61 (2H,m,ArCH2CH2-C-NH2),2.34 (2H,t,J = 7.3 Hz,O=C-CH2CH2),1.96~1.80 (2H,m,ArCH2CH2-C-NH2),1.60 (2H,m,COCH2- CH2),1.46~1.17 (8H,m,O=CCH2CH2C4H8CH3),0.88 (3H,t,J = 6.9 Hz,O=CCH2CH2C4H8CH3);13C-NMR (100 MHz,MeOD) δ: 174.1,157.6,134.1,130.2,116.1,67.3,66.7,60.8,55.5,33.9,31.7,29.3,29.0,28.8,25.4,23.1,14.1。
4.2 抗肿瘤活性评价及构效关系设计合成的3类芬戈莫德类似物中,B类化合物中,化合物10、11、12具有与芬戈莫德相当的抗肿瘤活性,化合物9没有达到预期的活性效果。说明侧链中引入苯环这样的刚性结构,不利于提高活性。侧链为体积较小的、长度为6~8原子的柔性基团时,可以使化合物保持活性。A类化合物没有达到预期的活性效果,可能是由于A类化合物疏水烷基侧链上引入的酰胺或酯键,增大了侧链的体积,化合物难以进入S1P受体口袋的长腔,使化合物与受体亲和力下降,继而导致活性下降。C类化合物与A类相比,主要差别是C类化合物在烷氧基侧链中引入了酯键,没有达到预期的活性效果。表明侧链的体积较大时,使化合物与受体亲和力下降,活性下降,这与B类化合物结果类似。综上所述,体积较小的柔性侧链是芬戈莫德类似物具有抗肿瘤作用的必须基团。在进一步芬戈莫德类似物侧链合成研究中,应该选择体积较小的柔性侧链、长度为6~8原子并可以在此基础上,把侧链上的碳原子以适当的杂原子代替,以提高化合物与受体的亲和力,从而提高目标化合物的抗肿瘤活性。
| [1] | 胡 敏, 皮惠敏, 郑元梅. 冬虫夏草的化学成分及药理作用 [J]. 时珍国医国药, 2008, 9(11): 2804-2806. |
| [2] | Chibak A. FTY-720, immunosuppressant [J]. Drugs Fut, 1997, 1(22): 18-22. |
| [3] | Fujita T, Inoue K, Yamamoto S, et al. Part II. A potent immunosuppressive activity found in Isaria sinclairii metabolite [J]. J Antibiot, 1994, 47(2): 208-215. |
| [4] | Pitman M R, Woodcock J M, Lopez A F, et al. Molecular targets of FTY720 (fingolimod) [J]. Curr Mol Med, 2012, 12(10): 1207-1219. |
| [5] | Chiba K, Matsuyuki H, Maeda Y, et al. Role of sphingosine 1-phosphate receptor type 1 in lymphocyte egress from secondary lymphoid tissues and thymus [J]. Cell Mol Immunol, 2006, 3(1): 11-19. |
| [6] | Lee J W, Ryu J Y, Yoon G, et al. Sphingosine kinase 1 as a potential therapeutic target in epithelial ovarian cancer [J]. Cancer, 2015, 137(1): 221-229. |
| [7] | Pchejetski D, Bohler T, Brizuela L, et al. FTY720 (fingolimod) sensitizes prostate cancer cells to radiotherapy by inhibition of sphingosine kinase-1 [J]. Cancer Res, 2010, 70(21): 8651-8661. |
| [8] | Pereira F V, Arruda D C, Figueiredo C R, et al. Figueiredo, FTY720 induces apoptosis in B16F10-NEX2 murine melanoma cells, limits metastatic development in vivo, and modulates the immune system [J]. Clinics, 2013, 68(7): 1018-1027. |
| [9] | Pyne S, Bittman R, Pyne N J, et al. Sphingosine kinase inhibitors and cancer: seeking the golden sword of Hercules [J]. Cancer Res, 2011, 71(21): 6576-6582. |
| [10] | Gao Y, Gao F, Chen K, et al. Sphingosine kinase 1 as an anticancer therapeutic target [J]. Drug Des Develop Ther, 2015, 9: 3239-3245. |
| [11] | Hanson M A, Roth C B, Jo E, et al. Crystal structure of a lipid G protein-coupled receptor [J]. Science, 2012, 335(6070): 851-855. |
| [12] | Yan N, Chen K, Bai X, et al. A concise synthesis of Fingolimod: an orally available drug for treating multiple sclerosis [J]. Chem Cent J, 2015, 9(1): 1-4. |
 2016, Vol. 47
2016, Vol. 47


