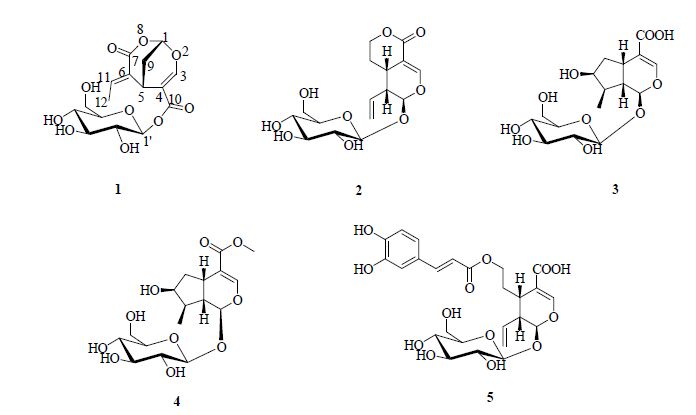
莛子藨属Triosteum Linn. 系忍冬科(Caprifoliaceae)多年生草本植物。莛子藨属全球约7~8种,主要分布于北美、中亚至东亚等地,其中我国产3种,分别为莛子藨Triosteum pinnatifidum Maxim.、穿心莛子藨T. himalayanum Wall.、腋花莛子藨T. sinuatum Maxim.,多分布于我国西南部、西北部和东北部[1]。莛子藨的根称天王七、白果七等,是“陕西七药”之一,味苦、涩,性平,具有理气活血、祛风湿、健脾胃、消炎镇痛、生肌等功效,用于治疗劳伤、风湿腰腿痛、跌打损伤、消化不良、月经不调、白带等症。其叶称天王七叶,味苦、涩,性平,可止血生肌[2]。据文献报道莛子藨属中的化合物主要有环烯醚萜类、黄酮类、苯丙素类及生物碱类等[3, 4, 5, 6, 7]。本课题组从莛子藨的地下部分已经分离得到了环烯醚萜类、单萜二糖苷、生物碱类等化合物[3, 5, 7],为进一步探讨莛子藨的化学成分,本实验对莛子藨地上部分的乙醇提取物正丁醇萃取部分进行了化学成分的研究,并从中分离得到5个环烯醚萜化合物,分别鉴定为triohima C 10-O-β-D-glucopyranoside(1)、獐芽菜苷(sweroside,2)、马钱子苷酸(loganic acid,3)、马钱子苷(loganin,4)、grandifloroside(5)。其中化合物1为新化合物,命名为莛子藨苷。结构见图 1。
|
图 1 化合物1~5的结构 Fig. 1 Structures of compounds 1—5 |
Bruker Tensor 27红外光谱仪(瑞士Bruker公司);Bruker Avance Ⅲ液体核磁共振谱仪(600 MHz,瑞士Bruker公司);Bruker microTOF-Q Ⅱ高分辨率质谱仪(瑞士Bruker公司);薄层色谱硅胶(GF254,10~40 μm,青岛海洋化工厂),柱色谱硅胶(100~200、200~300目,青岛海洋化工厂);Sephadex LH-20葡聚糖凝胶(Amersham Pharmacia生物技术公司);ODS柱色谱硅胶(Fuji Silysia化学有限公司,20~45 μm);D101大孔吸附树脂(天津市海光化工有限公司);色谱甲醇(天津市康科德科技有限公司);其他试剂均为分析纯(天津市江天化工技术有限公司,天津市康科德科技有限公司)。
莛子藨的地上部分2006年采于陕西省眉县,由西北农林科技大学的吴振海教授鉴定为莛子藨Triosteum pinnatifidum Maxim.,标本保存在天津大学药物科学与技术学院天然药物化学实验室。
2 提取与分离莛子藨干燥地上部分5.5 kg,95%乙醇(25 L)冷浸3周,再用95%乙醇回流提取2次,每次2 h,60%乙醇回流提取2次,每次2 h。合并提取液,减压浓缩至无醇味,得浸膏400 g,加2 L蒸馏水混悬,依次用等体积石油醚、氯仿、醋酸乙酯、正丁醇进行萃取,得正丁醇萃取部分113 g。正丁醇萃取部分再经D101大孔吸附树脂柱分离,以乙醇-水(0∶100→30∶70→50∶50→95∶5)梯度洗脱,得30%乙醇洗脱部分32 g、50%乙醇洗脱部分12 g。
取30%乙醇洗脱部分29 g,经硅胶柱色谱分离,醋酸乙酯-甲醇(9∶1→3∶7)梯度洗脱,通过TLC检识得5个组分(Fr. 1~5)。Fr. 2(1.05 g)经硅胶柱色谱分离,二氯甲烷-甲醇(96∶4→95∶5→92∶8→8∶2→0∶100)梯度洗脱,得到的Fr. 2.22~2.32(440 mg)再采用反相ODS柱色谱分离纯化,甲醇- 水(50∶50→70∶30→100∶0)梯度洗脱,得化合物1(16 mg)。Fr. 3(2.1 g)经Sephadex LH-20(甲醇)柱色谱分离,得4个组分(Fr. 3.1~3.4)。Fr. 3.2(1.7 g)依次经ODS柱色谱,硅胶柱色谱分离得到化合物4(13 mg)。Fr. 3.4(6.5 g)经硅胶柱色谱分离,醋酸乙酯-甲醇(100∶0→92∶8→84∶16)梯度洗脱,得21个组分。通过TLC捡识,合并组分Fr. 3.4.16~3.4.20(3.1 g),然后经ODS柱色谱分离,甲醇-水(20∶80→30∶70→40∶60→60∶40→100∶0)洗脱,得化合物2(1.0 g)和3(20 mg)。
50%乙醇洗脱部分(10 g)经硅胶柱色谱分离,醋酸乙酯-甲醇(9∶1→3∶7)梯度洗脱,得12个组分,Fr. 7~9(606 mg)经Sephadex LH-20柱色谱(甲醇)分离纯化,得化合物5(70 mg)。
3 结构鉴定化合物1:无色针晶(甲醇),易溶于甲醇,难溶于二氯甲烷。[α]D20−38.89°(c 0.36,MeOH)。HR-ESI-MS m/z: 395.095 2 [M+Na]+(C16H20O10Na+,计算值395.0949),确定化合物1分子式为C16H20O10。${\rm{IR }}\nu _{\max }^{{\rm{KBr}}}$(cm−1): 3 430,1 649,1 049,表明分子中含有羟基、羰基、双键等官能团。
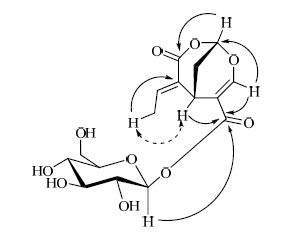
1H-NMR (600 MHz,CD3OD)(表 1)中可见2个氢信号δH 6.92 (1H,q,J = 7.2 Hz,H-11) 和δH 2.01 (3H,d,J = 7.2 Hz,12-CH3) 提示结构中存在亚乙基片段;2组连接2个叔碳原子的仲碳上的氢信号δH 2.10 (1H,ddd,J = 14.0,3.6,1.4 Hz,H-9a) 和δH 2.27 (1H,ddd,J = 14.0,2.3,2.3 Hz,H-9b);1个连氧双键上的氢信号δH 7.67 (1H,s,H-3);1组连氧碳上的氢信号δH 3.20~5.50,推测为糖基,其中δH 5.47 (1H,d,J = 8.0 Hz,H-1′) 为糖的端基氢信号。13C-NMR (150 MHz,CD3OD) 中显示有16个碳,其中2个羰基碳原子、4个烯碳原子、7个连氧碳原子和3个不连氧的饱和碳原子。对比化合物1与triohima C[6]的1H-NMR和13C-NMR数据,发现二者非常相似,只是化合物1比triohima C多了7个氢信号 δH 5.47 (1H,d,J = 8.0 Hz,H-1′),3.78 (1H,dd,J = 12.1,1.9 Hz,H-6′b),3.62 (1H,dd,J = 12.1,5.1 Hz,H-6′a),3.26~3.40 (4H,overleped,H-2′~5′) 和6个碳信号δC 62.3,71.0,73.8,77.8,78.8,95.7,这些信号提示结构中存在1个β-D-葡萄糖,推测化合物1是triohima C的葡萄糖苷。通过进一步综合分析1H-1H COSY谱、HSQC谱和HMBC谱验证了前述推测。在HMBC谱图(图 2)中δH 5.47 (1H,d,J = 8.0 Hz,H-1′)与δC165.8 (C-10) 有远程相关,表明10位羧基与葡萄糖1位羟基酯化。在NOESY谱图中δH 3.99 (1H,brs,H-5) 与δH 2.01 (3H,d,J = 7.2 Hz,12-CH3) 有NOE相关,而与δH 6.92 (1H,q,J = 7.2 Hz,H-11) 没有NOE相关,可以确定Δ6(11)双键的构型为E,如图 2所示。由此鉴定化合物1为triohima C 10-O-β-D-glucopyranoside,为1个新化合物,命名为莛子藨苷。
|
|
表 1 化合物1的1H-NMR和13C-NMR 数据 Table 1 1H-NMR and 13C-NMR data of compound 1 |
|
图 2 化合物1的重要HMBC (→) 和NOESY ( ) 相关
Fig. 2 Key HMBC (→) and NOESY ( ) 相关
Fig. 2 Key HMBC (→) and NOESY ( ) correlations of compound 1 ) correlations of compound 1
|
化合物2:白色固体,易溶于甲醇,与獐芽菜苷对照品[3]在3个展开剂系统下进行共薄层检查,其色谱行为一致,故鉴定化合物2为獐芽菜苷。
化合物3:白色固体,易溶于甲醇,与马钱子苷酸对照品在3个展开剂系统下进行共薄层检查,其色谱行为一致,鉴定其化合物3马钱子苷酸。
化合物4:白色固体,易溶于甲醇。1H-NMR (600 MHz,CD3OD) δ: 5.28 (1H,d,J = 4.5 Hz,H-1),7.39 (1H,brs,H-3),3.11 (1H,brdd,J = 8.0,8.2 Hz,H-5),2.23 (1H,brdd,J = 14.0,7.9 Hz,H-6a),1.62 (1H,ddd,J = 13.4,7.6,5.1 Hz,H-6b),4.04 (1H,brdd,J = 4.3,4.3 Hz,H-7),1.88 (1H,m,H-8),2.02 (1H,ddd,J = 9.2,9.1,4.5 Hz,H-9),1.09 (3H,d,J = 6.8 Hz,10-CH3),3.69 (3H,s,11-OMe),4.65 (1H,d,J = 7.9 Hz,H-1′),3.19 (1H,dd,J = 9.0,8.0 Hz,H-2′),3.25~3.38 (3H,m,H-3′~5′),3.90 (1H,brd,J = 11.8 Hz,H-6′a),3.66 (1H,dd,J = 11.9,5.9 Hz,H-6′b)。以上数据与文献报道基本一致[8],故鉴定化合物4为马钱子苷。
化合物5:淡黄色固体,易溶于甲醇。1H-NMR (600 MHz,CD3OD) δ: 5.57 (1H,d,J = 6.5 Hz,H-1),7.52 (1H,s,H-3),2.93 (1H,ddd,J = 6.5,6.5,13.0 Hz,H-5),2.12 (1H,td,J = 14.0,7.0 Hz,H-6a),1.89 (1H,td,J = 14.0,7.0 Hz,H-6b),4.26 (1H,m,H-7a),4.20 (1H,m,H-7b),5.82 (1H,ddd,J = 17.5,9.0,8.5 Hz,H-8),2.69 (1H,ddd,J = 8.5,6.0,14.0 Hz,H-9),5.33 (1H,brd,J = 17.0 Hz,H-10a),5.28 (1H,brd,J = 10.5 Hz,H-10b),4.72 (1H,d,J = 8.0 Hz,H-1′),3.22 (1H,t,J = 8.5 Hz,H-2′),3.35 (1H,t,J = 9.5 Hz,H-3′),3.29 (1H,t,J = 9.5 Hz,H-4′),3.32 (1H,overlapped,H-5′),3.92 (1H,dd,J = 12.0,2.0 Hz,H-6′a),3.69 (1H,dd,J = 12.0,6.0 Hz,H-6′b),7.05 (1H,d,J = 2.0 Hz,H-2″),6.79 (1H,d,J = 8.5 Hz,H-5″),6.95 (1H,dd,J = 8.5,2.0 Hz,H-6″),7.54 (1H,d,J = 16.0 Hz,H-7″),6.24 (1H,d,J = 16.0 Hz,H-8″)。以上数据与文献报道基本一致[9],故鉴定化合物5为grandifloroside。
| [1] | 中国科学院植物研究所. 中国植物志 [M]. 北京: 科学出版社, 1999. |
| [2] | 郭增军. 陕西七药 [M]. 西安: 陕西科学技术出版社, 2003. |
| [3] | Chai X, Su Y F, Zheng Y H, et al. Iridoids from the roots of Triosteum pinnatifidum [J]. Biochem Syst Ecol, 2010, 38(2): 210-212. |
| [4] | Ding H X, Chen Y J, Zhao J, et al. Chemical constituents from the aerial parts of Triosteum pinnatifidum [J]. Chem Nat Compd, 2013, 49(1): 95-96. |
| [5] | Huang X, Li Y, Su Y F, et al. Monoterpene indole alkaloids and monoterpene diglycosides from the roots of Triosteum pinnatifidum [J]. Phytochem Lett, 2014, 7: 30-34. |
| [6] | Li Z M, Chen J J, Li Y, et al. Two novel iridoids with an unusual δ-lactone-containing skeleton from Triosteum himalayanum [J]. Tetrahedron Lett, 2009, 50(28): 4132-4134. |
| [7] | Chai X, Su Y F, Yan S L, et al. Chemical constituents of the roots of Triosteum pinnatifidum [J]. Chem Nat Compd, 2014, 50(6): 1149-1152. |
| [8] | Mpondo E M, Garcia J. Iridoids from Gentiana verna [J]. Phytochemistry, 1989, 28(9): 2503-2504. |
| [9] | Itoh A, Fujii K, Tomatsu S, et al. Six secoiridoid glucosides from Adina racemosa [J]. J Nat Prod, 2003, 66(9): 1212-1216. |
 2016, Vol. 47
2016, Vol. 47


