2. 天津中医药大学 天津市中药化学与分析重点实验室, 天津 300193
2. Tianjin Key Laboratory of TCM Chemistry and Analysis, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
阿尔茨海默病(Alzheimer’s disease,AD)是一种严重危害人类健康的神经退行性疾病[1]。有研究表明在患病人群中,65岁的患病率为1%,而95岁及以上人群的患病率达50%[2]。AD临床症状以进行性记忆力减退、认知功能障碍和行为异常为特征,以脑萎缩、脑神经细胞外出现β类淀粉样肽聚集形成的老年斑、脑神经细胞内tau蛋白异常聚集形成神经原纤维缠结及神经元丢失为其病理特征。老年性痴呆按发病机制不同,主要分为血管性痴呆(vascular dementia,VD)、阿尔茨海默病以及两者并存的混合型痴呆3种类型[3]。尽管从发现AD至今已经有100多年的历史,但由于其病因及发病机制复杂,涉及多系统、多环节结构与功能异常,AD发病机制的学说有很多,包括胆碱能学说、Aβ学说、衰老学说、tau蛋白过度磷酸化学说、自由基学说、代谢紊乱学说和基因学说等[4],但是没有一个公认且能够全面准确地解释AD的机制假说。中药以传统中医理论为指导,具有应用历史悠久、来源丰富、疗效广泛、靶点多样、不良反应少等特点,正契合了AD复杂多样的发病机制,为研发AD新药提供了一条新的途径。
天南星科(Araceae)菖蒲属Acorus L.禾草状多年生草本植物石菖蒲Acorus tatarinowii Schott最初记载于《神农本草经》,被列为上品,是中药中为数不多的芳香开窍药之一,在我国主要分布于黄河以南地区,印度、泰国、越南等国也有[5]。石菖蒲具有开窍豁痰、醒神益智、聪耳明目、化湿开胃的功效,临床上被广泛应用于癫痫、痰厥、热病神昏、中风失语、健忘、耳鸣、痴呆等病证的治疗[6]。在治疗老年痴呆的132首复方共使用的150味药材中,石菖蒲的使用频次最高[7]。石菖蒲中化学成分主要有苯丙素类(包括β-细辛醚、α-细辛醚、丁香酚和异丁香酚等挥发性成分)、木脂素类、生物碱类、糖类、有机酸类和氨基酸等[8]。近年来,有关石菖蒲提取物及其主要化学成分在改善学习记忆功能及治疗AD方面的研究报道日渐增多,本文对近年来石菖蒲及其活性成分治疗AD的相关研究进展进行综述。
1 石菖蒲及其活性成分防治AD的作用机制 1.1 改善学习记忆能力学习记忆功能障碍是AD患者早期出现的明显临床表现,至疾病后期,患者生活不能自理,严重影响患者及其家属的日常生活[9]。研究显示,石菖蒲不同药效部位(水煎液和挥发油)均能显著改善β-淀粉样蛋白1-42(amyloid-β 1-42,Aβ1-42)致AD模型小鼠的学习记忆能力,其治疗机制可能是由于抑制了一氧化氮合酶(nitricoxide synthase,NOS)的合成,减少了大脑和海马内源性NO的生成与释放,从而使神经元诱发和维持长时程增强效应(long time potentiation,LTP),增强了突触传递效应;也可能是石菖蒲能调节某些神经递质的释放,影响NO的生成与释放[10, 11]。β-细辛醚(β-asarone,图 1)能改善在海马区注射β-淀粉样蛋白的大鼠和APPswe/PS1dE9双转基因痴呆小鼠学习记忆障碍的认知能力,作用机制可能是通过调节β淀粉样前体蛋白(amyloid precursor protein,APP)的过量表达或分解排泄,对与学习记忆密切相关的突触起到一定的保护和修复作用[12, 13];也具有改善D-半乳糖诱导和Al损伤的AD模型大鼠记忆障碍的能力,其机制可能与促进AD模型鼠海马区的局部脑血流量和脑代谢,下调内皮素-1(ET-1)mRNA的表达有关[14]。顾丰华等[15]发现石菖蒲经水提取并经树脂和柱色谱技术分离获得的完全不含挥发油及细辛醚成分的活性成分SIPI-SCPd,对东莨菪碱所致的动物记忆障碍有改善作用,且该作用并非通过抑制乙酰胆碱酯酶(AChE)而起效,可能与增强超氧化物歧化酶(SOD)活力,减少MDA量的抗氧化等作用有关。研究发现通过嗅觉吸入丁香酚,结合小鼠嗅球摘除模型,采用水迷宫、嗅觉辨识记忆实验以及免疫组织化学检测海马、皮质等脑区的神经递质变化,证实丁香酚能通过嗅觉通路改善小鼠的学习记忆,可能是通过嗅球的神经冲动把信息传递到海马,影响嗅觉传导的信号改变而增强学习记忆功能,其机制可能与嗅觉通路中胆碱乙酸转移酶(ChAT)、γ-氨基丁酸(GABA)、谷氨酸(Glu)等多种神经递质的改变有关[16]。
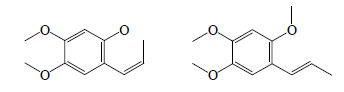 | 图 1 石菖蒲中α-细辛醚和β-细辛醚的结构Fig.1 Structures of α-asarone and β-asarone |
AD患者的胆碱能系统受到损害,导致突触部位乙酰胆碱量降低,从而使患者的学习和记忆能力丧失。临床上治疗这种疾病主要依赖延缓胆碱酯酶释放到突触间隙,采用AChE抑制剂抑制AChE活性,从而发挥对AD的治疗作用[17]。据报道石菖蒲甲醇提取物(0.1 mg/mL)显示有抑制AChE活性的作用[18]。金虹等[19]发现石菖蒲根和叶的挥发油具有较强的抑制AChE活性,所含α-细辛醚为强抑酶活性成分,石菖蒲根醋酸乙酯和正丁醇萃提液抑酶活性分别比石菖蒲叶强,石菖蒲根水提液有微弱抑酶活性,而叶的水提液无抑酶活性,但两者的水提液均含具有酶促作用的化学成分。该研究与石菖蒲挥发油、β-细辛醚能抑制脑内AChE活性报道一致[20]。
1.3 保护中枢神经元Aβ是老年斑(senile plaques,SP)的核心成分,也是AD的病理特征之一[21],其在特定脑区内聚集,能引发相应的神经毒性作用,造成突触损伤,神经元死亡,从而导致了AD的发生[22]。Glu是中枢神经系统(central nervous system,CNS)中一种重要的兴奋性神经递质,在学习和记忆中有不可或缺的作用[23]。由于细胞外无降解Glu的酶,突触间隙Glu的清除依靠神经元和胶质细胞的高亲和力Glu转运体,其是神经冲动高效传递的支持和保障[24]。也就是说,若不能及时清除突触间隙中的Glu,则会导致突触后的Glu受体持续兴奋,从而加快神经元调亡。神经元Glu转运蛋白能维持细胞外Glu水平的稳定,这和癫痫、AD、缺血性脑卒中等疾病有关[25]。Gu等[26]发现石菖蒲中的化学成分α-细辛醚(α-asarone,图 1)能刺激氨基酸转运载体EAAC1来减少突触间隙的Glu浓度,从而抵消持续兴奋。张春霞等[13]发现β-细辛醚及丁香酚可以抑制Aβ的前体蛋白(APP)的过量表达,对与学习记忆密切相关的突触有一定的保护和修复作用,其作用机制可能是通过抑制APP的过量表达或促进APP分解排泄,减少Aβ的生成,减轻Aβ对神经元和神经突触超微结构的毒性损坏,起到保护和修复突触结构的作用。
1.4 抗氧化应激AD发生和发展的关键因素之一是氧化应激(oxidative stress,OS)。由于自由基的过量产生超过了正常细胞抗氧化能力,从而导致氧化应激损伤,造成细胞功能损害[27]。调查显示在AD患者的尸检组织中发现蛋白、脂质、DNA被氧化,进一步论证氧化应激学说[28, 29]。早期研究报道石菖蒲醋酸乙酯提取物显示有抗氧化、清除自由基的功能[30]。Yang等[31]证明β-细辛醚能明显改善脑缺血再灌注大鼠的神经功能,其作用机制是其能增强有关病变发病机制的抗氧化物活性。Tang等[32]发现石菖蒲挥发油和水溶性成分能增加小鼠脑组织中SOD量,显著降低脑内脂质过氧化物(LPO)水平,有效清除自由基、阻止过氧化物形成,从而对脑细胞具有良好的保护作用。Ou等[33]认为石菖蒲特征成分之一丁香酚可以通过改善氧化低密度脂蛋白(ox-LDL)引起的内皮细胞功能障碍,增加抗氧化酶的活性,从而抑制活性氧的生成。江湧等[34]以三氯化铝溶液ig制备AD模型小鼠,不同剂量β-细辛醚ig给药,发现各剂量组均可提高血清SOD、谷胱甘肽过氧化物酶(GSH-Px)的量,降低MDA量。该实验表明,β-细辛醚可通过调节自由基代谢和提高机体抗氧化能力而发挥治疗作用。
1.5 抗神经细胞凋亡细胞凋亡是生理条件下的细胞程序化死亡,是有核细胞在一定条件下通过启动其自身内部机制,激活内源性DNA内切酶而诱发的细胞自然死亡过程。在痴呆和老化模型脑中存在的多种神经细胞凋亡与Aβ沉积于轴突周围引起轴突萎缩、氧化损伤、葡萄糖代谢降低、兴奋性毒性、线粒体损伤有关[35]。研究报道β-细辛醚可以减少血管内皮和皮质的神经细胞损伤[36];并在神经母细胞瘤细胞SH-SY5Y细胞中,通过抑制Aβ诱导的ASK1-MKK7-JNK信号通路,从而减少细胞凋亡[37]。Liu等[38]通过在大鼠脑部海马区域注射Aβ25-35后,考察β-细辛醚对鼠神经细胞的影响。结果发现,β-细辛醚不仅能够抑制Bax、Bad的mRNA表达,也能裂解caspase-9从而减少神经细胞的凋亡。在Aβ25-35作用的PC12细胞中,经β-细辛醚干预后,对损伤细胞的凋亡也有明显的保护作用,其机制可能是通过下调caspase-3的表达和上调Bcl-w和Bcl-xL的表达来实现的[39]。Wei等[40]在Aβ PP/PS1转基因模型鼠中发现β-细辛醚抗细胞凋亡的作用与CaMKII/CREB/Bcl-2信号通路有关。An等[41]研究发现石菖蒲水提醇沉后溶解在RPMI1640培养基中的提取物可以通过抑制线粒体凋亡通路,减少活性氧(ROS)生成,从而保护Aβ25-35损伤引起的PC12细胞凋亡。杨立彬等[42]研究发现α-细辛醚可能通过增强Bcl-2表达,抑制幼鼠癫痫发作激发的海马神经元凋亡。也有研究报道丁香酚可降低Aβ1-40对皮层神经细胞的毒性作用,作用机制可能是有效减少细胞内钙离子浓度,提高细胞存活率,从而更好地发挥保护PC12细胞免受Aβ毒性损伤的作用[43]。
细胞死亡方式可分为细胞坏死和程序性细胞死亡2种,程序性细胞死亡又包括细胞凋亡和自噬性细胞死亡2个亚类[44]。自噬能参与到神经退行性疾病、衰老、癌症等疾病的正常生理或发病过程中[45]。越来越多的报道证明,细胞自噬的调控机制与老年性痴呆的病程有着密切的联系[46, 47]。缺血/缺氧再灌注能激活海马神经元的自噬,并可能在缺血/缺氧再灌注过程中发挥抗损伤的作用[48]。研究表明β-细辛醚可以保护PC12细胞因缺氧/复氧造成的损伤,部分原因是减少了由钙流减弱和细胞基质金属蛋白酶(MMP)升高引起的Beclin-1依赖性自我吞噬作用[49]。也能通过减弱Akt-mTOR自噬信号通路的活性从而保护由Aβ1-42诱导细胞毒性的PC12细胞,这可能是与β-细辛醚参与对抗Aβ神经毒性有关[50]。Liu等[51]也证实β-细辛醚能减弱缺血再灌注对大鼠的损伤,并且呈剂量依赖关系,可能的机制是通过减弱c-Jun氨基末端激酶(JNK)和p-JNK的表达,增强Bcl-2的表达,最终干扰Beclin 1在细胞自噬中的作用。Dai等[52]通过自噬抑制剂筛选模型发现丁香酚能改善氧化应激功能,抑制自噬基因的表达。推测其机制是丁香酚能抑制氧化应激和激活ERK1/2、p38MAPK、IKK/NF-kB信号通路,进而抑制Beclin 1-Bcl-2异质二聚体的解离,阻止细胞自噬。
1.6 抗炎症反应炎性反应学说认为,免疫炎症反应是AD患者神经元损伤的原因之一,主要表现为老年斑被激活,小胶质细胞产生炎症因子、补体蛋白、趋化因子及炎症急性期反应物等神经毒性物质,进而激活免疫炎症反应[53, 54]。小神经胶质细胞活化能够通过诱导神经炎症因子如一氧化氮(NO)、肿瘤坏死因子(TNF-α)和白细胞介素因子(IL-1β)的产生,从而引起神经退行性疾病的发生[55]。通过检测Aβ25-35注射后大鼠海马和颞叶皮层的NO水平,考察在八臂迷宫中大鼠的空间记忆能力,证实α-细辛醚能通过防止NO在海马和颞叶皮层过剩,减少星形胶质细胞增生来保护Aβ25-35损伤的神经元[56]。刘扬俊等[57]发现石菖蒲微波水提液对二甲苯致小鼠耳廓肿胀显示较为明显的抑制作用,具有一定抗炎作用,但是其作用机制仍有待进一步研究。吴晶晶等[58]利用NF-κB启动子双荧光素酶报告基因技术,采用蛋白免疫印迹法检测NF-κB蛋白表达,发现β-细辛醚能有效抑制NF-κB启动子活性,且随剂量增大抑制作用增强,提示β-细辛醚直接抑制NF-κB的转录,可能有较强的抗炎作用。陶莉等[59]通过制备大鼠局灶性脑缺血再灌注模型,应用蛋白质印迹检测大鼠脑组织中NF-κB的表达,发现丁香酚可能通过抑制炎症来减轻大鼠脑缺血再灌注损伤。
2 石菖蒲及其活性成分配伍或辅助用药防治AD早期研究报道石菖蒲有效成分的配伍,能更好地发挥保护PC12细胞免受淀粉样蛋白毒性损伤的作用[60]。在治疗AD疾病的药物研发中,由于药物相对分子质量太大,难以通过血脑屏障,阻碍了药效的发挥[61],而石菖蒲中的主要成分能够顺利通过血脑屏障进入大脑[62],若与其他临床药物配伍用药,可能起到促进药物吸收的作用,从而达到更好的治疗效果。
石菖蒲与远志按1:1的比例混合的水煎剂,高、中低剂量作用于AD大鼠,结果显示能较好改善AD大鼠的学习记忆能力,减少脑内Aβ的聚集,其机制可能与增强SOD活性和抑制羟自由基的生成有关[63]。田会娟等[64]观察石菖蒲2种活性成分单体β-细辛醚、丁香酚按4:1比例配伍,不同剂量对鹅膏蕈氨酸(IBO)致AD模型大鼠学习记忆功能的影响,结果发现石菖蒲中有效成分配伍高剂量对BIO导致的大鼠学习记忆障碍有改善作用。姜静等[65]发现β-细辛醚、丁香酚和远志皂苷3种药物联用应用可显著降低Aβ25-35诱导的神经细胞凋亡率和乳酸脱氢酶(LDH)活性,提高细胞相对生存率。开心散始载于《千金要方》,而石菖蒲是开心散的主要组成药味之一[66]。近年来报道开心散在改善行为学表现、影响Aβ产生和分解、增强神经突触可塑性、保护神经元、抗氧化作用、抑制AchE活性以及调节脑内NO量等方面都有一定的作用[67]。林慧光等[68]发现石菖蒲挥发油香熏辅助化学药治疗AD,其结果在行为学改变、防止脑萎缩、对抗自由基氧化及改善性激素等方面都有促进作用,提示石菖蒲香熏疗法可以作为AD治疗重要的辅助疗法。
3 展望在研发治疗AD药物方面,大部分研究采用的药物筛选模型都是体外细胞培养模型和动物模型,这些筛选手段都不能完全地反映出AD患者的症状,所以目前已进入临床使用的治疗药物和极大部分处于研究阶段的治疗药物都只能减缓AD发病进程,还没有可逆转疾病进程的药物研究成功。FDA已批准上市的药物有他克林、多奈哌齐、卡巴拉汀、加兰他敏和美金刚,但近年来没有批准一个新的AD药物上市,究其原因,与AD的发病机制尚未完全研究透彻,存在胆碱能神经元假说、Aβ毒性假说、Tau蛋白假说、胰岛素假说、自由基损伤假说等多种假说有关[69]。所以深入研究AD的发病机制,从研究思路为单一靶点转化为多个靶点,或许是研发可逆转AD进程药物的关键之一。此外,在建立AD疾病网络基础上,通过系统生物学方法探索基于疾病网络的多靶点影响AD疾病发生发展的关键节点,可能对AD治疗能够取得较好成效[52]。
在长期的临床治疗实践中,发现很多中药在防治AD方面具有很好的临床效果,而天然产物具有生物来源的多样性、结构独特新颖等特点,在今后研发治疗AD药物中具有极其重要的作用。目前市售的石杉碱甲药物的成功开发,也为研发治疗AD的中药开辟了先河。当前在中医理论指导下,中药复方的配伍使用在临床上也取得了一定疗效,利用药物之间的协调拮抗、互相纠正其偏性、减弱毒性等作用可最大限度地提高临床疗效,具有用药剂量小、不良反应轻等优点。这也为以后研发治疗AD药物提供了思路。当然,石菖蒲提取物及其活性成分的临床效果和具体作用机制还有待于进一步深入研究和探讨。
| [1] | Kosasa T, Kuriya Y, Matsui K, et al. Inhibitory effects of donepezil hydrochloride(E2020) on cholinesterase activity in brain and peripheral tissues of young and aged rats[J]. Eur J Pharmacol, 1999, 386(1):7-13. |
| [2] | Nussbaum R L, Ellis C E. Alzheimer's disease and Parkinson's disease[J]. N Engl J Med, 2003, 348:1356-1364. |
| [3] | 刘婧, 付小梅, 吴建华, 等. 中药治疗老年痴呆的研究进展[J]. 中国医药科学, 2014, 4(11):43-46. |
| [4] | 倪嘉缵, 陈平, 刘琼, 等. 阿尔茨海默病的防治策略研究进展[J]. 深圳大学学报, 2013, 30(4):331-348. |
| [5] | 叶居新, 何池全. 一种净化水体的植物——石菖蒲[J]. 植物杂志, 1996, 23(1):10-11. |
| [6] | 吴启端, 吴清和. 石菖蒲的药理研究进展[J]. 中药新药与临床药理, 2006, 17(6):477-480. |
| [7] | 胡增峣, 黄晏, 刘港, 等. 中药复方治疗老年痴呆的用药规律分析[J]. 中药药理与临床, 2012, 28(5):252-256. |
| [8] | 林晨, 安红梅, 石菖蒲的中枢神经系统药理作用研究[J]. 长春中医药大学学报, 2014, 30(2):230-233. |
| [9] | Coleman P D, Yao P J. Synaptic slaughter in Alzheimer's disease[J]. Neurobiol Aging, 2003, 24(8):1023-1027. |
| [10] | 田素民, 马宇昕, 孙灵芝, 等. 石菖蒲不同药效部位改善阿尔茨海默病模型小鼠的认知功能[J]. 中国病理生理杂志, 2012, 28(1):159-162. |
| [11] | 马宇昕, 李国营, 孙灵芝, 等. 石菖蒲不同提取部位对β淀粉样蛋白致学习记忆障碍模型小鼠的影响[J]. 神经解剖学杂志, 2011, 27(5):521-526. |
| [12] | Geng Y, Li C, Liu J, et al. Beta-asarone improves cognitive function by suppressing neuronal apoptosis in the beta-amyloid hippocampus injection rats[J]. Biol Pharm Bull, 2010, 33(5):836-843. |
| [13] | 张春霞, 郭俊和, 陈云波, 等. 石菖蒲活性成分对双转基因小鼠APP及神经突触超微结构的影响[J]. 中药新药与临床药理, 2014, 25(1):18-23. |
| [14] | Li Z, Zhao G, Qian S, et al. Cerebrovascular protection of β-asarone in Alzheimer's disease rats:A behavioral, cerebral blood flow, biochemical and genic study[J]. J Ethnopharmacol, 2012, 144(2):305-312. |
| [15] | 顾丰华, 陈嘉, 许海燕, 等. 石菖蒲水提取物SIPI-SCPd改善动物学习记忆的研究[J]. 世界临床药物, 2012, 33(3):150-155. |
| [16] | 杨天鹏, 唐敏, 刘巧琼, 等. 丁香酚通过嗅觉通路改善昆明鼠学习记忆的机制[J]. 中国康复医学杂志, 2007, 22(6):487-489. |
| [17] | Dhivya P, Sobiya M, Selvamani P, et al. An approach to Alzheimer's disease treatment with cholinesterase inhibitory activity from various plant species[J]. Int J Pharm Technol Res, 2014, 6(5):1450-1467. |
| [18] | Mathew M, Subramanian S. In vitro screening for anticholinesterase and antioxidant activity of methanolic extracts of ayurvedic medicinal plants used for cognitive disorders[J]. PLoS One, 2014, 9(1):e86804. |
| [19] | 金虹, 徐国波, 黄毅. 石菖蒲抑酶活性的实验研究[J]. 时珍国医国药, 2009, 20(3):2241-2242. |
| [20] | 吴宾, 方永奇. 石菖蒲益智作用的物质基础及其机理研究[J]. 中医药学刊, 2004, 22(9):1635-1636. |
| [21] | Wirths O, Multhaup G, Bayer T A. A modified β-amyloid hypothesis:intraneuronal accumulation of the β-amyloid peptide-the first step of a fatal cascade[J]. J Neurochem, 2004, 91(3):513-520. |
| [22] | Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J]. Science, 2002, 297(5580):353-356. |
| [23] | Lester-Coll N, Rivera E J, Soscia S J, et al. Intracerebral streptozotocin model of type 3 diabetes:relevance to sporadic Alzheimer's disease[J]. J Alzheimer's Dis, 2006, 9(1):13-33. |
| [24] | 弓淑娟, 张连巍, 张敏. 神经元谷氨酸转运体的研究进展[J]. 中风与神经疾病杂志, 2012, 29(5):469-472. |
| [25] | Beart P, O'shea R. Transporters for L-glutamate:An update on their molecular pharmacology and pathological involvement[J]. Br J Pharmacol, 2007, 150(1):5-17. |
| [26] | Gu Q, Du H, Ma C, et al. Effects of α-asarone on the glutamate transporter EAAC1 in xenopus ocytes[J]. Planta Med, 2009, 75(1):1-4. |
| [27] | Fusco D, Colloca G, Monaco M R L, et al. Effects of antioxidant supplementation on the aging process[J]. Clin Intervent Aging, 2007, 2(3):377-387. |
| [28] | Subbarao K V, Richardson J S, Ang L C. Autopsy samples of Alzheimer's cortex show increased peroxidation in vitro[J]. J Neurochem, 1990, 55(1):342-345. |
| [29] | Smith M A, Harris P L, Sayre L M, et al. Iron accumulation in Alzheimer disease is a source of redox-generated free radicals[J]. Proceed Nat Acad Sci, 1997, 94(18):9866-9868. |
| [30] | Acuña U M, Atha D E, Ma J, et al. Antioxidant capacities of ten edible North American plants[J]. Phytother Res, 2002, 16(1):63-65. |
| [31] | Yang Y X, Chen Y T, Zhou X J, et al. Beta-asarone, a major component of Acorus tatarinowii Schott, attenuates focal cerebral ischemia induced by middle cerebral artery occlusion in rats[J]. BMC Complement Altern Med, 2013, 13(1):1-6. |
| [32] | 唐洪梅, 招荣鑑, 邓玉群. 石菖蒲挥发油和水溶性成分对癫痫小鼠脑组织SOD、LPO、NO的影响[J]. 中国药师, 2005, 12(8):983-985. |
| [33] | Ou H C, Chou F I, Lin T M, et al. Protective effects ofeugenol against oxidized LDL-induced cytotoxicity and adhe-sion molecule expression in endothelial cells[J]. Food Chem Toxicol, 2006, 44(9):1485-1495. |
| [34] | 江湧, 方永奇, 邹衍衍. β-细辛醚对痴呆小鼠学习记忆能力及SOD、GSH-Px和MDA水平的影响[J]. 中国老年学杂志, 2007(12):1126-1127. |
| [35] | 王淑英. 老年痴呆的发病机理及药物治疗进展[J]. 洛阳医专学报, 2002, 20(3):266-268. |
| [36] | Fu S, Fang R, Fang G, et al. Effects of beta-asarone on expression of FOS and GAD65 in cortex of epileptic rat induced by penicillin[J]. 中药材, 2008, 31(1):79-81. |
| [37] | Zou D J, Wang G, Liu J C, et al. Beta-asarone attenuates beta-amyloid-induced apoptosis through the inhibition of the activation of apoptosis signal-regulating kinase 1 in SH-SY5Y cells[J]. Die Pharmazie-An Int J Pharm Sci, 2011, 66(1):44-51. |
| [38] | Liu J C, Li C C, Xing G H, et al. Beta-asarone attenuates neuronal apoptosis induced by Beta amyloid in rat hippocampus[J]. Yakugaku Zasshi, 2010, 130(5):737-746. |
| [39] | Li C, Xing G, Dong M, et al. Beta-asarone protection against beta-amyloid-induced neurotoxicity in PC12 cells via JNK signaling and modulation of Bcl-2 family proteins[J]. Eur J Pharmacol, 2010, 635(1):96-102. |
| [40] | Wei G, Chen Y B, Chen D F, et al. β-asarone inhibits neuronal apoptosis via the CaMKⅡ/CREB/Bcl-2 signaling pathway in an in vitro model and AβPP/PS1 mice[J]. J Alzheimers Dis, 2013, 33(3):863-880. |
| [41] | An H M, Li G W, Lin C, et al. Acorus tatarinowii Schott extract protects PC12 cells from amyloidinduced neurotoxicity[J]. Die Pharmazie-An Int J Pharm Sci, 2014, 69(5):391-395. |
| [42] | 杨立彬, 李树蕾, 黄艳智, 等. 石菖蒲及其有效成分A-细辛醚对癫痫幼鼠脑海马神经元凋亡的影响[J]. 中草药, 2006, 37(8):1196-1199. |
| [43] | Irie Y, Keung W M. Rhizoma acori graminei and its active principles protect PC-12 cells from the toxic effect of amyloid-β peptide[J]. Brain Res, 2003, 963(1):282-289. |
| [44] | Booth L A, Tavallai S, Hamed H A, et al. The role of cell signalling in the crosstalk between autophagy and apoptosis[J]. Cell Signal, 2014, 26(3):549-555. |
| [45] | 佳娜提·达吾列提, 姜楠, 寇俊萍, 等. 调节细胞自噬的中药有效成分研究进展[J]. 中草药, 2014, 45(16):2283-2292. |
| [46] | Arroyo D S, Gaviglio E A, Ramos J M. P, et al. Autophagy in inflammation, infection, neurodegeneration and cancer[J]. Int Immunopharmacol, 2014, 18(1):55-65. |
| [47] | 刘知学, 陈洁, 张德翼. 细胞自噬的调控机制及其在老年性痴呆发生发展中的作用[J]. 生物化学与生物物理进展, 2012, 39(8):726-733. |
| [48] | 苏方, 张培, 姜治伟, 等. 海马神经元缺血/再灌注后自噬的表达及其作用[J]. 中国应用生理学杂志, 2011, 27(2):187-191. |
| [49] | Mo Z T, Fang Y Q, He Y P, et al. β-Asarone protects PC12 cells against OGD/R-induced injury via attenuating Beclin-1-dependent autophagy[J]. Acta Pharmacol Sin, 2012, 33(6):737-742. |
| [50] | Xue Z, Guo Y, Zhang S, et al. Beta-asarone attenuates amyloid beta-induced autophagy via Akt/mTOR pathway in PC12 cells[J]. Eur J Pharmacol, 2014, 741:195-204. |
| [51] | Liu L, Fang Y Q, Xue Z F, et al. Beta-asarone attenuates ischemia-reperfusion-induced autophagy in rat brains via modulating JNK, p-JNK, Bcl-2 and Beclin 1[J]. Eur J Pharmacol, 2012, 680(1):34-40. |
| [52] | Dai J P, Zhao X F, Zeng J, et al. Drug screening for autophagy inhibitors based on the dissociation of Beclin1-Bcl2 complex using BiFC technique and mechanism of eugenol on anti-influenza A virus activity[J]. PLoS One, 2013, 8(4):e61026. |
| [53] | Hock C, Heese K, Hulette C, et al. Region-specific neurotrophin imbalances in Alzheimer disease:decreased levels of brain-derived neurotrophic factor and increased levels of nerve growth factor in hippocampus and cortical areas[J]. Archiv Neurol, 2000, 57(6):846-851. |
| [54] | Kunugi H, Ueki A, Otsuka M, et al. A novel polymorphism of the brain-derived neurotrophic factor(BDNF) gene associated with late-onset Alzheimer's disease[J]. Mol Psychiatry, 2001, 6(1):83-86. |
| [55] | 徐凯, 卫东锋, 张仰君, 等. 知母及其提取物改善学习记忆和治疗阿尔茨海默病研究进展[J]. 中国中医药信息杂志, 2014, 21(6):132-136. |
| [56] | Limón I D, Mendieta L, Díaz A, et al. Neuroprotective effect of alpha-asarone on spatial memory and nitric oxide levels in rats injected with amyloid-β(25-35)[J]. Neurosci Lett, 2009, 453(2):98-103. |
| [57] | 刘扬俊, 邱腾颖. 石菖蒲微波水提液的抗炎及体外抗菌作用研究[J]. 海峡药学, 2012, 24(6):22-23. |
| [58] | 吴晶晶, 黄开远, 黎晖, 等. β-细辛醚抑制核转录因子Kappa B表达[J]. 解剖学研究, 2012, 34(2):104-106. |
| [59] | 陶莉, 望运玲, 武双婵, 等. 丁香酚对大鼠局灶性脑缺血/再灌注神经保护作用的研究[J]. 中国药理学通报, 2013, 29(8):1146-1150. |
| [60] | 江湧, 方永奇, 何玉萍. 石菖蒲有效成分配伍对Aβ损伤PC12细胞的保护作用[J]. 中药新药与临床药理, 2006, 17(5):335-338. |
| [61] | 殷明. 阿尔茨海默病治疗药物研发全面受挫及其思考[J]. 药学学报, 2014, 49(6):757-763. |
| [62] | Liu L, Fang Y Q. Analysis of the distribution of β-asarone in rat hippocampus, brainstem, cortex and cerebellum with gas chromatography-mass spectrometry(GC-MS)[J]. J Med Plants Res, 2011, 5(9):1728-1734. |
| [63] | 段灿灿, 许建阳, 陈牛艳, 等. 益智饮对阿尔茨海默病大鼠学习记忆能力的影响及抗氧化作用[J]. 中国实验方剂学杂志, 2010, 16(5):135-138. |
| [64] | 田会娟. 石菖蒲组分配伍治疗鹅膏蕈氨酸致痴呆大鼠的药效学研究[D]. 广州:广州中医药大学, 2012. |
| [65] | 姜静, 邓扬鸥, 杨丽. β-细辛醚, 丁香酚和远志皂苷对Aβ25-35神经细胞毒性的保护作用[J]. 中药药理与临床, 2012, 28(5):25-28. |
| [66] | Hu B, Zhang H, Meng X, et al. Aloe-emodin from rhubarb(Rheum rhabarbarum) inhibits lipopolysaccharide- induced inflammatory responses in RAW264. 7 macrophages[J]. J Ethnopharmacol, 2014, 153(3):846-853. |
| [67] | 张博, 黄树明. 开心散治疗老年性痴呆的研究进展[J]. 中药药理与临床, 2013, 29(3):193-196. |
| [68] | 林慧光, 杜建, 张亮亮, 等. 石菖蒲挥发油香熏辅助治疗老年性痴呆大鼠的实验研究[J]. 福建中医学院学报, 2007, 17(4):25-27. |
| [69] | 应侠, 吴振, 雷严, 等. 阿尔茨海默病的发病机制及治疗药物研究进展[J]. 中国药房, 2014, 25(33):3152-3155. |
 2016, Vol. 47
2016, Vol. 47


