决明子Cassiae Semen为豆科(Leguminosae)决明属Senna L.的钝叶决明S. obtusifoliaL. 或小决明S. tora L.的干燥成熟种子,有清热明目、润肠通便、降血压、调血脂、保肝等诸多功效[1],是我国重要的中药材[2],多分布于非洲、美洲及亚洲,在我国主要分布于长江以南[3]。决明子主要来源于野生资源和人工栽培,其中,野生资源越来越少,人工栽培品质不断下降,使得决明的产量降低,为了满足临床应用及生活需求,有必要探究提高决明产量和品质的新方法,其中创造新材料和选育决明新品种是根本。
花药培养是利用组织培养技术,将发育到一定阶段的花药通过无菌操作技术,接种在人工培养基上,以改变花药内花粉粒的发育程序,诱导其分化,并连续进行有丝分裂形成细胞团,进而形成无分化的愈伤组织,或分化成胚状体,随后使愈伤组织分化成完整植株。花药培养在植物离体培养中占有重要地位,随着1964年首次利用曼陀罗花药培养得到单倍体植株后,近年来在烟草、水稻、玉米、油菜等作物中也取得突破进展[4]。花药培养是获得纯合体和单倍体的有效途径,通过花药培养可以有效缩短育种年限、克服远缘杂交不亲和、获得优良性状等。因此,近年来花药培养应用越来越普遍。王鐠等[5]以决明胚轴、子叶为外植体诱导愈伤组织;刘正兰等[6]以决明试管苗茎段为外植体诱导愈伤组织;黄凤兰等[7]以决明子无菌苗的茎段和叶片为外植体诱导愈伤组织。目前尚未有决明花药培养诱导愈伤组织的报道。本实验通过观察决明花粉粒形态、测定花粉活力、确定花粉萌发条件、了解小孢子发育时期的形态特征,建立决明花药培养及其愈伤组织增殖培养体系,为决明单倍体育种奠定了基础。
1 材料与仪器 1.1 材料贵州遵义引进栽培决明,经西南大学植物教研室杨晓红教授鉴定的田间栽培钝叶决明Senna obtusifolia L.。卡诺氏固定液、乙醇、盐酸、冰醋酸、饱和对二氯苯、卡宝品红染色液、蔗糖、硼酸、琼脂粉、6-BA、NAA、2,4-D、IAA、GA3、PDA培养基、MS培养基。
1.2 仪器GXZ-300C智能光照培养箱(宁波东南仪器有限公司)、YXQ-LS-50SII立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)、NiKon eclipse e600光学显微镜。
2 方法 2.1 钝叶决明花粉粒的形态观察上午8点摘取田间栽培钝叶决明盛花期的花蕾,将不同大小(主要是纵径大小,横径差异不大)的花蕾按大小分开,取各等级(每隔0.1 cm为一个等级)的部分花蕾用卡诺氏固定液固定24 h,转移到70%乙醇,0~4 ℃冰箱中保存。取花蕾中的花药一枚,放置载玻片上,用解剖刀将其从中间划开,用镊子挤压花药,将花粉粒挤出,放置显微镜下观察。另一部分用于测定花粉活力。
2.2 钝叶决明花粉活力的测定采用I2-KI染色法。称取2 g KI加1 g I2溶于200 mL蒸馏水中配制染液,剥取不同大小花蕾中的一枚花药,放置载玻片上,用镊子挤压花药,压出花粉,制成涂抹片,滴1~2滴染液,放置5 min,显微镜下观察,染成蓝色的花粉代表有活性,褐色的则没有活性。重复3次,统计花粉活力。
2.3 钝叶决明花粉粒萌发最适条件 2.3.1 培养液的确定实验配制6种液体培养液,分别为5%蔗糖、10%蔗糖、15%蔗糖、1%硼酸+5%蔗糖、1%硼酸+10%蔗糖、1%硼酸+15%蔗糖。分别观测决明花粉的萌发率,以确定钝叶决明花粉萌发的最适培养液。
2.3.2 萌发时间的确定决明花粉在确定的最佳培养液上培养,每隔0.5 h观察统计花粉的萌发率,以确定钝叶决明花粉萌发的最适时间。
2.3.3 萌发温度的确定将钝叶决明花粉分别在20、25、30 ℃培养箱中培养3 h后镜检,统计花粉萌发率,以确定钝叶决明花粉萌发的最适温度。
2.4 小孢子发育时期的鉴定摘取钝叶决明盛花期不同大小的花蕾,测量花蕾的纵径,每隔0.1 cm为一等级,取各等级花蕾10~20个,观察花瓣、花药的颜色。用卡诺氏固定液固定花药20 min以上,转入70%乙醇保存,采用醋酸洋红染色-花药涂抹制片法制片,镜检观察,确定小孢子发育时期。
2.5 钝叶决明花药培养、愈伤组织诱导与增殖培养取小孢子发育处于单核靠边期的花蕾,在流水下冲洗干净,转至超净工作台用75%乙醇表面灭菌30 s,无菌水冲洗2次,再用0.1%的升汞灭菌10 min,然后用无菌水冲洗3~4次,最后用无菌滤纸吸干表面水分,剥出花药接种在经高压灭菌的MS培养基上,每个培养皿接种10个花药,接种完成后,将培养皿置于培养箱中培养,隔天观察花药的变化。蔗糖质量分数也是培养基的重要组成部分,实验设置1%~5% 5个不同质量分数的蔗糖,比较不同蔗糖质量分数对花药诱导的影响,确定培养基组成中最适蔗糖质量分数。张绿萍等[8]研究结果表明NAA是影响刺梨花药愈伤组织诱导的主要因子,添加6-BA可以促进花药愈伤组织的诱导。本实验分别设置0.5、1.0、2.0 mg/L 3个质量浓度,将NAA和6-BA进行组合,比较其不同激素配比对花药诱导的影响,从而确定诱导培养基的最适激素配比。诱导阶段各处理重复3次,培养条件均为25 ℃,暗培养30 d后转入光培养10 d后,统计诱愈率。
将诱导的愈伤组织转移到经高压灭菌的增殖培养基上,置于培养箱中培养。本实验采用王鐠等[5]发现的生长调节剂组合与质量浓度,制作增殖培养基。增殖条件为25 ℃,每天光照12 h,光照强度2 000 lx。
2.6 愈伤组织倍性鉴定实验参照高玉红等[9]方法,取继代增殖5~8 d的颗粒状愈伤组织,用饱和对二氯苯预处理20 h(4 ℃);转移到卡诺氏固定液中固定24 h;用1 mol/L盐酸和45%冰醋酸(1∶1)的混合液,在室温下解离2 min后低渗10 min;用无离子水冲洗3~4次;然后用改良苯酚品红染色30~60 min;再用45%冰醋酸进行分色压片。
3 结果与分析 3.1 钝叶决明花粉粒形态及萌发特征显微观察表明,决明子花粉粒呈椭球型,具有3条萌发沟,呈立体三角锥状。大多数情况下,花粉呈2孔萌发(图 1-d),少数情况呈单孔萌发(图 1-c)和3孔萌发(图 1-e),还发现了5孔萌发(图 1-f),但数量极少。
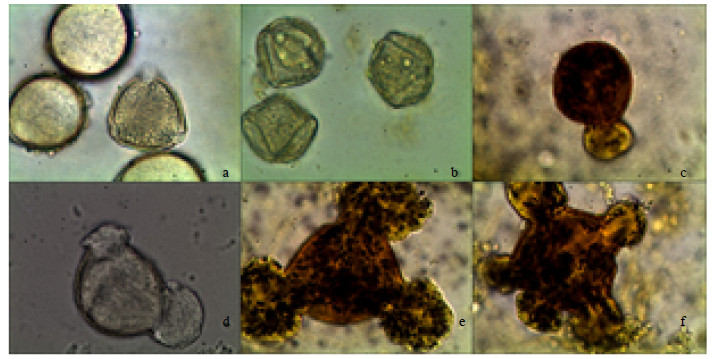 |
a、b-花粉的形态 c-单孔萌发 d-2孔萌发 e-3孔萌发 f-5孔萌发 a, b-pollen morphology c-single-hole germination d-double-hole germination e-three-hole germination f-five-hole germination 图 1 花粉的形态和萌发类型Fig.1 Pollen morphology and type of germination |
观察发现,花蕾纵径1.0~1.1 cm时的花粉活力最大,结果见表 1。
| 表 1 I2-KI染色下花粉的活力 Table 1 Pollen viability under I2-KI staining |
通过观察钝叶决明花粉在5%、10%和15%蔗糖和有无硼酸(1%)的培养液上培养1 h的萌发情况,发现在10%蔗糖+1%硼酸的培养液上萌发率最高,在5%蔗糖的培养液上萌发率最低(图 2)。在硼酸质量分数相等的培养液上,钝叶决明花粉在10%蔗糖的培养液上比5%和15%蔗糖培养液上的萌发率高;在蔗糖质量浓度相同的培养液上,钝叶决明花粉在添加硼酸培养液上的萌发率高于不添加硼酸的培养液,说明硼酸能够促进花粉的萌发。
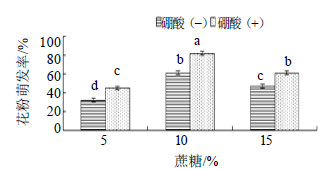 | 图 2 不同培养液上花粉的萌发率Fig.2 Pollen germination rates at different media |
钝叶决明花粉的活力很强,随着时间的推移,花粉的萌发率不断增加,在第3小时花粉的萌发率达到最大,为85%(图 3),3 h之后,随着时间的延长花粉萌发率没有显著变化,花粉的萌发率趋于平稳,且花粉管生长速度过快,交叉在一起(图 4-d),不便于花粉萌发率的计算。有活力的花粉在前3 h基本萌发完毕,不再随着时间的推移而变化,因此,前3 h是花粉萌发的最适时间。
 | 图 3 不同时间花粉的萌发率Fig.3 Pollen germination ratesat different time |
 |
a-单萌发管 b-双萌发管 c-培养3 h d-培养3 h后 a-single-tube germination b-double-tube germination c-cultured for 3 h d-cultured after 3 h 图 4 花粉的萌发Fig.4 Pollen germination |
不同培养温度下花粉的萌发率不同,花粉在20、25、30 ℃培养箱中培养3 h后观察并计算花粉的萌发率,在25 ℃时花粉的萌发率最大(表 2)。因此25 ℃是花粉的最适萌发温度。
| 表 2 温度对花粉萌发的影响 Table 2 Effect of temperature on pollen germination |
在观察过程中发现钝叶决明发育是连续的,但具有不同步性,同一花药中有可能出现不同发育时期的小孢子,因此,以占所有时期60%以上作为主要时期[10],记录其花蕾的纵径及花瓣和花药颜色特征,以便确定小孢子发育时期为单核靠边期时,花器的形态特征。
通过观察发现,小孢子处于单核靠边期时(图 5),花蕾纵径为0.9~1.1 cm,花瓣呈浅黄绿色,生长紧凑,花药呈浅绿色。
 |
a-单核靠边期 b-双核期 a-late uninucleate stage b-binucleate stage 图 5 小孢子发育时期Fig.5 Microspore developmental stages |
除生长调节剂外,蔗糖质量分数也是影响植物组织培养的重要因素。一方面蔗糖作为培养物的可用碳源,对细胞的生长有重要的作用;另一方面蔗糖质量分数也是影响培养基渗透压的主要因素。当蔗糖质量分数为3%时,诱愈率最高。蔗糖质量分数对钝叶决明花药愈伤组织的诱导效应见图 6。
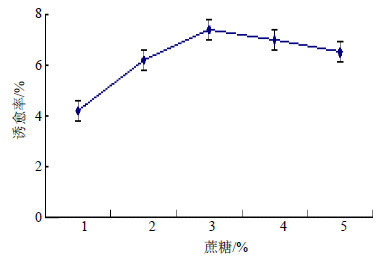 | 图 6 蔗糖质量分数对钝叶决明花药诱愈率的效应Fig.6 Effects of sucrose concentration on callus-inducing rate of S. obtusifolia anthers |
不同质量浓度的NAA和6-BA组合试验结果表明,NAA的最优水平是2mg/L,6-BA的最优水平是1 mg/L。处理8的诱愈率最高,达40%(表 3)。
| 表 3 NAA和6-BA对花药诱愈率的影响 Table 3 Effects of NAA and 6-BA on callus-inducing rate of S. obtusifolia anthers |
上述生长调节剂组合对决明花药愈伤组织诱导的实验表明,钝叶决明花药愈伤组织诱导的最佳生长调节剂组合为1.0 mg/L 6-BA+2.0 mg/L NAA。因此,本实验确定诱导培养基组成为MS+1.0 mg/L 6-BA+2.0 mg/L NAA+3%蔗糖+0.6%琼脂。王鐠等[5]对决明愈伤组织诱导的研究表明,生长调节剂组合为1.0 mg/L 6-BA+1.0 mg/L IAA+1.0 mg/L 2,4-D+1.0 mg/L GA3时决明愈伤的生长率很高。因此实验采用MS+1.0 mg/L 6-BA+1.0 mg/L IAA+1.0 mg/L 2,4-D+1.0 mg/L GA3+3%蔗糖作为增殖培养基。愈伤组织的生长状况良好,可以用于进一步的分化。
3.8 愈伤组织培养在花药诱导培养中,一般4~5 d内花药仍呈黄色,6~7 d时部分花药体积膨大,在花丝断裂处有淡黄色分泌物。10~12 d时出现分泌物的花药数量增加,15~20 d时花药开始变褐并出现萎缩。25 d左右,小部分花药变成褐色并且干瘪,其中部分花药的花丝断裂处出现黄褐色、不透明、致密的愈伤组织,30 d左右,有的愈伤组织直径可达0.5 cm(图 7),此时即可将其转移到增殖培养基上培养,可得到生长良好的丹绿色的愈伤组织(图 8)。
 |
a-培养4~5 d b-培养6~7 d c-培养10~12 d d-培养15~20 d e、f-培养25~30 d a-cultured for 4—5 d b-cultured for 6—7 d c-cultured for 10—12 d d-cultured for 15—20 d e, f-cultured for 25—30 d 图 7 愈伤组织形成过程Fig.7 Process of callus formation |
 |
a-培养1~2 d b-培养3~6 d c-培养6~10 d a-cultured for 1—2 d b-cultured for 3—6 d c-cultured for 6—10 d 图 8 愈伤组织增殖培养Fig.8 Callus enrichment culture |
将诱导产生的愈伤组织进行染色体倍性鉴定,结合黄靖等[11]对钝叶决明核型的分析初步结果表明,诱导产生的愈伤组织主要包含单倍体和二倍体,其中单倍体占40%,二倍体占50%,假二倍体等占10%。
4 讨论本研究首次对钝叶决明花粉进行了形态观察,表明其花粉呈立体三角锥状并具有三条萌发沟,大多数呈2孔萌发,少数呈单孔、3孔甚至5孔萌发,与双荚决明成熟花粉观察的结果相似[12];I2-KI染色观察表明,花蕾纵径为0.9~1.1 cm时,花粉的活力最高。蔗糖是影响植物组织培养的重要因素,一方面可以提供碳源,另一方面可以调节培养基渗透压,因此不同浓度的蔗糖对花粉的萌发具有不同的作用。杜纪红等[13]认为在培养基中加入硼酸可以提高花粉的萌发率。因此本研究以不同浓度的蔗糖和硼酸配置培养液并确定了决明花粉萌发的最适培养液是10%蔗糖+1%硼酸,以及25 ℃培养1~3 h为最佳萌发期,此结果与王庆等[14]对小叶野决明花粉萌发研究相同。小孢子单核期特别是单核靠边期的确定是单倍体诱导培养的关键。有研究表明,只有发育到某个时期的花粉,才对离体刺激最敏感,容易形成愈伤组织,从而发育成完整植株[15]。例如,红花槐小孢子在单核靠边期时诱导率最高。张子君等[16]对辣椒花药培养诱导胚状体的研究表明,花粉发育时期为单核靠边期。王玉英等[17]在花药培养时对比了各个时期花粉的发育情况,得出大多数植物在单核靠边期时培养效果最好。本研究通过I2-KI染色观察花粉不同时期的发育程度,确定了处于小孢子单核靠边期的花蕾纵径为0.9~1.1 cm;用其进行花药培养,成功得到了决明花药的愈伤组织并进行了增殖。结合花药愈伤组织起源的细胞学观察和愈伤组织的形成过程,陈红等[18]认为,25 d左右花丝断裂处出现的黄褐色、致密的愈伤组织是花药壁及花丝组织诱导而来的二倍体愈伤组织。为进一步说明问题,研究运用改良苯酚品红对愈伤组织进行倍性鉴定,结果表明,愈伤组织中存在倍性分离现象,具有单倍体和二倍体细胞。
本研究未成功诱导愈伤组织产生植株,原因可能是钝叶决明花粉诱导产生的嵌合体愈伤组织可能很顽化,也可能是还没有找到其成苗的诱导分化培养条件。后续研究拟采用不同的分化培养基配方,争取获得钝叶决明花药培养嵌合体植株。本实验为进一步进行钝叶决明花粉单倍体苗诱导和育种奠定了较好的基础。
| [1] | 李素红. 决明毛状根诱导培养体系优化及成分分析[D]. 重庆:西南大学, 2012. |
| [2] | 吕翠婷, 黎海彬, 黎续娥, 等. 中药决明子的研究进展[J]. 食品科技, 2006(8):295-298. |
| [3] | 张春平, 何平, 杜丹丹, 等. 决明种子硬实及萌发特性研究[J]. 中草药, 2010, 41(10):1700-1704. |
| [4] | 王茂良, 冯慧. 花药离体培养研究进展[J]. 北京农学院学报, 2010, 25(3):70-74. |
| [5] | 王鐠, 宋家祥, 付群英. 药用植物决明的愈伤组织诱导与生长增殖的培养条件研究[J]. 中药材, 1977, 28(12):739-742. |
| [6] | 刘正兰, 冯秋平. 培养条件对双荚决明愈伤组织诱导的影响[J]. 亚热带植物科学, 2011, 40(2):44-46. |
| [7] | 黄凤兰, 曾健寒, 布和巴特, 等. 决明子愈伤组织培养[J]. 内蒙古农业科学, 2013(2):25-26. |
| [8] | 张绿萍. 刺梨花药和未受精胚珠离体培养[D]. 贵阳:贵州大学, 2009. |
| [9] | 高玉红, 李胜, 张真, 等. 麻黄愈伤组织诱导及倍性鉴定[J]. 甘肃农业大学学报, 2005, 40(6):737-740 |
| [10] | 李允菲, 王仁涛, 袁存权, 等. 红花槐花药培养最适取材时期及选蕾标准[J]. 西北农林科技大学学报:自然科学版, 2013, 41(8):65-71. |
| [11] | 黄靖, 杨海渝, 苟兴, 等. 钝叶决明核型分析[J]. 西南师范大学学报, 2010, 35(5):144-148. |
| [12] | 李荣林, 王会宁. 双荚决明成熟花粉的超微结构观察[J]. 安徽农业科学, 2011, 39(26):16154-16155. |
| [13] | 杜纪红, 叶正文, 苏明申, 等. 桃花粉离体萌发和花粉管生长特性研究[J]. 西北植物学报, 2011, 31(1):64-71. |
| [14] | 王庆, 刘安成, 张瑞博, 等. 小叶野决明花粉萌发与低温储藏研究[J]. 西北农业学报, 2010, 19(4):165-168. |
| [15] | 谢丛华, 柳俊. 植物细胞工程[M]. 北京:高等教育出版社, 2004. |
| [16] | 张子君, 徐矿红, 田云, 等. 辣椒花药培养诱导胚状体成苗[J]. 辽宁农业科学, 2004(4):43-45. |
| [17] | 王玉英, 李春玲, 蒋钟仁. 辣椒和甜椒花药培养的新进展[J]. 园艺学报, 1981, 8(2):41-45. |
| [18] | 陈红, 张绿萍. 刺梨花药愈伤组织起源与倍性检测[J]. 江苏农业科学, 2011, 39(5):49-51. |
 2016, Vol. 47
2016, Vol. 47


