菊花为菊科植物菊花Chrysanthemum morifolium Ramat. 的干燥头状花序,具有疏风清热、平肝名目、清热解毒之功效[1, 2]。杭菊Chrysanthemum morifolium Ramat. cv. ‘Hangju’ 是药用菊花的主要栽培类型之一[3],主要化学成分包括黄酮类、挥发油类、绿原酸类等[4]。黄酮类化合物(flavonoids)是一类来自于丙二酰辅酶A和苯丙氨酸次生代谢产物[5],广泛分布于植物界,对植物的生长、发育、开花、结果以及抗菌防病起重要作用[6]。其中,花青素是一类水溶性天然色素,广泛存在于植物界[7]。它不仅控制植物花、果皮等的颜色,同时具有抗衰老、抗氧化、抗动脉硬化等作用,是目前发现的最强的自由基清除剂[8, 9]。二氢黄酮醇还原酶(dihydroflavonol 4-reductase,DFR)是花青素合成过程的关键酶,催化二氢黄酮醇,如二氢堪非醇、二氢榭皮素和二氢杨梅素分别生成无色天竺葵素、无色矢车菊素和无色翠雀素[10]。目前,对DFR基因研究集中在园艺植物花色或果实颜色等相关问题,对药用植物品质形成相关研究比较少见。而对杭菊的研究多集中在生理、化学、种质资源及组织培养等方面[2, 11, 12, 13, 14, 15],对遗传特征与品质形成关系研究尚停留在初步探索阶段,尚未见杭菊DFR基因相关报道。本实验采用RT-PCR扩增法从杭菊头状花序中克隆得到杭菊DFR基因,并对其表达量特征进行分析,为进一步进行该基因在杭菊中表达与催化产物的关系和调控机制研究奠定基础。
1 材料实验材料采自于浙江桐乡药用菊花种质圃,于2014年6月定植于南京农业大学药用菊花种质圃,经南京农业大学中药材研究所郭巧生教授鉴定为药用菊花栽培类型杭菊Chrysanthemum morifolium cv. ‘Hangju’;自花芽分化开始每隔10 d取1次样品,直到花蕾膨大成熟;参照郭巧生等[16]药用菊花头状花序开放程度标准(表 1),将杭菊开花期分为4个时期,分别采摘各时期舌状花、管状花和花序托,−80℃保存备用。
|
|
表 1 杭菊头状花序开放程度分级标准 Table 1 Flowering degree standard for capitulum of C. morifolium cv. ‘Hangju’ |
Trizol(Invitrogen);反转录试剂盒、DNA凝胶回收试剂盒、质粒提取试剂盒、pMD-19T Vctor、大肠杆菌感受态细胞(DH5α)、工具酶等(TaKaRa Bio,中国大连);PCR引物(上海立菲生物技术有限公司)。
2 方法 2.1 RNA提取与鉴定利用Trizol法提取总RNA。提取后用琼脂糖凝胶电泳检测RNA的质量,并使用核酸蛋白检测仪检测所提RNA的浓度和纯度。
2.2 cDNA合成和PCR扩增目的片段取10 μL RNA作为模板,按照反转录试剂盒说明书进行反转录得到cDNA第一链。根据GenBank报道的菊花DFR的CDS全序列(GenBank登录号GU324979)设计DRF-1F:5’-ATGAAAGAAGACT-CACCAGCCA-3’和DFR-1R:5’-GGGACTGATAAAT-GGACCAACA-3’;DFR-2F:5’-ACATTGGCGGAGA-AAGCAG-3’和DFR-2R:5’-AAACACATTCCCAG-TCCCG-3’ 2对引物并委托上海立菲生物技术有限公司合成;以cDNA为模板扩增2段目的片段,PCR反应体系为E×Taq 0.2 μL、10×Taq buffer 2 μL、Mg2+(25 mmol/L)2 μL、dNTP(2.5 mmol/L)2 μL、DFR-1F/DFR-2F(10 μmol/L)0.5 μL、DFR-1R/DFR-2R(10 μmol/L)0.5 μL、cDNA模版2 μL、ddH2O 15.8 μL,总体积为25 μL。PCR反应条件:预变性94℃、3 min,94℃变性、30 s,58℃、退火1 min,72℃延伸、90 s,30个循环,72℃补充延伸5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后回收和纯化。
2.3 杭菊DFR基因的克隆将回收的目的片段与pMD-19T Vector载体连接;转化DH5α,含氨苄青霉素LBamp培养基上涂板培养,蓝白斑选择阳性克隆,进行PCR检测后DNA序列测序。
2.4 杭菊DFR基因序列的验证根据测序后拼接的DFR基因全序列设计引物primer3-F: 5’-GACTCACCAGCCATTGTATG-3’和primer3-R: 5’-TCACCAAGTATGCTCTTTGC-3’,以cDNA为模板扩增目的基因,反应条件和反应体系均与“2.2”项相同。扩增产物经琼脂糖凝胶电泳检测后回收纯化;纯化产物经连接、转化后蓝白斑挑取阳性克隆经PCR检测后进行测序。最后将测序结果与拼接结果进行比对。
2.5 生物信息学分析将测序结果拼接得到杭菊DFR基因,在NCBI上进行Blast比对,并与已公开的其他植物DFR基因进行同源性分析,根据完整开放阅读框(ORF)预测氨基酸序列并构建系统进化树。
2.6 杭菊花中DFR基因表达量分析荧光定量PCR(qPCR)分析抗菊花芽分化过程和开花期不同时期舌状花、管状花、花序托的DFR基因表达量。根据杭菊DFR基因设计荧光定量PCR引物primer-F:5’-GACATTATGGAAGGCG-GATT-3’和primer-R:5’-GTGGCAACATGAAACA-CTC-3’进行qPCR,扩增产物长度为85 bp;选择actin作为内参基因,设计引物:primer(actin)-F:5’-ACAACTGCTGAACGGGAAAT-3’和primer(actin)-R:5’-TCATAGACGGCTGGAAAAGG-3’,扩增产物为长度为196 bp。PCR反应体系:SYBR Premix E×TaqTM(2×)10 μL;primer-F和primer-R均为0.4 μL(10 μmol/L);cDNA模板2 μL;ROX Reference Dye(50×)0.4 μL;ddH2O 6.8 μL。以actin作为内参,设3个重复,以ROX作为荧光校正;预变性95℃、30 s后95℃、5 s,60℃、30 s,40个循环;熔解曲线为95℃、15 s,60℃、60 s,95℃、15 s,每升高0.3℃,采集1次荧光信号,重复3次。
3 结果与分析 3.1 杭菊DFR基因cDNA全长克隆利用Trizol法从杭菊中提取总RNA,经凝胶电泳检测结果显示28 S rRNA和18 S rRNA条带清晰(图 1-A)且前者亮度约为后者2倍,说明所提取RNA完整性较好;经核酸蛋白检测仪检测A260/A280值为1.92,A260/A 230值为2.06,说明RNA纯度较高,已达到RT-PCR扩增和qPCR要求。
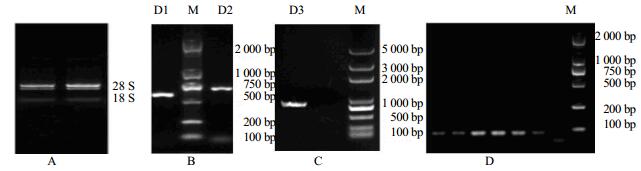 |
M-Marker D1-目的基因片段1 D2-目的基因片段2 D3-目的基因全长 A-杭菊总RNA提取凝胶电泳 B-杭菊DFR基因RT-PCR扩增凝胶电泳 C-杭菊DFR基因全序列PCR扩增的凝胶电泳 D-荧光定量PCR引物特异性验证的琼脂糖凝胶电泳 M-Marker D1-target gene fragment 1 D2-target gene fragment 2 D3-target gene fragment 3 A-agarose gel electrophoresis of total RNA of C. morifolium cv. ‘Hangju’ B-agarose gel electrophoresis of RT-PCRC amplification of DFR gene in C. morifolium cv. ‘Hangju’; C-agarose gel electrophoresis of RT-PCR amplification of full-length sequence of DFR gene in C. morifolium cv. ‘Hangju’; D-agarose gel electrophoresis of specific verification of qPCR primers 图 1 相关电泳图 Fig.1 Related electrophotogram |
根据菊花DFR基因(GenBank登录号:GU324979)的CDS全序列分别设计2对引物,以杭菊cDNA为模板分别进行扩增和测序(图 1-B),将测序结果拼接得到1条全长为1 152 bp的杭菊DFR基因序列。根据已得到的DNA序列设计引物,扩增得到的片段长度为1 152 bp(图 1-C),测序后结果与拼接得到的目的基因完全一致。
3.2 杭菊DFR基因的生物信息学分析已得到的杭菊DFR基因序列在NCBI上进行序列比对分析,发现该序列与菊花DFR基因序列同源性为99%,说明该基因确实为杭菊DFR基因。序列分析表明,该基因包含一个长度为1 029 bp的ORF,共编码342个氨基酸(图 2)。根据在线分析软件(http://web.expasy.org/),该蛋白的相对分子质量约为38 440,理论等电点(pI)为6.09。根据在线分析软件(https://npsa-prabi.ibcp.fr/)预测该蛋白的二级结构,结果表明该蛋白由134个α-螺旋、62个延伸链、36个β-折叠和110个自由卷曲相连接(图 3)。
 |
方框中为起始密码子和终止密码子 Initiation codon and termination codon in boxes 图 2 杭菊DFR基因cDNA序列及预测的氨基酸序列 Fig.2 cDNA sequence of DFR gene in C. morifolium cv. ‘Hangju’ and its predicted amino acid sequence |
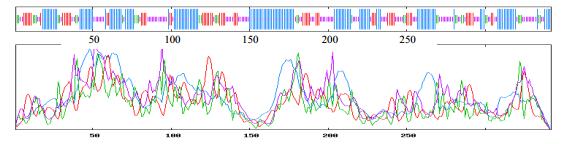 | 图 3 杭菊DFR基因编码氨基酸二级结构预测 Fig.3 Secondary structure prediction of C. morifolium cv. ‘Hangju’ DFR gene |
NCBI在线对杭菊DFR基因编码的氨基酸序列与其他物种DFR基因编码的氨基酸序列进行比对分析,通过MEGA 6.06软件,采用Test Neighbor-Joining法构建系统进化树(图 4)。结果表明,杭菊DFR基因编码氨基酸序列与菊科其他植物DFR基因编码氨基酸序列同源性很高,其中与菊花的DFR基因编码氨基酸序列的同源性高达98%,大丽花Dahila pinnata Cav. 86%,向日葵Helianthus annuus L. 84%;与其他科属植物也有较高的同源性,同源性均在72%~80%。从进化树上可看出杭菊DFR基因编码氨基酸与菊科的菊花、大丽花、向日葵、矢车菊Centaurea maculosa L.、雪莲Saussurea involucrate Kar. et Kir.、红凤菜Gynura bictor DC.、非洲菊Gerbera jamesonii Bolus. 的DFR基因编码氨基酸在进化关系上较近,与其他科属如杜鹃花Rhododendron simsii Planch.、猕猴桃Actinida chinensis Lindl. 等的DFR基因编码氨基酸在进化关系上较远;同科属间进化保守。
 | 图 4 杭菊DFR基因编码的氨基酸序列与其他物种DFR基因编码氨基酸序列构建的进化树 Fig.4 Phylogenetic trees based on amino acid sequences of DFR gene in C. morifolium cv. ‘Hangju’ and other plants |
qPCR分析花芽分化过程的DFR基因相对表达量(图 5),经PCR检测引物特异性良好(图 1-D)。结果表明花芽分化时期,0~20 d DFR基因表达量无明显变化,20~50 d,DFR基因的表达量上调显著;50 d时,DFR基因的表达量达到最高值。qPCR分析开花期不同时期杭菊舌状花、管状花、花序托的DFR基因相对表达量(图 6)。各部位DFR基因表达量在开花期不同时期有差异;同时期花不同部位中DFR基因相对表达量也有差异。其中DFR基因在时期Ⅰ的管状花中的表达量最高,在时期Ⅱ的花序托中表达量最低;DFR基因在管状花中的表达量均高于同一时期在舌状花和花序托中的表达量;DFR基因在花的同一部位的表达量随花期均呈现先降低后增高的趋势,但增高和降低的时间不完全同步。
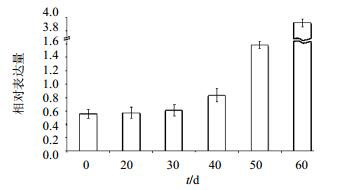 | 图 5 杭菊DFR基因在花芽分化过程的相对表达量 Fig.5 Relative expression of DFR gene in C. morifolium cv. ‘Hangju’ in flower bud differentiation |
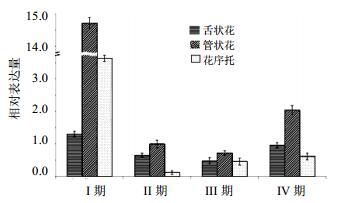 | 图 6 杭菊DFR基因在开花期不同时期不同部位的相对表达量 Fig.6 Expression of DFR gene in C. morifolium cv. ‘Hangju’ in different tissues in different blossom of periods |
花青素作为黄酮类化合物的一种,不仅直接调控植物的花、果实、种子的颜色,同时还有一定的药理作用,如抗肿瘤、降血糖等[17, 18],因此它不仅影响杭菊的外在品质,也影响其内在品质,具有很高的开发利用价值。DFR是DFR超家族中的一条短链还原酶[19],作为花青素代谢途径中的关键酶之一,已经从玉米、金鱼草、拟南芥和矮牵牛等多种植物中克隆得到[20, 21]。本实验通过RT-PCR技术首次克隆得到了杭菊DFR基因的cDNA序列,为今后对杭菊花青素合成代谢途径的深入研究提供了基础。
基因克隆方法包括RT-PCR扩增法、RACE技术及筛选cDNA文库等。RT-PCR扩增法因实验设计简单、易操作、结果稳定、可靠性高而成为首选。许志茹等[22]通过RT-PCR扩增法克隆得到了芜菁DFR基因。袁定阳等[23]利用此方法克隆得到籼稻叶绿素a/b结合蛋白基因全长。因此本实验采用RT-PCR扩增法克隆杭菊DFR基因方法可行、结果可靠。通过基因序列的比对以及编码氨基酸序列的比对,表明该基因进化比较保守,特别是在同科属之间非常保守,这与柳爱玲等[24]的研究结果一致。
qPCR技术被广泛应用于核酸浓度的定量、环境监测、基因转录检测、生物分类和植物病原物鉴测等方面,在医院研究中也用于中药的研究[25]。在研究基因表达量上该技术具有特异性强、灵敏度高、重复性好、定量准确、自动化程度高等优点[26]。本实验通过qPCR技术研究了杭菊花中DFR基因的表达量特征。结果表明DFR基因的表达存在时间和空间上的差异;从花芽开始分化到头状花序完全开放的过程中,杭菊DFR基因在花蕾成熟膨大到舌状花开放30%的时间段内表达量最高;杭菊DFR基因在花芽分化时期主要在成熟膨大的花蕾中表达,而在花芽分化初期表达量较低,开花期则主要在管状花中表达,这些部位都是杭菊的着色部位,由此推测DFR基因可能在植物组织的着色部位表达量较高,这与焦淑珍等[27]的研究结果一致。孟春祥等[28]研究发现光照可诱导非洲菊DFR基因的表达。由此推测杭菊DFR基因在开花期时期Ⅳ的表达量高于时期Ⅱ、时期Ⅲ,可能是由于随着花瓣开放程度的增加,光照面积增加而使DFR基因的表达量升高。而杭菊DFR基因表达量在时期Ⅱ出现显著减少可能与一些内部转录因子有关。各部位DFR基因表达量不完全同步也可能是受到其他环境因素和内部因素的影响。
本实验克隆得到了杭菊DFR基因的序列,证实了该基因在花中表达存在时间和空间差异;研究结果结合相关文献内容推测,杭菊DFR基因表达量可能与着色部位发育过程和光照诱导等因素有关;在花中的表达模式如何受到环境因子和内部因子的调控,DFR基因的表达量又如何影响花青素合成等问题仍需进一步研究。
| [1] | 邵清松,郭巧生,李育川,等. 药用菊花HPLC图谱分析及其模式识别研究[J]. 中草药,2011,42(11): 2330-2334. |
| [2] | 黄莺,王康才,张媛,等. 药用菊花种间杂交及F1代鉴定研究[J]. 中草药,2011,42(4): 783-787. |
| [3] | 中国药典[S]. 一部. 2010. |
| [4] | 邵清松,郭巧生,张志远. 药用菊花种质资源遗传多样性的ISSR分析[J]. 中草药,2009,40(12): 1971-1975. |
| [5] | 汪秋安,周冰,单杨,等. 天然黄酮类化合物的抗氧化活性和提取技术研究进展[J]. 化工生产与技术,2004,11(5): 29-32. |
| [6] | 杨文婷,刘秀明,张雪萌,等. 红花黄酮醇合成酶基因片段的克隆及表达分析[J]. 中草药,2015,46(2): 250-254. |
| [7] | 丁悦,吴秋云,宋勇,等. 植物体内花青素累积的外源调控机制研究进展[J]. 中国农学通报,2014,(19): 86-91. |
| [8] | Springob K,Nakajima J,Yamazaki M,et al. Recent advances in the biosynthesis and accumulation of anthoc-yanins[J]. Nat Prod Rep,2003,20: 288-303. |
| [9] | Bagchi D,Sen C K,Bagchi M,et al. Anti-angiogenic,antioxidant,and anti-carcinogenic properties of a novel anthocyanin-rich berry extract formula[J]. Biochemistry (Mosc),2004,69(1): 75-80. |
| [10] | 郭凤丹,夏晗,袁美,等. 花生二氢黄酮醇还原酶基因(DFR)的克隆及表达分析[J]. 农业生物技术学报,2011,19(5): 816-822. |
| [11] | Shao Q S,Guo Q S,Deng Y M,et al. A comparative analysis of genetic diversity in medicinal Chrysanthemum morifolium based on morphology,ISSR and SRAP makers[J]. Biochem Syst Ecol,2010,38(6): 1160-1169. |
| [12] | Wang T,Zhu Z B,Guo Q S,et al. Variation in major flavonoids glycosides and caffeoylquinic acids during florescence of three Chrysanthemum morifolium Ramat cv. 'Hangju'genotypes[J]. Biochem Syst Ecol,2013,47: 74-79. |
| [13] | Wang T,Guo Q S,Mao P F. Flavonoid accumulation during florescence of three Chrysanthemum morifolium Ramat cv. 'Hangju'genotypes[J]. Biochem Syst Ecol,2014,55: 79-83. |
| [14] | 郭巧生,王涛,程俐陶,等. 不同栽培类型药用菊花黄酮类成分比较分析[J]. 中国中药杂志,2008,33(7)756-759. |
| [15] | 毛鹏飞,郭巧生,汪涛. 药用杭菊扦插育苗技术研究[J]. 中草药,2012,43(8): 1611-1614. |
| [16] | 郭巧生,汪涛,程俐陶,等. 药用菊花不同栽培类型总黄酮动态积累研究[J]. 中国中药杂志,2008,33(11): 1237-1239. |
| [17] | 崔建,李晓岩. 花青素抗肿瘤作用机制研究进展[J]. 食品科学,2014,35(13): 310-315. |
| [18] | 马淑青,吕晓玲,范辉. 紫甘薯花色苷对糖尿病大鼠血糖和血脂的影响[J]. 营养学报,2010,32(1): 88-90. |
| [19] | Martens S,Teeri T,Forkmann G. Heterologous expression of dihydroflavonol 4-reductases from various plants[J]. Febs Lett,2002,531(3): 453-458. |
| [20] | O'Reilly C,Shepherd N S,Pereira A,et al. Molecular cloning of the a1 locus in Zea mays using the transposable elements En and Mul[J]. EMBO J,1985,4(4): 877-882. |
| [21] | 少华,张大生. 花青素生成相关基因DFR研究进展[J]. 福建林学院学报,2002,22(2): 189-192. |
| [22] | 许志茹,刘通,崔国新,等. 芜菁二氢黄酮醇4-还原酶基因的克隆与功能鉴定[J]. 园艺学报,2014,41(4): 687-700. |
| [23] | 袁定阳,余东,谭炎宁,等. RT-PCR克隆籼稻叶绿素a/b结合蛋白基因全长cDNA及序列in silico分析[J]. 基因组学与应用生物学,2012,31(2): 173-177. |
| [24] | 柳爱玲,沈欣杰,刘芸,等. 甜樱桃黄酮醇合酶基因的克隆及其表达分析[J]. 中国农业大学学报,2013,18(2): 56-63. |
| [25] | 付春华,陈孝平,余龙江. 实时荧光定量PCR的应用和进展[J]. 激光生物学报,2005,14(6): 466-471. |
| [26] | 刘小荣,张笠,王勇平. 实时荧光定量PCR技术的理论研究及其医学应用[J]. 中国组织工程研究与临床康复,2010,14(2): 329-332. |
| [27] | 焦淑珍,刘雅莉,娄倩,等. 葡萄风信子二氢黄酮醇4-还原酶基因(DFR)的克隆与表达分析[J]. 农业生物技术学报,2014,22(5): 529-540. |
| [28] | 孟春祥,彭建宗,王小菁. 光和糖对非洲菊花色素苷积累及CHS、DFR基因表达的影响[J]. 园艺学报,2007,34(1): 227-230. |
 2016, Vol. 47
2016, Vol. 47


